肝爽颗粒对肝损伤大鼠的保护作用
2021-10-30白璐马英杰王郁杰
白璐,马英杰,王郁杰
内毒素是指革兰阴性菌细胞壁中的脂多糖,当细菌裂解或是黏附在其他细胞上时会释放脂多糖,脂多糖含量增加会激活体内炎性反应,参与多种疾病进展。机体清除内毒素的主要器官为肝脏,肝脏也最容易受到内毒素诱导损伤,内毒素诱导的肝脏损伤是多种肝脏疾病的基础病理因素。现已有研究显示内毒素诱导的肝脏损伤可以激活多种介导炎症反应的信号通路,表明炎症反应是肝脏组织损伤的重要病理机制。TLR4/NF-кB 信号通路为重要的介导炎症反应的重要信号通路之一,在诱导细胞炎症反应、增加炎性因子水平的过程中具有重要作用,通过抑制该信号通路的传递,能够明显降低机体组织细胞的炎症反应进程。肝爽颗粒主要是由党参、柴胡、白芍、当归、茯苓、白术、枳壳、蒲公英、虎杖、夏枯草、丹参、桃仁、鳖甲组成,具有疏肝健脾、清热散淤、保肝护肝、软坚散结的作用,多用于急慢性肝炎、肝硬化以及肝功能损伤临床治疗。肝爽颗粒对肝组织损伤有明显减轻作用,同时还体现出保肝抗炎的功效,能够抑制mTOR信号通路,抑制肝星状细胞活性,实现抗肝纤维化的功能。肝爽颗粒对肝损伤的保护作用是否可以通过影响TLR4/NF-кB 信号通路传递来发挥其功能,尚不清楚。因此,本研究自2019 年5―10 月通过肝损伤大鼠模型来探索肝爽颗粒对其可能存在的作用机制,为肝爽颗粒用药提供实验依据。
1 材料与方法
1.1 试剂及仪器
肝爽颗粒(保定天浩制药有限公司,批号Z20027671)、LPS(L4391)、D-GalN(G0500)均购于美国Sigma 公司,白介素-1β(IL-1β)酶联免疫吸附剂测定(ELISA)试剂盒(YAD23684S,北京杰辉博高生物技术有限公司),谷胱甘肽过氧化物酶(GSH-Px)ELISA 试剂盒(SBJ-R0785,南京森贝伽生物科技有限公司),白介素-6(IL-6)ELISA 试剂盒(JK-a-0023)、超氧化物歧化酶(SOD)ELISA 试剂盒[JK-(a)-1752)均购于上海晶抗生物工程有限公司],肿瘤坏死因子-α(TNF-α)ELISA 试剂盒(QYBM10200,上海乔羽生物科技有限公司),丙二醛(MDA)ELISA 试剂盒(0-100860,上海将来实业股份有限公司),原位末端标记法(TUNEL)凋亡试剂盒(T2190,上海恒斐生物科技有限公司),Bcl-2相关X(Bax)、B细胞淋巴瘤-2(Bcl-2)、TLR4、Myd88、核因子κB(NF-κB)抗体购于武汉博欧特生物科技有限公司。荧光显微镜(DMi8-电动,徕卡),离心机(5430/5430R,Eppendorf),石蜡切片机(Finesse ME+,赛默飞)。
1.2 动物及分组
SPF 级SD 雄性健康大鼠50 只,4~5 周龄,体质量(190±20)g,购于湖南嘉泰实验动物有限公司,生产许可证号SCXK(湘)2015-0006,购回后适应性饲养1 周,培育室温度为20~25 ℃,湿度40%~50%,人工光照昼夜时间各12 h,饮水自由。本研究中对于大鼠的处理符合动物伦理学相关标准。将50 只SD 大鼠采用随机数字表法均分成5 组,分别为对照组、模型组、肝爽颗粒低剂量组、肝爽颗粒中剂量组、肝爽颗粒高剂量组。1.3 实验方法
肝爽颗粒低剂量组、肝爽颗粒中剂量组、肝爽颗粒高剂量组分别灌胃1.8 g/kg、3.6 g/kg、7.2 g/kg 肝爽颗粒,1 次/天,连续灌胃1 周;对照组、模型组灌胃等体积生理盐水,1 次/天,连续灌胃1周,末次给药后1 h,用于肝损伤大鼠模型制备。肝损伤大鼠模型制备方法参考文献,模型制备前禁食12 h,饮水自由,腹腔注射LPS(20 μg/kg)、D-GalN(400 mg/kg),对照组腹腔注射等体积的生理盐水,造模12 h后,进行各指标检测。
1.4 指标检测
腹腔注射LPS(20 μg/kg)、D-GalN(400 mg/kg)12 h 后,麻醉处死大鼠,取出肝脏组织,一部分肝脏组织制备成肝脏匀浆,用于检测肝脏组织中的MDA、SOD、GSH-Px、TNF-α、IL-1β、IL-6 水平;一部分肝脏组织用于细胞凋亡、TLR4/NF-кB 信号通路相关蛋白水平检测。1.5 TUNEL 检测
将已固定好的肝脏组织,经脱水、透明、浸蜡、包埋,5 μm 切片,参考TUNEL 试剂盒说明书步骤进行肝脏组织凋亡检测,在光学显微镜下随机选取5 个不重叠视野,记录100 个细胞中的阳性细胞数目,阳性细胞表现为棕黄色或棕褐色的细胞核,计算出细胞凋亡率,细胞凋亡率=阳性细胞数/细胞总数×100%。1.6 蛋白质印迹法(Western blotting)检测
提取肝脏组织总蛋白,调整蛋白质浓度,经SDS-PAGE 电泳、转移至PVDF 膜,加入Bax、Bcl-2、TLR4、Myd88、NF-κB、β-actin 一抗,于4 ℃条件下孵育过夜,再用TBST 漂洗40 min,分为3 次漂洗,再加入经HRP 标记的二抗继续孵育1 h,根据ECL试剂盒说明书对蛋白条带进行显影、定影,观察各组蛋白条带成像情况,并进行蛋白条带分析。
2 结果
2.1 各组大鼠肝组织凋亡情况比较
取各组大鼠肝脏组织进行TUNEL 检测,比较各组大鼠肝脏组织细胞凋亡率。结果显示,模型组、1.8 g/kg 肝爽颗粒组、3.6 g/kg 肝爽颗粒组、7.2 g/kg 肝爽颗粒组大鼠肝脏组织细胞凋亡率明显高于对照组(P
<0.05);1.8 g/kg 肝爽颗粒组、3.6 g/kg 肝爽颗粒组、7.2 g/kg 肝爽颗粒组大鼠肝脏组织细胞凋亡率均明显低于模型组(P
<0.05),且随着肝爽颗粒剂量逐渐增加,大鼠肝脏组织细胞凋亡率逐渐降低,见图1、表1。
表1 各组大鼠肝脏组织半胱氨酸天冬氨酸蛋白酶3(Cas‑pase-3)、B细胞淋巴瘤-2(Bcl-2)、Bcl-2相关X(Bax)蛋白水平及凋亡率比较/(%,± s)

图1 各组肝脏组织TUNEL检测结果(TUNEL×200):A为对照组;B为模型组;C为1.8 g/kg肝爽颗粒组;D为3.6 g/kg肝爽颗粒组;E为7.2 g/kg肝爽颗粒组
采用Western blotting 检测各组大鼠肝脏组织中Bax、Bcl-2蛋白水平,结果显示,与对照组相比,模型组与1.8 g/kg肝爽颗粒组、3.6 g/kg肝爽颗粒组、7.2 g/kg肝爽颗粒组大鼠肝脏组织中Bax蛋白含量均明显升高(P
<0.05),Bcl-2 蛋白水平均显著降低(P
<0.05);与模型相比1.8 g/kg 肝爽颗粒组、3.6 g/kg 肝爽颗粒组、7.2 g/kg 肝爽颗粒组大鼠肝脏组织中Bax蛋白水平降低(P
<0.05),Bcl-2 蛋白水平升高(P
<0.05),见图2、表1。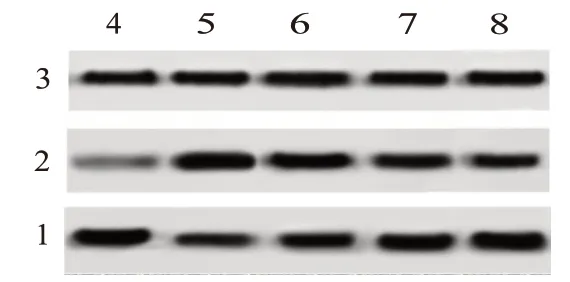
图2 各组肝脏组织半胱氨酸天冬氨酸蛋白酶3(Caspase-3)、Bax、Bcl-2蛋白水平凝胶成像结果
2.2 各组大鼠肝组织MDA、SOD、GSH-Px 水平比较
将各组大鼠肝脏组织制备成肝脏组织匀浆,经离心取上清液,采用ELISA 法检测各组大鼠肝脏组织中MDA、SOD、GSH-Px水平。结果显示,与对照组相比,模型组、1.8 g/kg 肝爽颗粒组、3.6 g/kg 肝爽颗粒组、7.2 g/kg 肝爽颗粒组MDA 含量增加(P
<0.05),SOD、GSH-Px活性降低(P
<0.05);与模型相比,1.8 g/kg 肝爽颗粒组、3.6 g/kg 肝爽颗粒组、7.2 g/kg 肝爽颗粒组MDA 含量降低(P
<0.05),而SOD、GSH-Px 活性升高(P
<0.05),且随着肝爽颗粒给药剂量增加,这种趋势更明显,见表2。
表2 各组大鼠肝脏组织丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)比较/± s
2.3 各组大鼠肝组织TNF-α、IL-1β、IL-6 含量比较
取各组大鼠肝脏组织制备成肝脏组织匀浆,经离心取上清液,采用ELISA 法检测各组大鼠肝脏组织中TNF-α、IL-1β、IL-6 水平。结果显示,与对照组相比,模型组、1.8 g/kg 肝爽颗粒组、3.6 g/kg 肝爽颗粒组、7.2 g/kg肝爽颗粒组TNF-α、IL-1β、IL-6含量均明显增加(P
<0.05);与模型相比,1.8 g/kg 肝爽颗粒组、3.6 g/kg肝爽颗粒组、7.2 g/kg肝爽颗粒组TNF-α、IL-1β、IL-6 含量均明显降低(P
<0.05),且随着肝爽颗粒给药剂量增加,降低趋势更明显,见表3。
表3 各组大鼠肝脏组织肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)、白介素-6(IL-6)含量比较/± s
2.4 肝爽颗粒对肝损伤大鼠TLR4/NF-кB 信号通路的影响
提取各组大鼠肝脏组织总蛋白,采用Western blotting 检测各组组织中的TLR4、MyD88、NF-κB 蛋白水平。结果显示,与对照组相比,模型组、1.8 g/kg 肝爽颗粒组、3.6 g/kg 肝爽颗粒组、7.2 g/kg 肝爽颗粒组TLR4、MyD88、NF-κB 蛋白水平均明显升高(P
<0.05);与模型组相比,1.8 g/kg 肝爽颗粒组、3.6 g/kg 肝爽颗粒组、7.2 g/kg 肝爽颗粒组TLR4、MyD88、NF-κB 蛋白水平均明显降低,且随着肝爽颗粒给药剂量增加,降低趋势更明显,见图3、表4。
表4 各组大鼠肝脏组织TLR4、MyD88、核因子κB(NF-κB)蛋白水平比较/(%,± s)
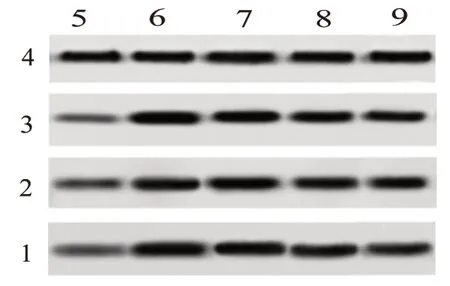
图3 各组肝脏组织TLR4、MyD88、NF-κB蛋白凝胶成像结果
3 讨论
急性肝损伤为多种肝病进展为肝功能衰竭的中间环节,引起急性肝损伤的因素众多,常见因素有肝组织缺氧缺血、代谢异常、中毒及感染等。我国病毒性肝炎患者较多,LSP 是诱导肝损伤的重要因素,能够激活单核巨噬细胞产生大量的炎性因子,使机体组织器官产生损伤。D-GalN 是核苷酸干扰剂,能够阻碍肝脏组织细胞尿苷三磷酸合成,引起肝脏组织炎症反应与组织坏死,降低肝脏对LPS的解毒功能,加重机体肝组织损伤,这点与病毒性肝炎病理特点相似。因此,本研究选择LPS/DGalN腹腔注射来制备急性肝损伤大鼠模型。
Liu 等研究发现肝爽颗粒可以通过抑制小鼠模型中的调节性T细胞对肝硬化的保护作用。本研究发现LPS/D-GalN 可以促进大鼠肝组织凋亡,降低Bcl-2 蛋白水平,增加Bax 蛋白含量,肝爽颗粒预处理可以降低肝损伤大鼠肝组织细胞凋亡率,升高Bcl-2 蛋白水平,降低Bax 蛋白含量。线粒体途径在细胞凋亡途径中具有重要作用,其结构及功能受损,使线粒体膜电位下降,激活Caspase-9,使Cas‑pase-3 蛋白含量增加,加快细胞凋亡。Bcl-2 家族为由线粒体途介导的细胞凋亡的是重要的调节因素,Bcl-2 含量增加可以抑制细胞凋亡,Bax 含量增加促进细胞凋亡。王晶等认为党参水提取物可以稳定D-半乳糖致衰小鼠肝脾结构,降低Bax 蛋白水平,抑制细胞凋亡,对小鼠肝脾组织有明显的保护作用。党参为肝爽颗粒中药组成之一,本研究结果与前人研究结果趋势相似,表明肝爽颗粒对肝损伤大鼠的肝脏组织细胞凋亡有抑制作用,可能是通过促进Bcl-2蛋白表达,抑制Bax蛋白表达有关。
LPS/D-GalN 诱导的急性肝损伤会激活巨噬细胞产生大量炎性因子,还能引起肝组织细胞凋亡。本研究结果显示模型组大鼠肝脏组织细胞凋亡率明显增加,且肝脏组织中的TNF-α、IL-1β、IL-6、MDA 水平升高,SOD、GSH-Px 活性明显减低。SOD活性降低会使细胞膜不饱和双键结构容易受自由基破坏,促进脂质分解产生MDA,引起线粒体膜的通透性发生改变,影响线粒体功能。GSH-Px可以清除活性氧诱导的脂质过氧化物,促进过氧化氢的分解,保护细胞的膜结构及其功能的完整。TNF-α、IL-1β、IL-6 是典型的炎性因子,其水平变化也反映了机体的炎性反应情况。肝爽颗粒中的丹参总酚酸可以对小鼠急性肝损伤有保护作用,可以降低小鼠血清IL-6、TNF-α 水平。柴胡也是肝爽颗粒的中药成分,有研究显示柴胡皂苷-b2 可以降低由四氯化碳引起急性小鼠肝损伤,可以降低小鼠MDA水平,增加SOD 活性,推测其保护肝组织损伤作用机制可能是通过改善氧化应激损伤有关。本研究结果与前人研究结果趋势相似,由此推测肝爽颗粒对大鼠急性肝损害的改善作用,也可能是通过缓解LPS/D-GalN 诱导大鼠的肝组织炎症反应与氧化应激来实现。
肝脏巨噬细胞可以分泌TNF-α、IL-1β、IL-6 炎性因子,TNF-α、IL-1β、IL-6 一方面可以通过作用于肝细胞表面受体,促进肝脏细胞坏死,另一方面还可以激活NF-кB 信号通路,以正反馈方式促进其自身含量增加,进一步加剧肝脏组织损伤。本研究结果显示,由LPS/D-GalN 诱导的急性肝损伤大鼠肝脏组织中TLR4、MyD88、NF-κB 蛋白水平明显增加,而肝爽颗粒可以抑制这种增长趋势。NF-кB信号通路是介导机体肝脏组织炎性反应的重要作用途径,中TLR4、MyD88、NF-κB 在肝脏组织炎性反应中有协同作用。脂多糖可以激活TLR4 信号,激活TLR4下游的MyD88,引起肝脏组织炎性反应并释放炎性因子。MyD88既是TLR4的转接蛋白,又为NF-кB连接蛋白,胞外炎症信号通过TLR4 传递给MyD88,促使MyD88与IRAK4相互作用,使IRAK4磷酸化并作用于TAB-1/TAB-2,激活TAB-1,再接着作用于NF-κB,激活IκB 激酶。在上游信号后刺激后,在IKK 作用下IκB 磷酸化激活,可进一步释放炎性细胞因子,炎性因子含量增加又可进一步激活NF-κB,因此TLR4-MyD88-NF-κB 信号通路在肝脏炎症反应中具有重要作用。李文燕等研究显示樟芝多糖可以通过下调TLR4-MyD88-NF-κB 表达来降低LPS/D-GalN 诱导的肝细胞凋亡以及急性肝损伤,同时在免疫组化实验中也发现肝损伤中NF-кB信号呈现出激活状态。Zhang 等研究显示LPS 低剂量连续预处理可以改善LPS/D-GalN 诱导的急性肝衰竭,起作用机制是通过抑制NF-кB 信号通路活化,从而有助于肝脏抵抗LPS/D-GalN 诱导的肝损伤。本研究结果与前人研究结果相似,由此推测,肝爽颗粒对LPS/D-GalN 诱导的大鼠急性肝损伤的保护作用,可能是通过抑制TLR4/NF-кB 信号通路活化,从而减少大鼠肝组织损伤,降低肝组织炎性反应。
综上所述,肝爽颗粒可能是通过降低Bax 蛋白水平,增加Bcl-2蛋白水平来降低急性肝损伤大鼠肝组织细胞凋亡率;还可以降低肝脏组织TNF-α、IL-1β、IL-6、MDA水平,增强SOD、GSH-Px活性,增强大鼠机体抗氧化应激、抗炎性能力,可能与抑制TLR4/NF-кB 信号通路有关,实现对肝脏组织结构及功能的保护作用。本研究所得结论仅限于大鼠动物实验,其他种类动物或临床上是否具有相似的趋势,还需要进一步研究。
