尾叶香茶菜丙素对肝癌耐药株HepG2/ADM细胞体外活性的影响
2021-10-30王欣玉裴晓东何志龙林佳雯黎永卓陈文卿刘小玲蒋利和
王欣玉,裴晓东,何志龙,林佳雯,黎永卓,陈文卿,刘小玲,蒋利和,3
恶性肿瘤是当今极难治愈的疾病之一,严重地威胁着人类的生命健康,是致死率第二高的疾病。其中肝癌作为第二大致死癌症,仅次于肺癌。目前,我国已成了全球肝癌发病率和死亡率最多的国家,每年肝癌发病约34.7 万人,占到全球的55%,死亡32.3 万人,占全球的45%,晚期肝癌病人只有大约15% 的人适合手术切除,多数病人选择放化疗治疗的方法。目前,化疗药物因其高毒性和耐药性使病人预后较差,祖国传统中药材具有多靶点低毒性的优点,因此人们期待在传统中草药中有应用前景的天然产物。
香茶菜属(Isodon
)植物隶属唇形(Lamiaceae)科罗勒亚科(Ocimoideae),约有30 余种在我国和日本民间被广泛使用,它们大多具有清热解毒、抗炎抗菌及抗肿瘤等作用。其中尾叶香茶菜产于黑龙江、吉林及辽宁等地区,活性成分包括二萜类化合物尾叶香茶菜丙素(Kamebakaurin),尾叶香茶菜丙素对慢性骨髓性白血病(CML)有治疗活性,且对心、肝、脾、肺、肾5 个脏器无副作用,还可减少扑热息痛引起的肝损伤;在抑制肿瘤方面,可通过抑制HIF-1α 蛋白表达抑制结肠癌细胞HCT116 和SNu638 生长。但是在对耐药肿瘤方面还未见文献报道,因此本研究自2018 年11 月至2019 年11 月通过尾叶香茶菜丙素对HepG2/ADM 细胞的生长活力、迁移能力、细胞凋亡和周期的影响和可能机制,初步探明尾叶香茶菜丙素对耐药肝癌的应用潜力。1 材料与方法
1.1 材料与试剂
尾叶香茶菜丙素购买于成都艾法公司,纯度99%;阿霉素购自上海生工,纯度99%。尾叶香茶菜丙素先用DMSO 溶解成200 μmol/L 浓度的母液,使用时用DMEM 稀释。胎牛血清购自美国GIBCO 公司,HepG2/ADM 细胞购自上海中科院细胞库,周期试剂盒购于联科公司,CCK-8 购于MCE 公司,凋亡试剂盒购于BD 生物公司,BCA 蛋白浓度测定试剂盒和蛋白上样缓冲液、RIPA 裂解液、蛋白酶抑制剂均购自索莱宝公司,PCR 引物由上海生工合成。抗体β-Tublin 多克隆抗体(货号10068-1-AP),p-AKT 多克隆抗体(货号66444-1-Ig),MDR1 多克隆抗体(货号22336-1-AP),Bax 多克隆抗体(货号50599-2-Ig),Bcl-2 多克隆抗体(货号12789-1-AP),AKT 多克隆抗体(货号10176-2-AP)GAPDH 多克隆抗体(货号60004-1-Ig),PTEN 多克隆抗体(货号22034-1-AP)均在Proteintech 购买;p-PTEN 单克隆抗体(货号AP0930)购自AbClon生物公司。1.2 仪器与设备
DMI4000B 倒置荧光显微镜购于日本奥林巴斯公司;CO恒温培养箱购自Eppendorf AG;低温离心机购于广州吉迪仪器有限公司;BGPower 300电泳仪产自贝基恩生物科技有限公司。1.3 细胞培养
HepG2/ADM 细胞用含10% 的胎牛血清、100 IU/mL 青霉素、100 mg/L 链霉素的高糖DMEM 完全培养基加入1 μg/mL 的阿霉素培养以保持细胞耐药性,于37 ℃,5% 二氧化碳细胞培养箱内培养。1.4 CCK-8 试剂盒检测HepG2/ADM 细胞增殖活力
取分裂期细胞以5×10/mL接种在96孔板中,每孔100 μL,每个浓度梯度平行设4 个复孔。37 ℃,5% 浓度二氧化碳培养箱中培养24 h,更换用新鲜DMEM 稀释的含尾叶香茶菜丙素培养基或含阿霉素培养基,浓度梯度为培养24 h,后吸出培养基,加入浓度为10% 的含CCK-8 的新鲜的无血清DMEM,培养箱中孵育1 h后用酶标仪在450 nm 波长处测定吸光值。按下列公式计算各组药物对细胞的抑制率(inhibition rate,IR)=(1-药物组OD 值/细胞对照组OD值)×100%。实验重复3次结果取平均值。1.5 细胞周期实验
将HepG2/ADM 细胞接种于六孔板中,密度为5×10个/毫升,生长密度达到70% 时加入混有尾叶香茶菜丙素的新鲜培养基,分为四组:空白组,40 μmol/L 组、60 μmol/L 组、80 μmol/L组。培养24 h后收集细胞加入按1∶100浓度混合的PI 染色缓冲液,每个样本加入500 μL 充分重悬细胞,37 ℃培养箱孵育25 min,上机检测。实验重复3次结果取平均值。1.6 流式细胞仪检测HepG2/ADM 细胞凋亡
分裂期HepG2/ADM 细胞接种于6 孔板中,培养至密度70%后更换新鲜培养基并加入K,浓度分别为0、40、60、80 μmol/L。24 h 后收集细胞并用PBS 洗涤两次,1 200 r/min,3 min。吸出PBS 后每孔加入Bind‑ing Buffer 500 μL 重悬细胞,再加入5 μL Annexin VFITC 混合均匀,最后加入5 μL Propidium IAide。将细胞充分吹打散开后放入培养箱中37 ℃孵育15~30 min,取出后置于冰上,上机测定其凋亡率,重复3次取平均值。1.7 Transwell 小室实验
消化收集分裂期的细胞,通过细胞计数吸取5 000 个细胞加入到小室中,其中上室200 μL 混有细胞的无血清培养基,下室500 μL 含有10% 血清的培养基。24 h 后停止实验,无水乙醇固定10 min,1% 浓度的结晶紫染色10 min,PBS 清洗两次每次8 min,之后进行常光拍照。实验重复3次结果取平均值。1.8 细胞平板划痕实验
细胞接种于6 孔板,密度为5×10个/mL,待生长到密度90% 时用10 μL 白色枪头划线,每组画三条,用PBS清洗两次洗去浮起的细胞,加入混有尾叶香茶菜丙素的无血清培养基,设置四组为空白con 组、尾叶香茶菜丙素40 μmol/L组、60 μmol/L 组、80 μmol/L 组。在0、24、48 h 分别进行拍照记录。1.9 实时荧光定量PCR
尾叶香茶菜丙素处理HepG2/ADM 细胞后24 h 提取RNA,之后RNA 反转为DNA,预变性95 ℃3 min,95 ℃变性10 s,60 ℃退火30 s,95 ℃延伸30 s,总共40 个循环;之后69 ℃终延伸1 min。1.10 蛋白质印迹法(Western blotting)
六孔板中细胞生长在70% 时将培养液换为混有尾叶香茶菜丙素的新鲜培养基,尾叶香茶菜丙素浓度为40 μmol/L、60 μmol/L、80 μmol/L。37 ℃继续培养24 h后吸出旧培养基,PBS 冲洗2 次加入RIPA 裂解液(RIPA∶蛋白酶抑制剂=1∶100),每孔加入200 μL。用细胞刮将细胞刮下后转移至EP 管中4 ℃冰上裂解40 min,每隔10 min 用手指弹管壁使细胞充分裂解。用BCA蛋白浓度试剂盒测定蛋白浓度,加入4X蛋白上样缓冲液沸水煮10 min,上样跑胶,转膜,5%脱脂奶粉或5%BSA 封闭,一抗4 ℃孵育过夜,1%TBST 洗膜3 次,二抗常温孵育70 min,洗膜3 次,上机显色拍照。1.11 统计学方法
采用SPSS 22.0 软件,计量资料采用x ± s,
组间比较采用LSD-t
检验,多组间比较采用单因素方差分析,P
<0.05为差异有统计学意义。2 结果
2.1 尾叶香茶菜丙素可抑制HepG2/ADM 细胞的生长活力
为测定尾叶香茶菜丙素对HepG2/ADM细胞生长活力的影响,使用CCK-8 试剂盒测定,实验显示加入阿霉素浓度达到1.0 mg/mL 时对HepG2/ADM 细胞的抑制率只有26.5%(n
=3),而加入尾叶香茶菜丙素后肝癌细胞HepG2/ADM 细胞生长活力下降明显(图1),说明尾叶香茶菜丙素可抑制HepG2/ADM细胞生长活性且呈浓度依赖性,IC50为(62.97 ±2.81)μmol/L(n
=3)。同时,也表明尾叶香茶菜丙素对耐药ADM 的HepG2 细胞具有抑制作用。
图1 尾叶香茶菜丙素对HepG2/ADM细胞活力的影响(24 h):A为尾叶香茶菜丙素对HepG2/ADM细胞抑制率;B为阿霉素对HepG2/ADM细胞的抑制率
2.2 尾叶香茶菜丙素将HepG2/ADM 细胞周期阻滞在G2 期
通过流式细胞仪测定HepG2/ADM 细胞在增殖不同时期的数目比例分布,结果表明随着尾叶香茶菜丙素浓度,HepG2/ADM 细胞被阻滞到G2 期,G2 期比例在空白组、40 μmol/L、60 μmol/L、80 μmol/L 分别增加(11.883±2.551)% 、(21.756±1.737)% 、(30.152±1.964)% 、(37.024±2.727)%(n
=3),呈现浓度依赖性的趋势(F
=1.821,2.380,2.516,t
=6.189,5.221,4.287,P
=0.041,0.033,0.0017)。2.3 尾叶香茶菜丙素促进HepG2/ADM 细胞凋亡
利用流式细胞术分析不同浓度尾叶香茶菜丙素对细胞凋亡的影响,实验结果显示,在尾叶香茶菜丙素浓度分别为0、40、60、80 μmol/L 时,HepG2/ADM 细胞凋亡率分别为(6.267±1.317)%、(15.10±1.265)%、(19.77±1.963)%、(25.614±2.301)%(n
=3),凋亡率呈递增趋势,说明尾叶香茶菜丙素能诱导HepG2/ADM 细胞凋亡,且呈浓度依赖性。Western blotting 结果显示Bcl-2 家族中促凋亡蛋白Bax 蛋白灰度值在尾叶香茶菜丙素浓度分别为0、40、60、80 μmol/L 时 分 别 为1、(1.24±0.072)、(1.63±0.128)、(2.19±0.183),说明Bax 蛋白表达上升,抑凋亡蛋白Bcl-2 在尾叶香茶菜丙素浓度分别为0、40、60、80 μmol/L 时 别 为1、(0.62±0.049)、(0.36±0.036)、(0.23±0.028),表达下降,显示尾叶香茶菜丙素通过调节Bcl-2家族蛋白表达发挥促凋亡作用(F
=2.057,1.553,5.785,t
=4.757,12.58,10.07,P
=0.0089,0.002,0.005)。见图2。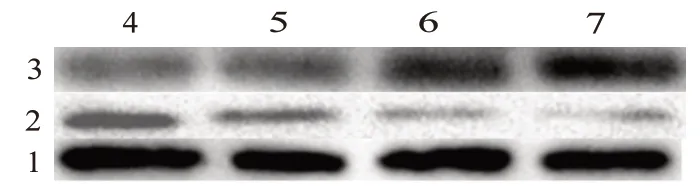
图2 尾叶香茶菜丙素对HepG2/ADM细胞凋亡的促进作用
2.4 尾叶香茶菜丙素抑制HepG2/ADM 细胞迁移
为了研究尾叶香茶菜丙素对HepG2/ADM 细胞迁移的影响,研究进行了Transwell 小室实验和平板划痕愈合实验,发现在K 浓度为0、40、60、80 μmol/L时,穿过膜的细胞数量分别为[(832.56±38.91)、(617.85±26.71)、(436.23±31.52)、(361.69±27.13)]个,在平板划痕愈合实验中发现,24 h时划痕面积在K 浓度为0、40、60、80 μmol/L 分别是0 h 时的(0.68±0.012)、(0.83±0.021)、(0.90±0.019)、(0.95±0.010)倍;48 h 时划痕面积在K 浓度为0、40、60、80 μmol/L分别是0 h 时的(0.41±0.022)、(0.56±0.024)、(0.72±0.031)、(0.88±0.016)倍,说明随着尾叶香茶菜丙素浓度的升高,小室中穿过膜的细胞数量越来越少,划痕愈合的速率也呈浓度依赖性的变慢,说明尾叶香茶菜丙素可以抑制HepG2/ADM 细胞的迁移(t=12.61,9.82,P=0.003,0.005)。见图3。
图3 尾叶香茶菜丙素对HepG2/ADM细胞迁移的影响:A为Tran‑swell小室实验;B为平板划痕愈合实验
2.5 尾叶香茶菜丙素能抑制MDR1 在转录和翻译水平的表达
为了检测尾叶香茶菜丙素是否调控耐药基因的表达,我们首先进行了实时荧光定量PCR,表1 为引物合成表,结果显示,BCRP、MRP1、MRP2 都未受到显著调节,而在尾叶香茶菜丙素浓度为60 μmol/L 时MDR1 基因表达下调为空白对照的(0.255±0.013)倍(t
=20.41,P
=0.017)(n
=3)。West‑ern blotting 结果显示MDR1 蛋白的表达量也受到了抑制,在尾叶香茶菜丙素处理浓度在80 μmol/L 时MDR1蛋白的浓度为空白对照组的(0.352±0.089)倍(t
=19.87,P
=0.008)(n
=3),说明尾叶香茶菜丙素在转录和翻译两个水平都抑制了MDR1 的表达。见图4。
表1 引物设计和合成
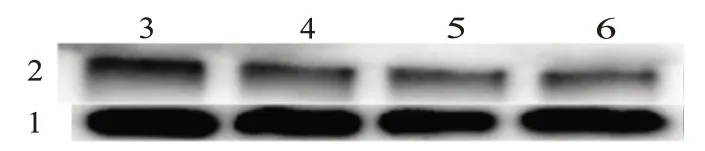
图4 尾叶香茶菜丙素对ABC超家族转运蛋白mRNA和蛋白质表达的影响
2.6 尾叶香茶菜丙素抑制能p-PTEN 和p-AKT 的表达
另外,Western blotting 结果显示(图5),尾叶香茶菜丙素处理HepG2/ADM 细胞后p-AKT 蛋白表达量下降在80 μmol/L 时p-AKT 蛋白表达量降至空白组的(0.231±0.036)倍(t
=15.49,P
=0.002),p-PTEN表达量上升,在60 μmol/L时上升为空白组蛋白表达量的(1.523±0.126)倍(t
=7.189,P
=0.002)且这些蛋白全部以浓度依赖性的方式受到调节。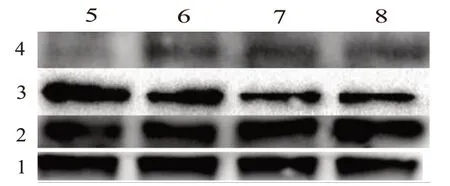
图5 尾叶香茶菜丙素对PENT-AKT通路蛋白的调控
3 讨论
肝癌耐药性一直是其化疗效果不佳和预后较差的重要原因,本研究发现阿霉素在1 mg/mL(184 μmol/L)时对HepG2/ADM 细胞耐药株的生长抑制率只有26.5%,而尾叶香茶菜丙素(Kamebakurin)对肝癌细胞HepG2/ADM细胞生长活力有强抑制作用,其IC50 值为62.97 μmol/L,尾叶香茶菜丙素对HepG2/ADM细胞的毒性要高于一线药物ADM。
在细胞凋亡主动中Bcl2 家族发挥重要作用,尾叶香茶菜丙素能诱导HepG2/ADM 细胞凋亡,蛋白免疫印迹结果显示尾叶香茶菜丙素通过上调促凋亡蛋白Bax 的表达并抑制抑凋亡蛋白Bcl-2 表达;尾叶香茶菜丙素可将HepG2/ADM 细胞周期阻滞在G2期,说明尾叶香茶菜丙素使细胞DNA 损伤,细胞G2检查点将受损细胞阻滞在G2 期无法进行后续有丝分裂,是HepG2/ADM 细胞发生凋亡和生长活力下降的主要原因之一;癌细胞的高迁移能力,是癌症难以治愈的重要原因之一,我们的研究表明尾叶香茶菜丙素具有很强的抑制HepG2/ADM 细胞迁移的能力。MDR1在癌细胞中过表达是肿瘤化疗成功的主要障碍之一,在肿瘤病人中,MDR1 将化疗药物排出细胞外,使药物疗效下降。在本研究中,尾叶香茶菜丙素处理细胞后,MDR1 在mRNA 和蛋白水平上显著降低,逆转了HepG2/ADM 细胞耐药株将药物泵出细胞的能力,说明尾叶香茶菜丙素具有逆转HepG2/ADM 细胞耐药的潜力,其部分功能通过抑制MDR1 基因和蛋白的表达发生,可能这是HepG2/ADM 细胞对尾叶香茶菜丙素要比阿霉素更敏感的原因之一。AKT 通路与很多肿瘤的发生相关,其异常激活会促进肿瘤的生长增殖以及迁移侵袭等,PTEN 是一种新发现的抑癌基因,作为AKT 通路的负调控因子其磷酸化水平的升高会抑制p-AKT 的激活从而抑制细胞增殖和迁移。通过Western blotting 实验显示尾叶香茶菜丙素处理细胞后,p-AKT含量下降且AKT通路上游蛋白p-PTEN表达上升最终抑制AKT通路的激活。
综上所述,尾叶香茶菜丙素可能通过抑制MDR1 蛋白表达从而逆转HepG2/ADM 细胞对药物的敏感性,主要通过上调p-PTEN抑制p-AKT的激活从而促进HepG2/ADM 细胞的凋亡并抑制其迁移能力,说明尾叶香茶菜丙素具有很好的抑制肝癌耐药的功效和潜力。
