卡维地洛对肝纤维化动物模型TLR4-MyD88-NF-κB信号通路的影响及其抗肝纤维化的作用机制
2021-10-29陈建勇郝芳艳林近秋田晓鹏王素格
陈建勇,郝芳艳,林近秋,田晓鹏,王素格
(1华北医疗健康集团邢台总医院内五科,2邢台市人民医院消化内科,河北 邢台 054000)
肝纤维化是肝细胞对慢性肝损伤后作出的一种自我修复反应,属于多种肝病逐渐发展为肝硬化的重要中间阶段[1]。肝纤维化在肝损害后的肝脏修复过程中会伴随细胞外基质(extracellular matrix,ECM)的大量合成,使得肝内ECM 出现过度沉积。研究证实肝纤维化早期具有一定逆转可能性,进行及时有效的治疗具有重大意义[2]。卡维地洛可以通过阻滞交感神经受体,发挥成纤维细胞增殖抑制作用,从而降低ECM 合成量,改善肝纤维化[3]。肝纤维化进程中常伴随炎症及机体免疫反应,且两者会进一步加重肝纤维化的发生和发展[4]。Toll 样受体4(toll-likere‑ceptors4,TLR4)-髓样分化因子88(myeloiddifferentia‑tionfactor,MyD88)-NF-κB(TLR4-MyD88-NF-κB)作为参与机体固有免疫的重要信号通路之一,其与酒精性肝纤维化发生发展存在密切相关性,其可通过激活机体炎症反应诱导肿瘤坏死因子α(tumornecros‑isfactor-α,TNF-α)、白细胞介素-1(interleukin-1,IL-1)、IL-6 等下游炎症因子大量合成和释放,但目前关于该信号通路在肝纤维化病程发展中的作用尚且研究不多,且卡维地洛是否通过TLR4-MyD88-NF-κB信号通路改善肝纤维化尚且需要进一步研究证实[5]。为探讨卡维地洛对肝纤维化的抑制程度及作用机制,以及肝纤维抑制作用与给药剂量之间的关系。本研究以SD大鼠构建肝纤维化动物模型进行相关研究,结果报道如下。
1 材料与方法
1.1 一般材料选择60 只清洁级雄性SD 大鼠(动物来源:广东省医学实验动物中心),鼠龄12月左右,大鼠体重(200±15)g,按照清洁级大鼠饲养要求进行饲养,大鼠自由进食食物和水。药物卡维地洛购自上海麦克林生化科技有限公司(批号:20190122)。试剂:抗体TLR4、MyD88、NF-κB均购自Abcam 公司,批号分别为ab13556、ab2064、ab16502);抗β-actin 购自康为世纪公司,批号为20190215;SDS-PAGE 凝胶配制试剂盒、TRIzol试剂购于北京柏莱斯特科技有限公司;ELISA 试剂盒购自北京索莱宝科技有限公司;主要仪器:电泳仪(厂家:上海天能科技有限公司,型号:EPS300),荧光定量PCR 仪(厂家:美国ABI 公司,型号:ABI7500),Modulus多功能光度计(厂家:美国BioSystems公司),显微镜(厂家:日本Olympus公司)。
1.2 模型建立与药物干预方法将60只大鼠随机分为空白对照组、模型组以及低、中、高剂量卡维地洛组,每组各12只。采用胆总管结扎法建立模型组和卡维地洛组大鼠肝纤维化模型[6],并于造模成功后48 h开始,分别灌胃给予低、中、高剂量卡维地洛组大鼠卡维地洛药液0.5、1.0、1.5 mg/kg/d,均分2次给药,连续给药4 w;空白对照组和模型组每次给予同时等量蒸馏水。
1.3 各组大鼠血清学指标水平测定干预7 d后从各组大鼠眼眶取血1.5 mL,2 500 r/min离心15 min(有效离心半径10 cm)后得到分离后血清,采用酶联免疫吸附测定(ELISA)试剂盒测定各组大鼠血清样品中ALT、AST、ALB以及炎症因子IL-1、IL-6、TNFα水平和Hyp、LN、PIIINP含量。
1.4 肝组织病理学观察给药干预4 w后,在无菌操作条件下切取左叶肝组织5 mm×5 mm×5 mm,然后使用多聚甲醛(4%浓度)将肝组织固定并进行常规石蜡切片,完成切片制备后进行HE染色和Masson染色。镜下观察各组大鼠的肝脏组织结构、肝细胞炎症、变性坏死以及纤维化增生情况。
1.5 Western-blot法测定皮损组织TLR4、MyD88、NF-κB蛋白水平在无菌操作条件下剪取各组大鼠左叶肝组织各3块,约100 mg/块,经超声裂解后采用BCA法对蛋白进行定量,使用10%SDS聚丙烯酰胺凝胶电泳对蛋白样品进行分离后,将蛋白转移到PVDF膜上,使用封闭液将样品于室温下封闭1 h,将膜转入封闭液稀释的一抗(TLR4、MyD88、NF-κB稀释1 000倍),以β-actin为内标。然后于4℃条件下孵育过夜后使用洗液进行洗涤,化学发光法显色,X射线底片曝光。
1.6 实 时 定 量PCR法 检 测NF-κB与TLR4/MyD88 mRNA水平取出大鼠肝组织并加入TRIzol试剂将细胞完全裂解,并于室温条件静置5 min。然后加入氯仿200µL于裂解后细胞中,涡旋20 s后再于室温条件下静置5 min。取静置后样品放入离心机中在12 000 rpm条件下离心15 min,将上清液转移于EP管中并加入异丙醇0.5 mL,混匀并于室温条件下静置10 min。然后使用Prime Script RT reagent Kit反转录试剂盒(购于赛默飞世尔中国公司)将总RNA进行反转录。NF-κB、TLR4、MyD88引物序列分别为正向5'-A C AC GG ACA GGATT GACAGA-3'、反向5'-GGAC ATC TAAGGGCATCACA-3';正 向5'-CAAT‑GACATTTCACACACGCAG-3',反向5'-AGATGGAG‑GAGGTCTCGCAG-3';正 向 5'-TGGCAGTGTCT‑TAGCTGGTTG-3',反向5'-G C G A G C A C A G A A TT A ATACGAC-3'。PCR反应条件:95℃60 s,95℃15 s,60℃15 s,72℃15 s,连续循环42次,并于72℃条件下延伸10 min。最后均采用2-△△ct计算组 织 中NF-κB、TLR4、MyD88 mRNA相 对 表 达 量(RQ)。
1.7 统计学分析采用SPSS19.0统计分析软件对本研究不同组别各项指标间差异进行评价。其中计量资料以(±s)表示,采用独立t检验,计数资料以%表示,采用χ2检验,多组间采用方差分析,组间两两比较采用SNq检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 肝纤维化大鼠模型验证造模后,HE染色结果表明:对照组大鼠肝小叶结构完整且有序排列,肝索形态清晰可见,肝细胞未出现明显的变性或坏死,以及未见明显增生纤维组织。模型组大鼠肝组织大部分肝小叶结构被破坏,肝细胞出现明显水肿、变性甚至坏死,炎性细胞大量沉积,肝索结构和形态混乱。Masson染色结果表明:对照组大鼠肝小叶结构清晰、完整,未形成肝纤维化。模型组大鼠汇管区域发生扩张且增生出大量纤维组织,甚至形成纤维间隔。病理检查结果提示大鼠肝纤维化模型造模成功。见图1。

图1 造模结束后空白对照组和模型组大鼠肝组织HE和Masson染色结果(×200)
2.2 各组大鼠血清学指标水平比较与空白对照组比较,模型组IL-1、IL-6、TNF-α、ALT、AST以及Hyp、LN、PIIINP水平明显升高(P<0.05),ALB水平水平明显下降(P<0.05);干预4 w后,低、中、高剂量卡维地洛组大鼠血清ALT、AST、炎症因子IL-1、IL-6、TNFα水平以及Hyp、LN、PIIINP相比模型组明显下降(P<0.05),ALB水平明显上升(P<0.05),且随着给药剂量增加,各因子水平改善更显著。见表1、表2。
表1 各组大鼠血清IL-1、IL-6、TNF-α以及ALT、AST、ALB水平比较(±s)

表1 各组大鼠血清IL-1、IL-6、TNF-α以及ALT、AST、ALB水平比较(±s)
注:与空白对照组相比,aP<0.05;与模型组相比,bP<0.05;与低剂量卡维地洛组比较,cP<0.05;与中剂量卡维地洛组比较,dP<0.05。
组别空白对照组模型组低剂量卡维地洛组中剂量卡维地洛组高剂量卡维地洛组例数12 12 12 12 12 IL-1/(pg/mL)16.02±3.36 48.31±5.23a 39.62±4.93ab 32.02±4.25abc 26.18±3.38abcd IL-6/(pg/mL)15.25±4.47 36.38±5.25a 29.62±4.23ab 26.10±3.78abc 20.65±3.62abcd TNF-α/(pg/mL)11.74±3.36 29.25±5.79a 25.20±5.31ab 19.69±4.17abc 16.62±3.27abcd ALT/(U/L)42.32±8.25 158.27±10.08a 102.20±7.16ab 78.29±7.04abc 53.63±5.57abcd AST/(U/L)41.56±7.26 152.31±11.74a 105.78±10.63ab 76.02±9.68abc 63.52±7.31abcd ALB/(g/L)40.45±5.27 24.83±4.72a 28.53±4.83ab 31.85±5.23abc 35.69±5.35abcd
表2 各组大鼠血清Hyp、LN、PIIINP水平比较(±s)

表2 各组大鼠血清Hyp、LN、PIIINP水平比较(±s)
注:与空白对照组相比,aP<0.05;与模型组相比,bP<0.05;与低剂量卡维地洛组比较,cP<0.05;与中剂量卡维地洛组比较,dP<0.05。
组别空白对照组模型组低剂量卡维地洛组中剂量卡维地洛组高剂量卡维地洛组例数12 12 12 12 12 Hyp/(µg/mL)7.10±1.25 17.38±3.24a 14.74±3.13ab 12.02±2.47abc 9.48±2.36abcd LN/(ng/mL)75.25±8.61 136.63±10.96a 105.32±9.47ab 92.18±8.63abc 82.65±6.42abcd PIIINP/(ng/mL)9.44±2.10 26.36±4.23a 20.62±3.56ab 16.63±3.37abc 13.62±2.61abcd
2.3 各组大鼠肝组织病理学检查结果比较
2.3.1 HE 染色 空白对照组与模型组与验证模型时HE染色结果显示的病理变化相似。高剂量卡维地洛组仅出现少量胶原纤维沉积及炎性细胞浸润,肝索排列整齐,未出现假小叶;中、低剂量卡维地洛组均有不同程度肝细胞变性甚至坏死,浸润有明显的炎性细胞以及出现增生的胶原纤维,肝索结构混乱以及出现不同程度的假小叶,其中中剂量卡维地洛组病理程度轻于低剂量卡维地洛组,见图2。

图2 干预后各组大鼠肝组织HE 染色结果
2.3.2 Masson 染色 空白对照组与模型组与验证模型时HE 染色结果显示的病理变化相似,高剂量卡维地洛组大鼠肝小叶结构完整,少量纤维组织增生;中、低剂量卡维地洛组大鼠存在少量肝小叶结构,以及纤维组织增生。见图3。
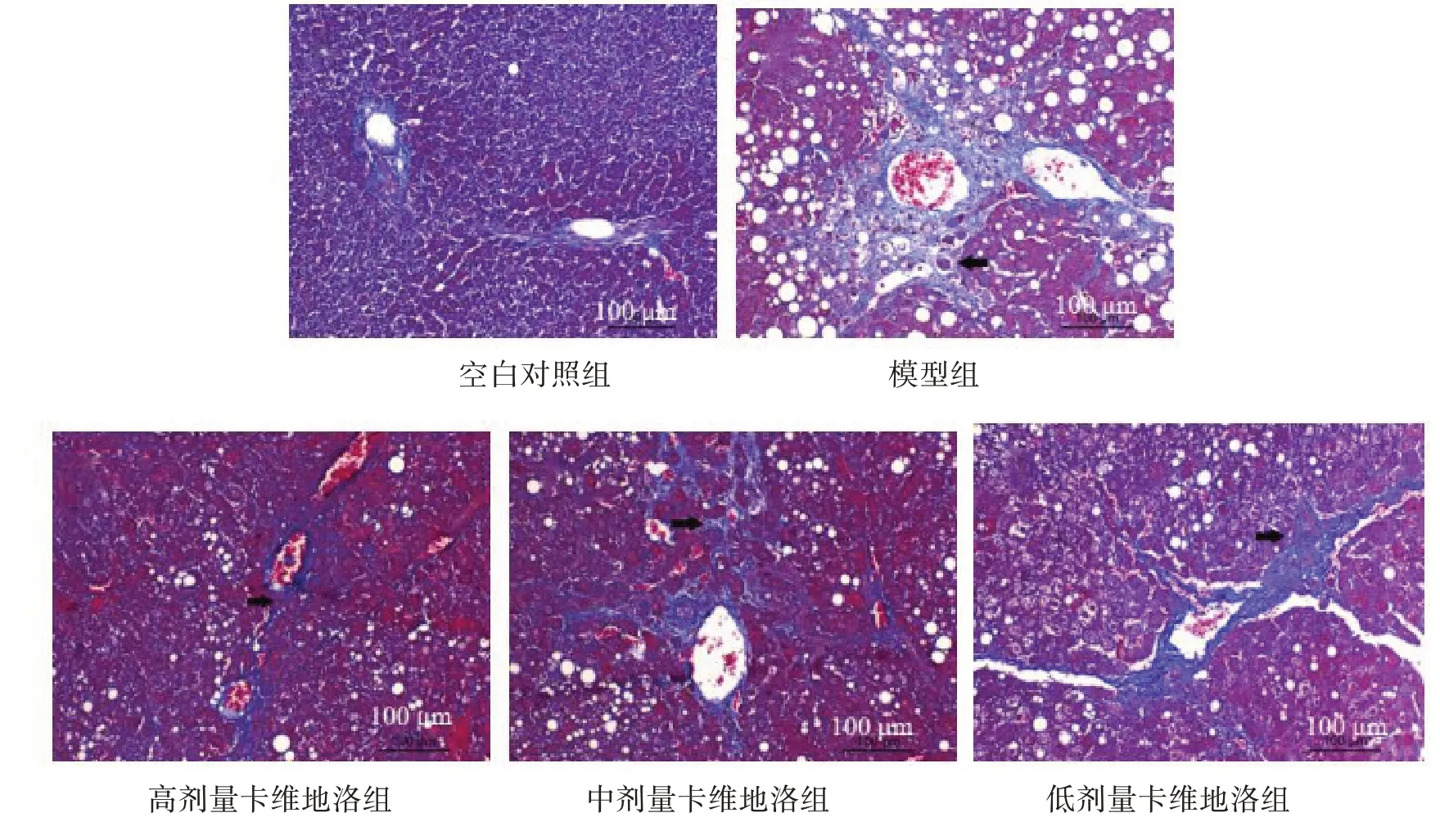
图3 干预后各组大鼠肝组织Masson染色结果(×200)
2.4 各组TLR4、MyD88、NF-κB 蛋白水平测定结果模型组大鼠TLR4、MyD88 和NF-κB 表达水平相比空白对照组明显升高(P<0.05)。不同剂量卡维地洛干预后,随着剂量增加,TLR4、MyD88 和NF-κB 表达水平逐渐降低,表现出明显的剂量依赖(P<0.05),见表3和图4。

图4 各组大鼠TLR4、MyD88、NF-κB蛋白水平western blot图
表3 各组大鼠TLR4、MyD88、NF-κB蛋白水平测定结果(±s)

表3 各组大鼠TLR4、MyD88、NF-κB蛋白水平测定结果(±s)
注:与空白对照组相比,aP<0.05;表示模型组相比,bP<0.05;与低剂量卡维地洛组比较,cP<0.05;与中剂量卡维地洛组比较,dP<0.05。
组别空白对照组模型组低剂量卡维地洛组中剂量卡维地洛组高剂量卡维地洛组例数12 12 12 12 12 TLR4/β-actin 0.19±0.05 0.45±0.16a 0.38±0.14ab 0.32±0.13abc 0.24±0.08abcd MyD88/β-actin 0.32±0.08 0.96±0.15a 0.85±0.10ab 0.67±0.08abc 0.46±0.07abcd NF-κB/β-actin 0.35±0.06 0.88±0.12a 0.74±0.09ab 0.62±0.06abc 0.51±0.04abcd
2.5 各组大鼠NF-κB 与TLR4/MyD88 mRNA 水平比较模型组大鼠TLR4、MyD88 和NF-κB mRNA 表达水平相比空白对照组明显升高(P<0.05)。不同剂量卡维地洛干预后,随着剂量增加,TLR4、MyD88 和NF-κB mRNA 表达水平逐渐降低,表现出明显的剂量依赖(P<0.05),见表4。
表4 各组大鼠NF-κB与TLR4/MyD88 mRNA水平比较(±s)

表4 各组大鼠NF-κB与TLR4/MyD88 mRNA水平比较(±s)
注:与空白对照组相比,aP<0.05,与模型组相比,bP<0.05,表示与低剂量卡维地洛组比较,Pc<0.05;与中剂量卡维地洛组比较,dP<0.05。
组别空白对照组模型组低剂量卡维地洛组中剂量卡维地洛组高剂量卡维地洛组例数12 12 12 12 12 TLR4 mRNA 1.00±0.08 3.68±0.21a 2.47±0.17ab 2.10±0.15abc 1.85±0.12abcd MyD88 mRNA 1.00±0.09 3.54±0.18a 2.23±0.12ab 1.97±0.13abc 1.41±0.10abcd NF-κB mRNA 1.12±0.10 3.36±0.18a 2.17±0.16ab 1.75±0.12abc 1.51±0.09abcd
3 讨论
TLR4-MyD88-NF-κB 信号通路是参与固有免疫的一种重要信号通路。TLR4属于肝脏产生炎症反应的关键介质,其在心血管疾病进展过程中发挥重要作用,但其在肝纤维化进程中的作用机制仍需进一步证实[7]。张斌等[8]研究显示TLR4 被激活后即将被转运至细胞内以启动该信号通路,导致NF-κB 被活化;而NF-κB 作为对多种基因转录具有调控作用的重要因子,可参与机体免疫应答、炎症反应以及细胞凋亡调控等重要生理病理过程并发挥重要作用。郝健等[9]研究也证实,TLR4可以通过Toll/IL-1受体结构域利用MyD88 依赖或非依赖途径,进一步活化下游核因子NF-κB,从而促进大量炎症和细胞因子生成。
卡维地洛属于第三代β阻滞剂,可以选择性阻断α1 受体和非选择阻断β 受体,可以发挥抗氧化和抗增殖作用,且对细胞凋亡具有一定抑制功能[3]。研究报道卡维地洛对交感神经受体具有显著阻滞作用,从而有效抑制成纤维细胞增殖程度以阻断细胞外间质合成,发挥改善心脏间质重塑作用,目前主要应用于心血管疾病的预防和治疗[10]。本研究结果表明采用不通过剂量的卡维地洛干预治疗后,与模型组比较,高、中、低卡维地洛组随着其给药剂量增加,大鼠TLR4、MyD88和NF-κB蛋白和mRNA表达水平降低,表现出明显的剂量依赖。推测可能是由于卡维地洛通过抑制或阻断MyD88 依赖途径,甚至还可能通过阻断MyD88非依赖途径进而抑制NF-κB蛋白表达水平。已有研究证实炎性细胞因子在肝纤维化形成中发挥关键作用,肝纤维化和肝硬化患者血清及肝组织中IL-1、IL-6 、TNF-α 等炎性因子表达水平相比正常人均显著上升[11-12]。本研究表明肝纤维化模型组大鼠的IL-1、IL-6、TNF-α 以及ALT、AST 水平相比空白对照组明显升高,ALB 水平明显下降;干预4 w 后,低、中、高剂量卡维地洛组大鼠血清ALT、AST、炎症因子IL-1、IL-6、TNF-α 水平以及Hyp、LN、PIIINP 水平相比模型组明显下降,ALB 水平明显上升,且随着给药剂量增加,各因子水平改善更显著。PIIINP是由III 型前胶原(PCIII)在内肽酶作用下去除C 端球形肽而形成,其可以有效反映PCIII水平,也是目前公认的可以作为反映肝纤维化程度的有效指标[13-14]。本研究通过HE 染色和Masson 染色进一步验证了卡维地洛对肝纤维化的改善效果,发现不同剂量卡维地洛组大鼠的胶原纤维沉积以及炎性细胞浸润均出现不同程度改善,且以高剂量组改善最佳。证实卡维地洛确实可抑制和改善肝纤维化发生及发展程度,推测其作用机制可能是卡维地洛通过降低TLR4和NFκB 表达水平进而抑制下游炎性因子分泌,达到降低和改善肝组织炎性细胞浸润现象,缓解炎症反应进而改善肝纤维化和肝功能[15-16]。有研究报道卡维地洛可以显著改善缺氧/复氧诱导心肌H9C2 细胞的凋亡程度,揭示其作用机制也是通过抑制TLR4 /NFκB 信号通路,升高NF-κB 调控蛋白(β-arrestin2)表达水平[17],与本研究的卡维地洛对TLR4 /NF-κB 信号通路具有抑制作用结果一致。
综上所述,卡维地洛可能通过调控TLR4-MyD88-NF-κB 信号通路调控TLR4、MyD88 以及NFκB蛋白表达,发挥抑制肝脏炎症反应和抗纤维作用,从而改善肝纤维化程度。
