灯盏花素对COPD小鼠模型气道平滑肌细胞增殖的影响
2021-10-29石露露韩卫南许宁宁
石露露,韩卫南,王 强,许宁宁
(张家口市第一医院药学部,河北 张家口 075000)
慢性阻塞性肺疾病(chronic obstructive pulmori‑ary disease,COPD)的特征是气流受限,其与气道对有害颗粒或气体的慢性炎症反应增强有关,临床上尚无特效治疗方法[1]。气道平滑肌细胞(airway smooth muscle cells,ASMC)的过度增殖会引起气管功能障碍,并参与气道重塑和气道高反应性[2]。在COPD 患者的支气管分泌物中检测到肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)升高,其可以通过TNF 受体(TNF receptor,TNFR)激活核因子(nuclear factor,NF)-κB,上调靶基因的表达参与炎性反应,如磷脂酶A2 等[3]。近年来研究显示TNF-α/TNFR/NF-κB 途径也可以诱导ASMC的过度增殖[4]。灯盏花素是一种从中草药中分离得到的类黄酮糖苷混合物,其药理作用包括缓解机体高凝状态、调控氧化应激反应和炎性反应等[5]。已有研究显示灯盏花素可以缓解COPD病情并调控患者免疫水平,改善预后[6],但是灯盏花素缓解COPD 的机制以及其对ASMC 的影响仍不明确。本研究主要基于TNF-α/TNFR/NF-κB 途径探讨灯盏花素对COPD 动物模型气道平滑肌细胞增殖的调控机制。
1 材料与方法
1.1 材料C57BL/6 小鼠,雄性,4 周龄,湖北省实验动物研究中心,SCXK(鄂)2015-0018。脂多糖(美国Sigma 公司)。香烟(红塔集团,烤烟型)。灯盏花素注射液(神威药业,Z13020778)。小动物肺功能仪(拜安吉)。苏木精-伊红(hematoxylin-eosin,HE)HE试剂盒(碧云天)。RNAspin Mini 试剂盒(美国GE Healthcare)。Bestar qPCR RT 和Bestar™qPCR 试剂盒(德国DBI Bioscience)。Agilent Stratagene Mx3000P序列检测系统(美国Santa)。一抗和山羊抗兔HRP–IgG二抗(ab205718)(美国Abcam)。PVDF膜(中国香港JS0344,JSENB)。ECL 显色试剂盒(美国Ther‑mo Fisher)。 小鼠ASMC 细胞(美国ATCC 公司)。NF-κB 抑制剂EVP4593(美国Selleck 公司)。5-乙炔基-2'脱氧尿嘧啶核苷(5-ethynyl-2'-deoxyuridine,EdU)试剂(RiboBio)。
1.2 建模将45 只小鼠分为3 组:对照组、COPD 组和COPD+灯盏花素组,每组15 只。通过鼻腔滴入脂多糖(LPS)和香烟环境诱导建立COPD 模型[7],在实验第1周、第5周和第9周的第1天滴入30 µg的LPS,然后将小鼠放置在熏箱中(0.7 m×0.5 m×0.4 m),熏箱中放入点燃香烟,每次10 支,每日1 次,连续12 w。COPD+灯盏花素组小鼠在建模后使用灯盏花素腹腔注射,每次剂量按灯盏花素计算为48 mg/kg,每日1次,连续4 w[8]。
1.3 观测指标
1.3.1 气道反应性检测 小鼠通过腹腔注射戊巴比妥钠(1%,70 mg/kg)麻醉,切开气管插入导管连接到肺功能检测仪上,检测和记录气道阻力。
1.3.2 增殖细胞核抗原检测(proliferating cell nuclear antigen,PCNA)小鼠颈脱臼处死后取出肺组织,用4%的聚甲醛固定并用梯度醇脱水,包埋在石蜡中,制成厚度为5 µm 的组织玻片标本。用Mayer's 苏木精在室温下染色10 min,然后用0.5% 的曙红室温下染色3 min。将切片在-20°C 的冷丙酮中固定15 min。然后在37°C 下与抗小鼠PCNA 抗体孵育1 h,然后使用IgG 试剂显色,最后利用苏木精复染细胞核,棕色和黄色染色代表阳性细胞。
1.3.3 mRNA 检测 从组织中提取RNA,使用Bestar qPCR RT 试剂盒将其逆转转录为cDNA,条件如下:37 °C /15 min;98 °C /5min。然后使用Bestar™qPCR预混液进行qPCR 实验,条件如下:95 °C/2 min,94 °C/ 20 s,58 °C 20 s,72 °C/20 s,40 个循环,最后在72 °C 下 延伸4 min。使 用Agilent Stratagene Mx3000P 序列检测系统进行RT-qPCR 分析。GAPDH 作为内源参照,通过比较循环阈值评估mRNA水平。
1.3.4 蛋白检测 将气管组织研磨后萃取总蛋白并检测浓度,然后分别取总量为40 µg 的总蛋白进行分离,分离条件为10% 的聚丙烯酰胺凝胶、80~120 V、90 min。然后通过湿法进行转膜,在100 mV 下将分离的蛋白转移到PVDF膜上。将一抗稀释500倍后分别加入膜中并在4 °C 下孵育过夜。洗涤后加入山羊抗兔HRP –IgG 二抗室温孵育1 h。本研究内参为GAPDH,分析目标蛋白条带相对于GAPDH 的灰度值分析蛋白表达水平。
1.3.5 细胞增殖检测 将ASMC分为空白组、模型组、模型+灯盏花素组和模型+灯盏花素+ EVP4593 组。在培养基中加入4% 的香烟提取物和0.1 µg /mL 的脂多糖诱导体外COPD 模型培养24 h[9],其中培养基中灯盏花素的终浓度为50 mg/L。对于模型+灯盏花素+ EVP4593 组,在培养前加入10 µmol/L 的NF-κB抑制剂EVP4593 预培养48 h。4 组细胞用EdU 试剂处理2 h,进行染色,细胞核使用Hoechst 染色。然后在荧光显微镜下随机选择5 个高倍视野拍照观察,计算细胞增殖比例(=新增殖细胞/总细胞数目×100%)。
1.4 统计学处理所有实验进行3 次平行实验。数据以平均值±标准偏差(SD)表示。 统计分析使用SPSS 19 软件。多组间比较进行方差分析,两两比较使用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 3 组小鼠气道阻力比较COPD 组50 mg/mL 和100 mg/mL 条件下的气道阻力[(9.94±1.67)cm H2O×s/mL,(18.94±2.13)cm H2O×s/mL] 显 著 高 于 对 照 组[(5.72±0.94)cm H2O×s/mL,(10.15±1.39)cm H2O×s/mL](P<0.05),COPD+灯盏花素组的气道阻力[(7.15±1.28)cm H2O×s/mL,(13.78±1.86)cm H2O×s/mL]显著低于COPD组(P<0.05),见表1。

表1 3组小鼠气道阻力比较/(cm H2O×s/mL)
2.2 3 组小鼠肺组织和气管病变比较对照组小鼠肺组织细胞染色均匀、细胞形态正常、排列规则,肺泡结构清晰,支气管壁细胞排列有序,厚度均匀。COPD 组肺泡结构紊乱,支气管壁明显增厚。COPD+灯盏花素组肺组织损伤情况和气管病变情况较COPD组轻。见图1。

图1 3组小鼠肺组织和气管病变比较(×100)
2.3 3组小鼠PCNA 蛋白表达水平比较COPD 组小鼠ASMC 的PCNA 染色水平显著升高,COPD+灯盏花素组的PCNA表达水平低于COPD组。见图2。

图2 3组小鼠PCNA蛋白表达水平比较(×100)
2.4 3 组小鼠TNF-α/TNFR/NF-κB 转录水平比较3 组小鼠TNF-α、TNFR、NF-κB mRNA 转录水平比较差异均有统计学意义(P<0.05)。 COPD 组的TNF-α、TNFRmRNA、NF-κB mRNA 显著高于对照组(P<0.05),COPD+灯盏花素组显著低于COPD 组(P<0.05),见表2。

表2 3组小鼠TNF-α、TNFR、NF-κB mRNA转录水平比较
2.5 3组小鼠TNF-α/TNFR/NF-κB蛋白表达水平比较3 组小鼠TNF-α、TNFR、NF-κB 通路中蛋白表达水平比较差异均有统计学意义(P<0.05)。COPD组的TNF-α、TNFR 、NF-κB 蛋白水平显著高于对照组(P<0.05),COPD+灯盏花素组显著低于COPD 组(P<0.05),见表3、图3。
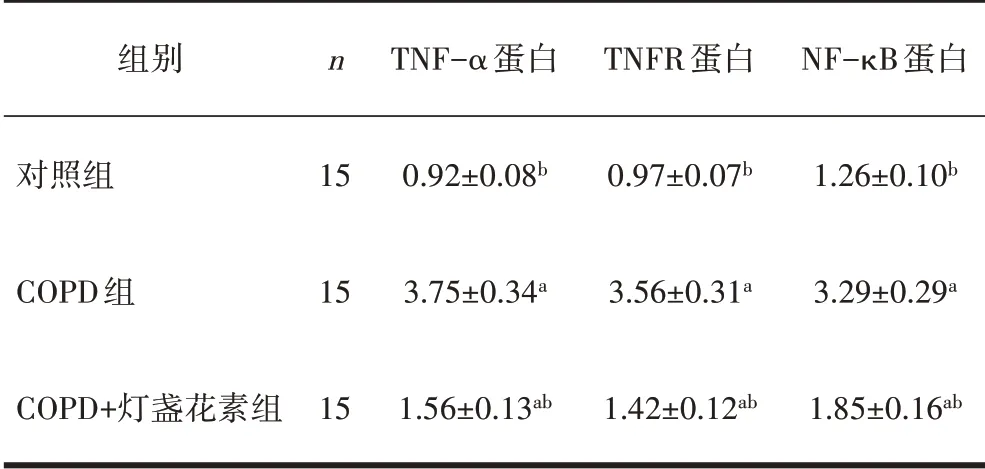
表3 3组小鼠TNF-α、TNFR、NF-κB 蛋白表达水平比较

图3 3组小鼠TNF-α、TNFR、NF-κB 蛋白表达水平比较
2.6 TNF-α/TNFR/NF-κB 通路对ASMC 增殖的影响4组ASMC 增殖情况比较差异均有统计学意义(P<0.05),其中模型组的增殖率[(41.26±3.58)%]显著高于空白组[(15.85±1.87)%](P<0.05),模型+灯盏花素 组 的 增殖 率[(30.64±3.06)%] 显 著 低 于 模 型 组(P<0.05),模型+灯盏花素+EVP4593 组的增殖率[(22.18±4.02)%]显著低于模型+ 灯盏花素组(P<0.05)。见图4。

图4 TNF-α/TNFR/NF-κB通路对ASMC增殖的影响(×400)
3 讨论
COPD 已成为主要的国际卫生问题,其患病率和死亡率日渐增多[10]。 COPD 最常见的症状为长期咳嗽、咳痰、呼吸急促和呼吸困难。气道上皮细胞增殖会引起气管壁增厚、气道重塑和高反应性,是COPD的主要发病机制之一[11]。灯盏花素(C42H36O23)是从灯盏花中提取的一种黄酮类化合物,其具有扩张毛细血管、减少血小板凝集、清除自由基和改善微循环的作用[12]。临床研究已经显示了灯盏花素可缓解急性COPD,并改善患者肺功能提高预后[13]。本研究利用LPS 和香烟构建了COPD 小鼠模型,并通过灯盏花素进行干预,结果显示灯盏花素可以明显的减少COPD模型小鼠阻力,缓解气管壁增厚,并且可以显著的抑制ASMC 的增殖。现阶段灯盏花素抑制细胞增殖的作用主要集中在肿瘤细胞中,研究显示灯盏花素具有抑制肝癌[14]和前列腺癌[15]的肿瘤细胞增殖的作用。此外,体外研究也证实了灯盏花素可以抑制肺癌细胞的增殖[16]。本研究结果提示灯盏花素缓解COPD的作用可能与抑制细胞增殖有关,可能通过抑制ASMC 的增殖缓解气道高反应,从而抑制气道重塑,进而缓解COPD。
为进一步分析灯盏花素抑制ASMC 增殖的机制,本研究检测了TNF-α/TNFR/NF-κB 通路表达水平。该通路在COPD 中发挥重要作用,一方面,是因为激活NF-κB 蛋白的转录功能,促进促炎因子的转录导致炎性反应[17];另一方面,TNF-α 也可以通过NF-κB通路促进ASMC 的增殖[18]。本研究发现灯盏花素可以明显的抑制COPD 模型小鼠TNF-α/TNFR/NF-κB通路的转录和翻译水平。已有研究结果表明灯盏花素抑制了ASMC 的增殖,并且EVP4593 抑制TNF-α/TNFR/NF-κB 通路后会进一步提高灯盏花素的抗增殖作用[19]。灯盏花素可通过抑制NF-κB 通路缓解脑损伤[20]。灯盏花素通过抑制LPS 诱导的BV-2 小胶质细胞中的NF-κB 途径来抑制神经炎症[21]。灯盏花素可通过抑制TNF-α表达和NF-κB的活化抑制滑膜细胞的增殖并抑制炎性反应[23]。以上文献研究结果提示灯盏花素具有抑制TNF-α/TNFR/NF-κB 通路的功效,而本研究结果则表明灯盏花素可能通过抑制TNF-α/TNFR/NF-κB 通路的转录和翻译,来抑制炎性反应和抑制ASMC 增殖,从而发挥抗COPD 的作用。
综上所述,灯盏花素可能通过抑制TNF-α/TN‑FR/NF-κB 通路抑制ASMC 的增殖,进而减少气道阻力。关于灯盏花素调控TNF-α/TNFR/NF-κB 通路的机制得深入研究,这可能成为治疗COPD的新方法。
