艾迪注射液对N-亚硝基二乙胺(DEN)诱导的大鼠肝癌模型的干预作用
2021-10-29韩会靖施兴海孙丽华
韩会靖,施兴海,孙丽华
(1新疆维吾尔自治区药品检验研究院,乌鲁木齐,830011;2新疆维吾尔自治区乌鲁木齐市第一人民医院实验室,乌鲁木齐 830002;3新疆医科大学第一附属医院肝病中心,乌鲁木齐 830054)
原发性肝癌是全球第六大常见的恶性肿瘤。在肿瘤致死原因中居第四位,2018 年全球约有841000例新病例,每年有78.2 万人死亡[1]。全球47.1% 的死亡病例在中国。2015 年我国肝癌所死亡率为25.26/10万,位居全部恶性肿瘤第二位[2],肝细胞癌(hepa‑tocellular carcinoma,HCC)是成人中最常见的原发性肿瘤,是全球癌症死亡的主要原因。肝内扩散和肝外转移是肝癌恶性生长的关键因素。中医学认为原发性 肝癌 属“肝 积”“臌 胀”“癖 黄”“症 瘕”“肝 壅”“黄疸”等范畴[3],治疗原则以驱邪扶正为主。艾迪注射液是临床常见的药物类型,具有化瘀散结、清热解毒的功效,主要包括刺五加、人参、斑螯、黄芪等,是一种新型的复方中药注射液[4-5]。有研究显示,艾迪注射液可以通过多成分、多靶点治疗肝细胞癌[6]。CD34是内皮细胞标志物,主要表达于肝血窦的毛细血管,其显示血管内皮细胞的特异性最高[7-8],α-平滑肌肌动蛋白(α-SMA),主要表达于肝脏肿瘤及肝纤维化中新生的血管。为了探讨艾迪注射液对肝癌血管内皮的影响,本研究以CD34 和α-SMA 为研究对象,研究艾迪注射液干预下CD34和α-SMA的表达,探讨艾迪注射液的抗癌作用机制,为天然植物应用于肝癌临床治疗提供实验依据,现报道如下。
1 材料与方法
1.1 实验动物健康Wistar 大鼠30 只,购自新疆医科大学动物实验中心,清洁级,雄性,体重(200±20)g。动物生产许可证号:SCXK(新)2018-0001;动物使用许可证号:SYXK(新)2018-0003。本实验获得新疆医科大学第一附属医院伦理委员会审批通过,伦理审批号:IACUC20180313-04。所有大鼠在20~25°C下保持12 h的明暗循环,自由摄食和饮水。
1.2 主要仪器与试剂二乙基亚硝胺(DEN )购自Sig‑ma 公司,艾迪注射液(贵州益佰制药股份有限公司,规格10 mL/支,批号:国药准字Z52020236)。兔抗α–SMA(ab108424),CD34(ab81289)由英国ABCAM公司生产,通用型二抗由北京中杉金桥生物技术有限公司生产,Masson 试剂盒(MXB 迈新试剂)。常用眼科手术器械,电子秤(上海鹰牌衡器有限公司)。天门冬氨酸转移酶(AST)、丙氨酸转移酶(ALT)、碱性磷酸酶(ALP)试剂盒购自深圳迈瑞生物医疗电子股份有限公司,深圳迈瑞半自动生化分析仪。
1.3 实验动物分组及造模30 只大鼠分笼适应性饲养1 w 后随机分为对照组、模型组、艾迪注射液处理组,每组10 只。对照组按0.1 mL/kg 的剂量腹腔注射生理盐水,每周注射1 次,共注射20 w。模型组大鼠给予一次性腹腔注射100 mg/kg 体重的DEN,后给予0.05%DEN 自由饮水。艾迪注射液处理组大鼠开始腹腔注射DEN 时即给予艾迪注射液1 mL/kg,后每周注射1 次,共注射20 w,末次给药后24 h,应用戊巴比妥钠麻醉大鼠,采用腹主动脉采血,4°C,3 000 r/min离心5 min,分离血清,采用生化分析仪测定血清中ALT、AST、ALP含量,对大鼠行安乐死后,取各组大鼠肝脏组织。
1.4 病理学检查肝脏标本取材固定于100 mL/L 的中性福尔马林,常规脱水,石蜡包埋,4 µm 切片,分别做HE 染色和Masson 染色(按试剂盒说明书步骤操作)。显微镜下观察大鼠肝组织病理学情况,观察肝脏炎症的坏死程度及肝包膜、汇管区、肝窦及中央静脉等处胶原纤维增生情况。
1.5 免疫组织化学染色检测肝组织中α-SMA 抗体和CD34蛋白的表达肝组织石蜡包埋后,切成4 µm切片。经脱蜡脱水后孵育一抗α-SMA 抗体(1:200)和CD34 抗体(1:1000),4℃过夜,二抗37℃孵育2 h。经DAB 显色,苏木素复染,中性树胶封片,将各组切片随机选取10个视野。测定每个视野中阳性细胞所占百分比。α-SMA 表达判断标准:以肝血管内出现棕色、棕黄色染色为阳性细胞,每张切片分别随机选取5个高倍镜视野进行观察。CD34 阳性标准定位于小血管内皮细胞的胞膜/胞浆,呈棕黄色表达。结果用IPP6.0软件测定积分光密度(IOD)值。
1.6 统计学处理采用SPSS22.0 软件进行统计学分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肝脏一般情况的比较对照组肝脏呈鲜红色,质地软,表面光滑,光泽度明显。模型组肝脏呈暗紫色,肝整体可见大面积坏死、水肿,被膜肿胀,大部分肝脏表明凹凸不平,可见大小不等癌结节。个别表面有明显粟粒样改变,呈肝硬化表现,艾迪治疗组肝脏呈暗红色,质地较软,表面尚光滑,偶可见表面有少量结节。
2.2 艾迪注射液对大鼠血清ALT、AST、ALP 的影响与对照组比较,模型组大鼠血清中ALT、AST、ALP 均明显增高,差异有统计学意义(P<0.05)。与模型组比较,艾迪注射液处理组ALT、ALP 明显降低,差异有统计学意义(P<0.05),各组ALT、AST 和ALP 水平见表1。
表1 大鼠血清中各组ALT、AST、ALP水平(±s,U/L)

表1 大鼠血清中各组ALT、AST、ALP水平(±s,U/L)
注:与对照组比较,#P<0.05;与模型组比较,*P<0.05。
组别对照组模型组艾迪注射液组F值P值样本数10 10 10 ALT/( U/L)51.10.10±5.90 251.18±30.16#178.20±85.93#*305.089 0.000 AST/( U/L)41.64±10.40 97.77±17.69#99.85±18.81#42.199 0.000 ALP/( U/L)55.04±12.47 109.77±15.61#92.76±24.58#*23.454 0.000
2.3 HE 染色及Masson 染色结果HE 染色结果显示,对照组肝小叶形态正常,肝脏结构完整,低倍镜下肝细胞呈条索状排列整齐,如图1a;模型组肝组织低倍镜下肝脏结构被破坏,可见大片肝坏死,可见大量纤维组织增生,汇管区成纤维细胞大量增生,肝血窦间隙变宽,可见大量结缔组织增生并向小叶内延伸形成典型的假小叶,如图1b。高倍镜下可见癌变的肝细胞变大,呈大的多边形、类圆形多核,核仁明显,细胞不规则排列,有大量脂肪变性和水肿,其间薄层纤维组织分割,坏死的癌组织中呈灶状分布,炎症细胞少见,如图1B;艾迪注射液处理组低倍镜下肝脏结构可见大量结缔组织增生并向小叶内延伸形成典型的假小叶,有大量炎细胞浸润,肝脏标本可见小叶内有干酪样坏死,如图1c。高倍镜下可见癌变的肝细胞,还有大量的脂肪空泡和水肿,如图1C。

图1 各组肝脏组织HE染色
Masson 染色结果显示,对照组呈正常肝组织形态,未见明显胶原纤维增生。模型组看见大量蓝色胶原纤维将肝组织分割成不规则形状,看见胶原纤维分割出来的假小叶紧紧将癌细胞包围,胶原纤维作为分割线将正常肝组织和癌组织分隔开,如图2b;高倍镜下可见胶原纤维包裹下的大量坏死区,如图2B;艾迪注射液处理组肝组织低倍镜下可见大量胶原纤维分隔形成的假小叶,肝细胞间隙有大量的橘红色的红血球,如图2C。

图2 各组肝脏组织Masson染色
2.4 免疫组织化学染色α-SMA 阳性结果呈棕黄色,表达于非成对动脉、无明显静脉、胆管及结缔组织伴行的的动脉),主要反映肝脏肿瘤血管生成。对照组呈低表达,主要表达于动静脉血管周围,如图3A;模型组在癌组织周围可见大量的阳性表达,大量的非成对的动静脉血管分布于癌组织中,呈不规则圆形,椭圆形,如图3B;艾迪注射液处理组在形成假小叶的胶原纤维中散在分布着呈棕黄色的阳性表达,如图3C。
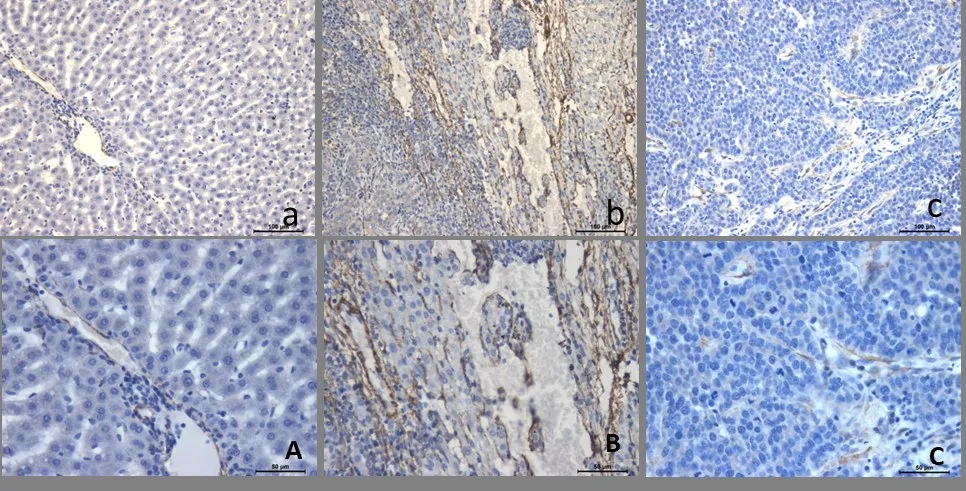
图3 免疫组织化学法检测各组兔肝组织中α-SMA的表达
CD34阳性染色为血管内皮细胞胞质内出现棕黄色颗粒,肿瘤微血管分布不均,表现出明显异质性,在癌组织、新生癌巢周边及纤维包膜中CD34 呈阳性细胞,微血管分布明显。对照组呈低表达,主要表达于动静脉血管周围,如图4A;模型组在癌组织可见大量的阳性表达,肝细胞坏死区、胶原纤维及部分肝癌细胞均及血管周围均呈阳性表达,如图4B;艾迪注射液处理组在形成假小叶的胶原纤维中散在分布着呈棕黄色的阳性表达,动静脉血管周围呈阳性表达,如图4C。

图4 免疫组织化学法检测各组兔肝组织中CD34的表达
与对照组比较,模型组、艾迪注射液处理组肝癌组织中α-SMA 表达升高,差异有统计学意义(P<0.01);与模型组比较,艾迪注射液处理组的α-SMA明显降低,差异有统计学意义(P<0.01)。与对照组比较,模型组、艾迪注射液处理组肝癌组织中CD34 表达升高,差异有统计学意义(P<0.01);与模型组比较,艾迪注射液处理组的CD34 明显降低,差异有统计学意义(P<0.01),见表2。
表2 α-SMA和CD34在各组大鼠肝脏组织的表达情况(±s)
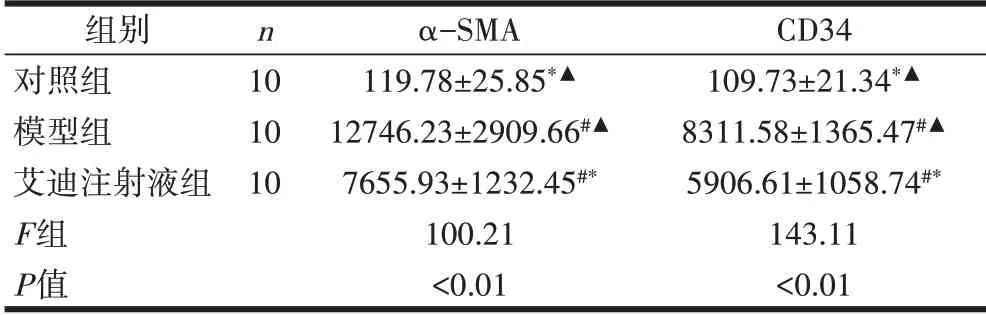
表2 α-SMA和CD34在各组大鼠肝脏组织的表达情况(±s)
注:与对照组比较,#P<0.01;与模型组比较,*P<0.01;与艾迪注射液处理组组比较,▲P<0.01。
组别对照组模型组艾迪注射液组F组P值n 10 10 10 α-SMA 119.78±25.85*▲12746.23±2909.66#▲7655.93±1232.45#*100.21<0.01 CD34 109.73±21.34*▲8311.58±1365.47#▲5906.61±1058.74#*143.11<0.01
3 讨论
肝细胞癌的发生发展是一个多步骤、多因素的进程,一些DNA 损伤性化学物质与细胞毒物质被认为肝癌发生的根本原因,二乙基亚硝胺(DEN)是一种诱发原发性肝癌的化学药物[9-10],DEN 在大鼠体内最终可以转化为烷基化代谢物,此代谢物可以导致DNA 加合物的形成,随后转化为中间体,促使了甲基化,DEN 的成瘤最关键的是由于DNA 中的O6 与N-7甲基鸟嘌呤的形成,使得遗传信息的改变,形成启动的致癌细胞。已有研究选用Walker-256 细胞接种于大鼠肝脏,21 d即可看见在肝脏出现乳白色菜花样占位性瘤体,证实了Wistar大鼠更适用于制作肝癌模型[11]。
艾迪注射液主要包括刺五加、人参、斑螯、黄芪等,组方以斑蝥为君药,斑螯素为斑螯的主要成分,也是抗恶性肿瘤的有效成分,具有较好的抗肿瘤作用,其在抑制肿瘤细胞的同时却对机体无明显免疫抑制作用,对白细胞数量不产生影响[6]。人参、黄芪、刺五加为佐药[12-13],属扶正固本类药物,能诱导肿瘤细胞凋亡,抑制肿瘤细胞增殖,艾迪注射液具有扶正祛邪的双重功效。传统中医理论认为艾迪注射液具有清热解毒、消瘀、散结的作用。本研究采用DEN 化学试剂制备大鼠肝癌模型,探讨艾迪注射液的价值。
ALT和AST是衡量肝脏代谢功能的重要的指标,当肝脏受损严重时,血清中ALT、AST 会显著升高[14]。ALP 主要用于诊断肝胆及骨骼系统疾病,是反映肝内占位性病变、肝外胆道梗阻和佝偻病的重要指标[15]。本研究通过测定大鼠血清中ALT 和AST 和ALP 水平,观察艾迪注射液的护肝作用。艾迪注射液干预后,大鼠ALT 和ALP 水平含量明显下降,提示大鼠肝脏功能在艾迪注射液的干预下有所恢复。
本研究的病理结果证实了大鼠肝癌模型制作成功,从HE 染色和Masson 染色中,模型组动物肝脏可以看见大量蓝色胶原纤维将肝组织分割成不规则形状,看见胶原纤维分割出来的假小叶紧紧将癌细胞包围,符合肝癌模型的病理特征[16]。经艾迪注射液干预后,本研究病理结果显示:肝脏坏死区变小,增生的胶原纤维分隔的假小叶变少,但是癌变的肝细胞和大量脂肪空泡仍然存在。说明艾迪注射液可能有治疗作用,但是因为本研究设定了一个干预剂量,无法判断是干预剂量不足或是治疗时间不足,后续本研究将会进一步深入探讨艾迪注射液的作用。
在肝癌的发生及转移过程中,肿瘤血管的生成起着至关重要的作用。在肝癌组织中,可以看到血窦是由一圈扁平梭状细胞连接而成,这种梭状细胞就是由内皮细胞构成,内皮细胞上α-SMA 为强阳性表达[17]。本研究中α-SMA 在对照组肝脏中央静脉、汇管区血管均为弱阳性表达或不表达,在模型组肝脏肝血窦及汇管区血管均为强阳性表达。艾迪注射液治疗后,肿瘤细胞α-SMA 表达有明显抑制作用。艾迪注射液能抑制肝癌肿瘤细胞α-SMA 蛋白的表达,提示其具有潜在的抗肿瘤血管生成,从而抑制肿瘤生长、转移及复发的作用。
CD34 的阳性表达程度与毛细血管密集程度有关,是肿瘤转移的重要原因[18]。CD34 在正常的肝窦内皮细胞中不表达,但可以作为微血管的标志,反映肝窦毛细血管化的程度。本研究以CD34 作为肝癌细胞的标志物,发现在癌组织、新生癌巢周边及纤维包膜中CD34 呈阳性细胞,微血管分布明显。与对照组比较,模型组和艾迪注射液处理组CD34 的表达明显升高,提示肝癌组织中CD34 出现了明显的阳性表达。经艾迪注射液干预后与模型组相比,CD34 表达明显降低,提示艾迪注射液治疗组对肝癌组织中CD34 的表达有降低作用,可能利于阻断新生血管的生成。
综上所述,艾迪注射液治疗DEN 所致肝癌大鼠后,大鼠肝脏a-SMA 和CD34 表达有降低趋势。艾迪注射液可能通过抑制a-SMA 和CD34 的表达,抑制肿瘤的浸润转移,发挥抑癌的作用。后续实验可采用不同剂量艾迪注射液对大鼠肝癌模型进行干预,并对a-SMA 和CD34 相关信号通路相关因子进行检测,为肝癌候选药物的研究提供依据。
