腹腔镜脾部分切除术和全脾切除术在脾良性占位性病变中的应用效果
2021-10-27邬迪张悦安勇陈学敏陈卫波
邬迪,张悦,安勇,陈学敏,陈卫波
脾良性占位性病变主要包括脾囊肿、脾脉管瘤、脾错构瘤、脾脓肿等,传统治疗方法是全脾切除术(total splenectomy,TS),但TS 术后容易引起败血症、血栓栓塞、肺动脉高压等严重并发症[1-2]。1905 年White 等[3]首 次 提 出 了 脾 部 分 切 除 术(partial splenectomy,PS),试图保留脾脏部分功能,但并没有得到快速普及。随着对脾脏生理、解剖的进一步认识和微创、快速康复外科理念的兴起,腹腔镜全脾切除术(laparoscopic total splenectomy,LTS)和脾部分切除术(laparoscopic partial splenectomy,LPS)逐渐应用于临床[4]。由于脾良性占位性病变相对少见,既往研究多为个案报道。本研究通过回顾性分析,比较LTS 和LPS 治疗脾良性占位性病变的近期疗效。
1 对象与方法
1.1 研究对象 收集苏州大学附属第三医院肝胆胰外科2016年2月—2018年2月收治的脾良性占位性病变(直径≥5 cm)患者52 例。纳入标准:心肺功能正常且能耐受全身麻醉;单发病灶;住院期间接受LTS或LPS。52例患者均为健康体检时发现脾占位,均无明显症状。根据占位位置分为2组,病变位于脾的中间或靠近脾门时,采用LTS 术式(30 例);病变位于脾的两极时,采用LPS术式(22例),其中10例位于脾上极,12例位于脾脏下极。
1.2 手术方法 所有患者术前均行腹部增强CT或MRI明确病变部位,并通过脾动脉血管重建明确脾叶血管走行。全麻后将患者双下肢分开,呈大字位,主刀医师和助手分别站在患者两侧,扶镜手站在患者两腿中间。腹内压维持在12 mmHg(1 mmHg=0.133 kPa)。在脐右下方置入12 mm穿刺器作为观察孔,另外4个穿刺器放置在腹部左右两侧作为手术孔,见图1。

Fig.1 The location diagram of puncture hole图1 穿刺孔的位置摆放示意图
LPS:对脾门进行精细分离,并用Hem-o-lok夹闭通向脾上极或下极的血管(图2A)。可见脾出现明显的缺血线(图2B)。用超声刀在缺血线内侧5~8 mm 处离断脾组织(图2C)。离断后主刀医师手持双极电凝器和吸引器止血,助手负责将创面暴露及使用冲洗器冲洗创面。最后用电凝钩或超声刀切开脾周韧带和粘连,将标本小心放入标本袋(图2D),标本袋自脐部切口完整取出。脾窝放置引流管,缝合操作孔,将患者送入重症监护室(ICU)。LTS:首先在胰腺上缘后方寻找并分离结扎脾动脉,待脾变软变小,仔细分离脾门,显露胰腺尾部及脾蒂血管;随后用直线切割吻合器切断脾蒂,解剖并结扎切断剩余的脾周韧带和胃短血管,将标本小心放入标本袋中,标本袋自扩大的脐部切口完整取出。脾窝放置引流管,缝合操作孔,将患者送入ICU。
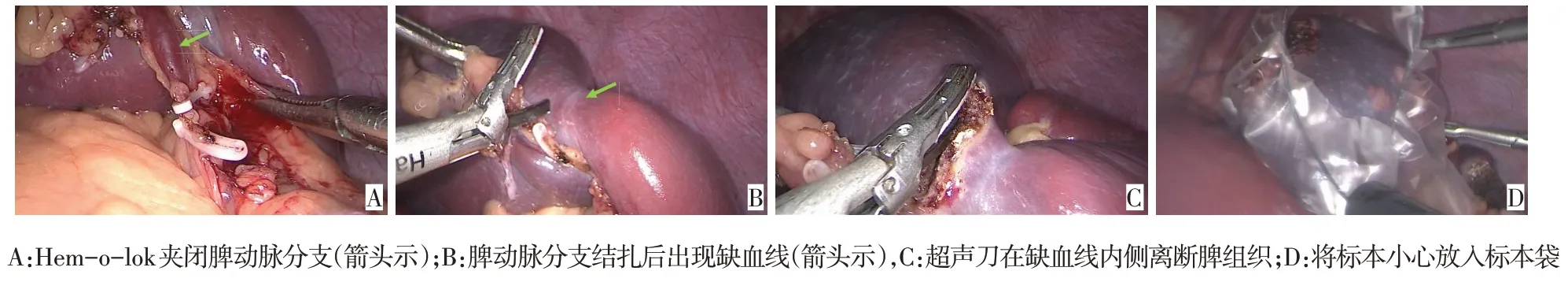
Fig.2 Intraoperative operation diagram of LPS图2 LPS术中操作图
1.3 术后管理和随访 如患者术后生命体征平稳,1~2 d 后转入普通病房。术后第1天和第3天检测血常规和引流液中淀粉酶水平。此后每隔3 d检测1次,以确认是否发生血小板增多症(血小板计数≥400×109/L)和胰瘘。胰瘘诊断标准参照国际胰瘘研究小组(ISGPF)2016 年版标准[5]。术后5 d 行增强CT检查腹腔内是否有积液,如腹腔内无积液,引流液呈浆液性,且无胰瘘发生,拔除引流管。患者于腹腔引流管拔除后第2 天出院。术后随访至出院后1 个月,随访资料包括影像学检查(超声或CT)和实验室检查(血常规)。
1.4 主要观察指标 术中指标:手术时间、术中出血量、术中输血量。术后恢复指标:排气排便时间、下地活动时间、拔管时间、术后住院时间、总住院费用、术后输血量、住院期间血小板增多症发生率和胰瘘发生率。出院后随访期间主要观察指标为血小板增多症发生率。
1.5 统计学方法 采用SPSS 17.0 进行数据分析。首先用Shapiro-Wilk 检验验证计量资料是否符合正态分布,符合正态分布的计量资料以均数±标准差()表示,组间比较采用独立样本t检验。计数资料以例(%)表示,组间比较采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 2 组患者基线资料比较 LTS 组和LPS 组的年龄、性别和病变直径比较,差异均无统计学意义(P>0.05),见表1。

Tab.1 Comparison of general data between the two groups表1 2组患者一般资料比较
2.2 2组手术情况和术后恢复情况比较 与LPS组相比,LTS组手术时间缩短,术中出血量和术中输血量减少(P<0.01);2组术后排气、排便时间和下地活动时间比较差异无统计学意义(P>0.05);LPS 组拔管时间和术后住院时间均较LTS组延长(P<0.05),但总住院费用差异无统计学意义(P>0.05);2 组均无术后输血病例;LPS 组住院期间血小板增多症发生率较低(P<0.01);2 组胰瘘发生率相似(P>0.05),见表2。出院后1 个月随访时,LPS 组血小板增多症的发生率较LTS 组明显降低(P<0.01),见表2。

Tab.2 Surgery and postoperative recovery of the two groups表2 2组手术情况和术后恢复情况
3 讨论
脾是人体重要的淋巴器官,在抗感染和机体免疫中起着重要的作用。以往由于手术技术的限制,脾良性占位性病变多采用TS 治疗。随着对脾解剖结构研究的深入和腹腔镜技术的进步,外科医生认为LPS 是治疗脾良性占位性病变安全有效的方法[6-7]。而对脾恶性肿瘤而言,TS 仍然是治疗金标准[8]。既往认为,PS术式要求脾病变局限于脾的上、下极或脾周围区域,且术后剩余脾体积至少应为原有的25%以上[9]。本研究中,病变位于脾两极者行LPS,位于脾中间的或者靠近脾门者行LTS。最近Bing 等[10]报道 1 例脾血管瘤位于脾中央,肿瘤完全位于脾上、下段缺血线的中间,患者行脾中极切除术。在 Manciu 等[11]研究中,4 例患者占位位于脾中央,且脾门血管是散在分布的,仍然接受LPS,术后只保留了脾上极或者下极的一小部分。由此可见,中央型脾良性占位并非LPS的绝对禁忌证。
本研究中LTS 组手术时间短于LPS 组,主要原因是LPS不需要分离通向脾上、下极的血管,只需在腔镜下直线切割吻合器整块切断脾蒂。LTS组术中出血量和术中输血量均少于LPS 组。LPS 组出血多发生在沿缺血线离断脾脏时,而止血则是对主刀医师手术技术及主刀和助手配合熟练程度的考验[12]。2 组患者在排气时间、排便时间和下地活动时间方面比较无明显差异,表明2 组患者的术后恢复情况相似。由于保留部分脾脏,LPS 组血小板增多症发生率低于LTS组。此外,LPS组拔管时间较LTS组延长约1 d,主要是由于脾脏断面渗血导致引流时间延长,拔管时间延长也导致了术后住院时间延长。术后LTS 组有4 例发生胰瘘,主要是由于腹腔镜下切割闭合器操作时导致胰尾损伤。日本内镜外科学会(JSES)的一项调查显示,LTS 术后胰瘘发生率为7.7%[13]。本研究中4 例胰瘘患者症状较轻,通过延长拔管时间和使用生长抑素类似物,患者均得以康复。2组住院总费用无明显差异,说明虽然LPS组术后住院时间比LTS 组长,但并没有给患者带来更大的经济负担。
LPS仍是一项风险、难度较高的手术,术前需严格掌握手术指征。目前主要指征包括病变局限于脾两极、病变直径>5 cm 等;此外,循环系统的一些疾病,包括免疫性血小板减少性紫癜、遗传性球形红细胞增多症、自身免疫性溶血性贫血、Ⅰ~Ⅲ级外伤性脾破裂患者也可考虑LPS治疗[14-15]。相信随着手术量的增加和外科手术技术的改善,手术适应证可适当扩大。术中应注意:(1)处理脾门血管前,可先在脾动脉主干上放置血管阻断带,以便在术中出现难以控制的大出血时阻断脾动脉进行止血。切除脾上极病变时,应切断胃脾韧带,结扎胃短血管,否则病变脾脏仍存在血供;切除脾下极病变时,则应注意保护胃短血管[7]。(2)二次细分离脾蒂是手术成功的关键,由于脾静脉分支壁薄,易损伤,此时应逐束结扎,离断病变极段的脾叶血管,切勿多束、大块处理血管[9]。(3)切除病变脾时,超声刀应沿着缺血线从浅层到深层进行切割,由于脾的缺血面并不是一个平面,直接沿缺血线离断可能损伤相邻的脾节段,造成不必要的出血。
综上所述,当脾良性占位位于脾的两极时,LPS是一种安全成熟的治疗方法。然而,LPS 较LTS 操作难度大,需要由熟练的外科医生团队共同完成。短期来看,LPS 可以有效降低术后血小板增多症的发生率,应该在有条件的医院予以推广。
