多模态影像学术前评估浸润性乳腺癌组织学分级
2021-10-26梁园园李昌帅赵文静聂家秋于艳妮
梁园园,李昌帅,赵文静,张 敏,郭 荣,聂家秋,于艳妮,耿 海*
(1.潍坊医学院医学影像学院,山东 潍坊 261053;2.潍坊市人民医院放射科,3.超声科,山东 潍坊 261041)
乳腺癌发病率居中国女性常见癌症之首,是30~59岁女性最常见的死亡原因[1]。早发现、早治疗可改善乳腺癌预后[2-3]。乳腺癌组织学分级与其预后关系密切[4],组织学等级越高,恶性程度越高,预后越差[5]。乳腺癌术前组织学分级多由侵入性穿刺活检获得[6],通过影像学表现无创预测乳腺癌组织学分级具有重要临床价值。本研究分析多模态影像学术前评估浸润性乳腺癌组织学分级的价值。
1 资料与方法
1.1 一般资料 回顾性分析2019年12月—2020年11月69例于潍坊市人民医院经手术病理证实的女性浸润性乳腺癌患者,年龄32~63岁,平均(52.2±6.4)岁;均为单发病灶,最大径0.6~5.4 cm,平均(2.34±0.95)cm。纳入标准:①术前接受乳腺X射线摄影、超声及MR检查,各项检查间隔时间不超过1周;②临床及影像学资料完整;③于影像学检查后3天内行手术或穿刺活检。排除标准:①严重精神疾病或身体情况无法配合检查;②影像学检查前有乳腺手术史(包括穿刺活检)或治疗史;③合并其他恶性肿瘤;④病灶呈非肿块样强化。
1.2 仪器与方法
1.2.1 乳腺X射线摄影 采用Siemens Mammomat Inspiration数字化乳腺摄影机行双侧乳腺头足(cranio-caudol, CC)位及内外斜(mediolateral oblique, MLO)位摄影,Opdose全自动数字曝光参数,根据需要手动调整参数。
1.2.2 超声检查 采用GE Logiq E9高频超声诊断仪,ML6-15线阵探头,频率7.5~15.0 MHz,根据乳腺组织厚度调整探头频率。嘱患者仰卧,暴露两侧乳腺及腋窝,以乳腺扫描条件行扇形扫查。
1.2.3 MR检查 采用GE Discovery 750W 3.0T MR仪。嘱患者俯卧,使双乳垂于乳腺专用线圈内。扫描序列及参数见表1。DCE-MRI扫描时间60秒/期,共8期(蒙片及7期强化)。经肘静脉以流率2.0 ml/s注射对比剂钆喷酸葡胺0.1 mmol/kg体质量后,跟注20 ml生理盐水,依次采集蒙片及行7期强化扫描,并绘制时间-信号强度曲线(time-signal intensity curve, TIC)。

表1 乳腺MR扫描序列及参数
1.3 图像分析
1.3.1 乳腺X射线摄影 由2名有5年以上放射科(X线)工作经验的医师(中级及以上职称)观察病灶有无可疑微小钙化及毛刺征。
1.3.2 超声 由2名有5年以上工作经验的超声科医师(中级及以上职称)测量乳腺病灶纵横比,判断腋窝淋巴结是否转移。符合下列任意项即考虑淋巴结转移:①淋巴结形态失常,正常结构消失;②淋巴结门消失或回声减低;③皮髓质分界不清;④皮质不对称增厚;⑤淋巴结内部彩色血流信号丰富或周边血供增多。
1.3.3 MRI 由2名有5年以上MR工作经验的影像科医师(中级及以上职称)评价病灶形状、边缘、内部强化方式、TIC类型、皮肤及乳头是否侵犯等;并于DWI、DKI原始图像上勾画ROI,保持其大小基本一致,测量表观弥散系数(apparent diffusion coefficient, ADC)、平均弥散率(mean diffusivity, MD)及平均峰度(mean kurtosis, MK);均于多次测量后取平均值作为结果。

表3 Ⅰ+Ⅱ级与Ⅲ级浸润性乳腺癌超声表现比较[个(%)]
1.4 组织学分级 于影像学检查后3天内行手术或穿刺活检,采用诺丁汉联合组织学分级(Nottingham combined histologic grade, NCHG)[7]对浸润性乳腺癌进行组织学分级。
1.5 统计学分析 采用SPSS 22.0统计分析软件。以±s表示符合正态分布的计量资料,组间比较采用t检验。对计数资料采用χ2检验或Fisher精确概率法进行比较。采用受试者工作特征(receiver operating characteristic, ROC)曲线,评估ADC、MD及MK对浸润性乳腺癌组织学分级的诊断效能。P<0.05为差异有统计学意义。
2 结果
69例浸润性乳腺癌中,组织学分级Ⅰ级4例、Ⅱ级28例(图1)、Ⅲ级37例,均表现为肿块样强化;包括浸润性导管癌41例,浸润性小叶癌17例,浸润性微乳头状癌7例,黏液腺癌、浸润性乳头状癌、腺样囊性癌、炎性乳腺癌各1例。
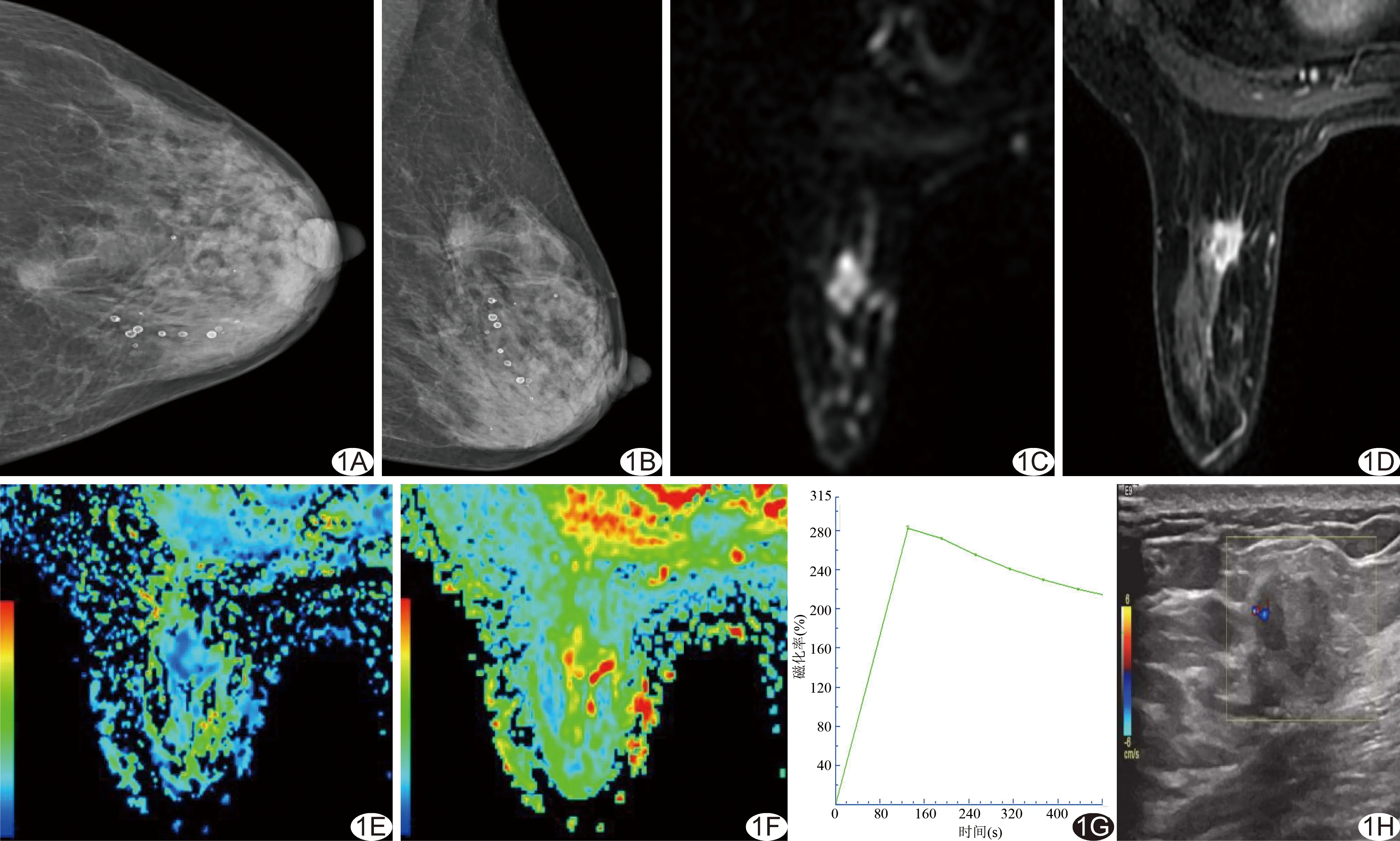
图1 患者女,57岁,左乳乳腺浸润性癌,Ⅱ级 A、B.乳腺CC位(A)及MLO位(B)X线片示左乳内上象限病变形态不规则,呈分叶状; C.DWI示病变高信号; D.DCE-MRI第7期图示病灶明显强化,形态不规则,边缘可见毛刺、分叶; E、F.分别为MD、MK伪彩图,MD=0.81 mm2/s,MK=1.31; G.Ⅲ型TIC; H.超声声像图示病灶形态不规则,纵横比>1,后方伴声影
Ⅰ+Ⅱ级与Ⅲ级浸润性乳腺癌之间,可疑微小钙化及毛刺征、腋窝淋巴结转移及ADC、MK、MD值差异均有统计学意义(P均<0.05),其余影像学表现差异均无统计学意义(P均>0.05),见表2~4。

表2 Ⅰ+Ⅱ级与Ⅲ级浸润性乳腺癌乳腺X线表现比较[个(%)]
ROC曲线结果显示,MK、MD及ADC预测浸润性乳腺癌组织学分级的AUC分别为0.93、0.88及0.80(P均<0.05),见表5及图2。

表4 Ⅰ+Ⅱ级与Ⅲ级浸润性乳腺癌MRI表现及参数比较

表5 ADC、MD、MK预测浸润性乳腺癌组织学分级的效能
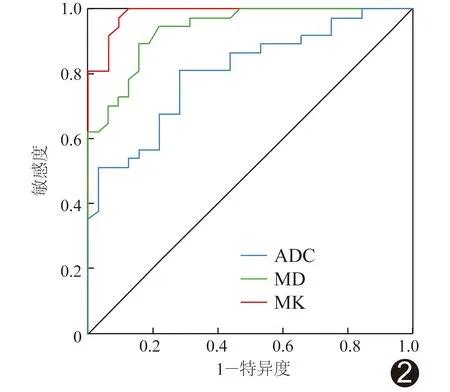
图2 ADC、MD及MK术前预测浸润性乳腺癌组织学分级的ROC曲线
3 讨论
乳腺癌组织学分级为影响患者预后的独立因素[8],对不同组织学分级肿瘤的手术方式不同,预后亦不同[9]。乳腺X射线摄影为筛查乳腺癌的主要手段,可显示微小钙化及毛刺征,进而发现早期乳腺癌。随着技术的不断进步,超声亦可用于诊断及鉴别诊断乳腺癌。乳腺MRI可显示更多信息,观察病灶强化方式及周围情况,对检出小病灶具有重要价值。
毛刺征对乳腺癌组织学分级具有一定提示意义,可作为诊断乳腺癌的重要依据;其形成原因在于病灶周围大量纤维组织增生及小管形成,而癌细胞在其间浸润生长,存在密度差异而表现为毛刺。本研究发现毛征刺更多见于低级别(Ⅰ+Ⅱ级)乳腺癌,可能与低级别乳腺癌相对高级别(Ⅲ级)者生长缓慢、周围纤维组织增生相对显著有关,与AU等[10]的研究结果相符。
微小钙化是诊断乳腺癌的重要依据。陈卫国等[11]认为多形性微钙化多见于浸润性癌,其形成原因多为肿瘤生长速度较快、血供不足[12]。本研究发现微小钙化更多存在于高级别乳腺癌,与尉志红等[13]的结果不同,但本组病例数较少,代表性不足,尚需进一步观察。
乳腺癌腋窝淋巴结转移与治疗方式及预后有关[14]。阮玫等[15]认为淋巴结皮质增厚(>0.54 cm)及淋巴结周围脂肪间隙模糊高度提示淋巴结转移。本研究发现腋窝淋巴结转移与浸润性乳腺癌组织学分级相关,高级别乳腺癌更易发生腋窝淋巴结转移,可能与其恶性度更高、更早侵犯邻近淋巴组织有关。韦军等[16]指出,病理分级Ⅲ级是早期乳腺癌腋窝淋巴结转移的独立危险因素。
DWI可反映活体组织中水分子扩散水平。本研究中Ⅰ+Ⅱ级浸润性乳腺癌ADC值高于Ⅲ级,与陈雅青等[17]的结果一致,原因可能在于分级较高的乳腺癌缺乏管样及腺体样结构,而其核多形性及有丝分裂计数较高,内部结构排列更为紧密[18],导致弥散受限更为明显。DKI以水分子非高斯分布为理论基础,可准确反映人体环境中水分子扩散情况[19]。MK值是DKI的最重要参数之一,其大小与组织结构复杂度呈正比[20];MD值则是经过校正的ADC值。本研究发现Ⅰ+Ⅱ级浸润性乳腺癌MK值高于Ⅲ级而MD值低于Ⅲ级;ROC曲线结果显示,MK值预测浸润性乳腺癌组织学分级的AUC为0.93,MD值的AUC为0.88,表明MK、MD值均可用于评估浸润性乳腺癌组织学分级。
综上,多模态影像学技术可用于评估浸润性乳腺癌组织学分级。但本研究样本量小,且未分析多种影像学技术联合诊断的效能,有待进一步完善。