2’-岩藻基乳糖对益生菌定殖及抗炎能力的影响
2021-10-24杨文君刘同杰崔庆宇吕优优公丕民易华西章检明刘大群张兰威
杨文君,刘同杰,梁 曦,张 喆,崔庆宇,吕优优,公丕民,易华西,章检明,刘大群,张兰威,
(1.中国海洋大学食品科学与工程学院,山东青岛 266000;2.浙江省农业科学院,浙江省农业绿色生物制造核心菌种改良重点实验室,浙江杭州 310021)
坏死性小肠结肠炎(Necrotizing enterocolitis,NEC)是新生儿常见的消化道疾病,炎症反应是导致其发生的重要危险因素之一[1−2]。国内外研究表明母乳低聚糖或益生菌可以通过抑制炎症反应的发生,降低婴幼儿患NEC的概率[3−5]。2’-岩藻基乳糖(2’-Fucosyllactose,2’-FL)是母乳中含量较高的低聚糖[6],其具有许多重要的生理功能,如促进益生菌粘附、增殖[7],促进肠道细胞分化成熟[8],增强肠道黏膜屏障[9−10],抑制致病菌侵袭[11],维持肠道菌群平衡等。2’-FL可能在抑制婴幼儿NEC炎症反应发生中发挥重要作用,临床研究表明喂养添加2’-FL配方奶粉的婴儿血浆中炎性细胞因子的含量显著低于喂食普通配方奶粉的婴儿,这些炎性细胞因子含量下降了29%~83%[12]。体外研究表明2’-FL可以作为拮抗剂,抑制免疫受体TLR5和TLR7,防止发生过度免疫反应;还可以通过抑制炎症因子的产生来抑制脂多糖(Lipopolysaccharide,LPS)介导的细胞炎症反应[13−14]。
益生菌则可以通过降低炎症因子的表达,抑制NEC炎症反应的发生[15]。临床研究表明补充益生菌制剂的NEC患儿的炎症因子(TNF-α、IFN-γ、IL-6)含量显著降低,炎症的严重程度随之降低[16]。体外研究同样展现出益生菌抑制炎症细胞表达炎症因子(TNF-α、IL-6和IL-1β)的抗炎作用[17−18]。
现有研究表明母乳低聚糖的混合物可以促进益生菌定殖[19],协助益生菌发挥益生功能,但具体是哪些低聚糖在发挥作用并不是十分清晰。2’-FL是母乳中含量较高的低聚糖,其对益生菌定殖能力和抗炎作用的影响还未见报道。因此本实验探讨了2’-FL对乳酸菌和双歧杆菌增殖、粘附肠道细胞能力的影响,并利用LPS诱导的Raw264.7细胞炎症模型,筛选出可以抑制NEC相关炎性因子的乳酸菌和双歧杆菌,进一步探讨2’-FL的添加对这些菌株抗炎效果的影响,为开发特殊婴幼儿配方奶粉提供基础。
1 材料与方法
1.1 材料与仪器
Man Rogosa Sharp(MRS)肉汤培养基、MRS无碳源培养基 青岛海博生物技术有限公司;胰蛋白酶、DMEM高糖培养基 北京索莱宝生物技术有限公司;青霉素-链霉素混合溶液、Triton-X-100、5(6)-羧基二乙酸荧光素琥珀酰亚胺酯(CFDA-SE) 碧云天生物技术公司;细胞活性检测(CCK-8)试剂盒GLPbio公司;特级胎牛血清 BI公司;NO试剂盒南京建成生物工程研究所;肿瘤坏死因子-α、白介素(IL)-6、IL-1β、IL-10试剂盒 苏州卡尔文生物科技有限公司;脂多糖(LPS)来源于大肠杆菌055 B5Sigma-Aldrich公司;2’-岩藻基乳糖 丹尼斯克(中国)有限公司;Caco-2细胞、Raw264.7细胞 中国科学院细胞库;实验所用双歧杆菌菌株:两歧双歧杆菌(Bifidobacterium bifidum)FL-276.1和FL-228.1;乳酸菌菌株包括:口乳杆菌(Lactobacillus oris)MN-33、FN-448、FN-473、FN-519、ML-329,鼠李糖乳杆菌(Lactobacillus rhamnosus)MN-431、FN-518、FN-470,植物乳杆菌(Lactobacillus plantarum)MN-169、FN-16,干酪乳杆菌(Lactobacillus casei)、FN-345、FN-377、ML-446,粪肠球菌(Enterococcus faecalis)MN-77、FN-19、ML-506、FN-313、ML-1、ML-2,屎肠 球 菌(Enterococcus faecium)FN-515、FN-249、FN-500、FN-484、ML-523、FN-483,肠球菌(Enterococcussp.)ML-237,鸟肠球菌(Enterococcus avium)ML-490 保藏于实验室菌库;鼠李糖乳杆菌(Lactobacillus rhamnosus)LGG 购买自ATCC细胞库;实验所用其它试剂均为国产分析纯。
SW-CJ-1D超净工作台 苏州净化仪器有限公司;LDWZX-75KBS高压蒸汽灭菌锅 上海申安医疗器械有限公司;LRH-250生化培养箱 上海一恒仪器有限公司;PB-10酸度计 赛多利斯仪器有限公司;CKX53荧光倒置显微镜 日本OLYMPUS公司;TG20KR-D高速冷冻离心机 长沙东旺仪器有限公司;MW80二氧化碳培养箱 上海皓庄仪器有限公司;VARIOSKAN FLASH全波长多功能酶标仪赛默飞世尔科技公司。
1.2 实验方法
1.2.1 菌株活化与菌悬液制备 实验菌株按照2%接种量接种于MRS液体培养基。37 ℃培养20 h活化。活化第3代的菌株培养液于4 ℃,6500 ×g条件下离心4 min,收集菌体,菌体用PBS缓冲液洗涤三次,最后用PBS或者DMEM培养基重悬,菌体悬液浓度按照下述实验的具体要求进行调整[20]。
1.2.2 2’-FL对乳酸菌和双歧杆菌增殖的影响 无碳源的MRS培养基中添加2.5 mg/mL的2’-FL或葡萄糖,将活化的第3代实验菌株培养液以2%接种量接种到上述培养基中,37 ℃培养24 h后测定发酵液的OD600nm和pH。分别以不添加碳源培养基和含葡萄糖培养基为空白对照和阳性对照,比较2’-FL对实验菌株增殖的效果[21]。
1.2.3 细胞培养 Caco-2细胞、Raw264.7细胞以DMEM完全培养基(含10%胎牛血清和1%青霉素-链霉素混合液)于37 ℃、5% CO2的培养箱中培养,每两天换液1次,待细胞生长至80%,用胰蛋白酶将细胞消化成单层,进行传代培养[22]。
1.2.4 菌株荧光标记 CFDA-SE用二甲基亚砜配制成1 mmol/L的溶液,经0.22 μm滤膜过滤。每1 mL PBS重悬的菌体悬液(约为109CFU/mL)添加20 μL CFDA染液,混匀,37 ℃避光孵育20 min。标记的菌体悬液于4 ℃,6500 ×g离心4 min,去除上清液。菌体沉淀用PBS洗涤3次,最后用DMEM培养基重悬并调整浓度为4×108CFU/mL[23]。
1.2.5 2’-FL对乳酸菌和双歧杆菌粘附Caco-2细胞的影响 Caco-2细胞以2×105个/mL,接种于48孔板,每2 d换液1次。待Caco-2细胞生长为紧密单层,用PBS洗涤细胞层以除去抗生素,2’-FL干预组加入含有2’-FL(终浓度为2.5 mg/mL)的100 μL DMEM培养基及100 μL荧光标记的4×108CFU/mL的菌体悬液,对照组加入100 μL DMEM培养基及100 μL荧光标记的菌体悬液。37 ℃孵育2 h后,用PBS缓冲液洗涤3次,将未粘附的菌洗脱。加入100 μL 0.5% TritonX-100溶液处理5 min,之后加入100 μL PBS缓冲液。收集孔内的液体,用酶标仪测定其荧光强度。吸收光波长为488 nm,发射光波长为518 nm。细菌的粘附率为细菌粘附细胞并用PBS洗脱后的荧光强度同细菌粘附细胞前的荧光强度的比值。2’-FL对菌株粘附细胞的影响结果用粘附倍数,即2’-FL干预组细菌的粘附率同对照组细菌的粘附率的比值表示[24]。
1.2.6 菌株对细胞增殖的影响 Raw264.7细胞以2×104个/孔接种100 μL于96孔板,细胞贴壁8 h可用于实验。实验菌株(2’-FL可以促进增殖或粘附的菌株)按照1.2.1的方法,制成DMEM重悬的菌体悬液,并调节浓度为107CFU/mL。实验菌干预组细胞加入100 μL DMEM重悬的菌体悬液,对照组细胞加DMEM培养基。于细胞培养箱中培养16 h后每孔加入10 μL的CCK-8溶液,37 ℃避光孵育2 h,于酶标仪450 nm波长处测定吸光度值(OD450nm)。计算时各组细胞需减去DMEM培养基的吸光度值[25]。

式 中:A2为 干 预 组OD450nm;A1为 对 照 组OD450nm;A0为培养基OD450nm(空白调零值)。
1.2.7 2’-FL对细胞增殖的影响 2’-FL干预组细胞加入100 μL含有终浓度为1.25、2.5、5、10 mg/mL的2’-FL的DMEM培养基。其它条件同1.2.6。
1.2.8 潜在抗炎菌株的筛选 Raw264.7细胞以2×105个/孔接种于24孔板,细胞贴壁8 h后更换成实验分组的培养基。其中LPS模型组细胞的DMEM培养基中含有终浓度为100 ng/mL的LPS,实验菌干预组除LPS外还含有终浓度为107CFU/mL的实验菌(所用菌株为2’-FL可以促进增殖或粘附且不会对细胞增殖产生明显副作用的菌株),对照组只加DMEM培养基。干预16 h后,收集细胞培养上清液,用相应的试剂盒并按照说明书的方法,依次测定上清液中的细胞因子NO、TNF-α、IL-1β、IL-6和IL-10含量[18,26−27]。
1.2.9 2’-FL对LPS诱导的Raw264.7细胞炎症的调节作用 2’-FL干预组除含LPS外还含有终浓度为5 mg/mL的2’-FL。其余同1.2.8。
1.2.10 联合干预组对LPS诱导的Raw264.7细胞炎症的调节作用 各组细胞按照表1实验分组所示更换各组的DMEM培养基。其余同1.2.8。
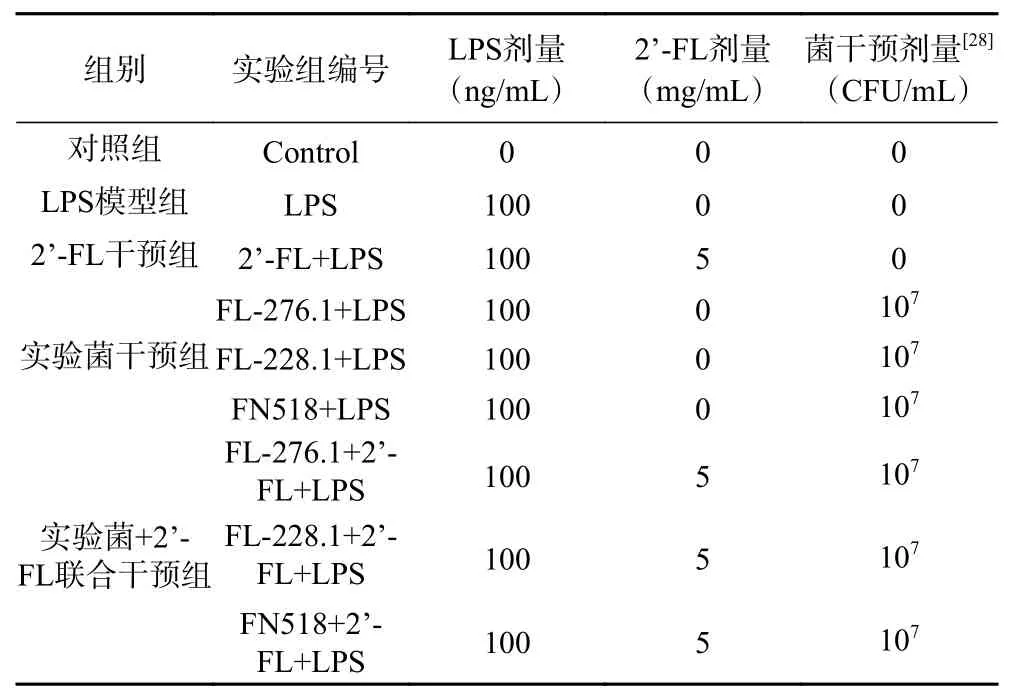
表1 实验分组Table 1 Experimental groups
1.2.11 联合干预组对LPS诱导的Raw264.7细胞形态的影响 按1.2.10中的方法干预,16 h后在倒置显微镜中观察细胞形态并拍照[27]
1.3 数据处理
所有实验均重复3次。实验结果通过独立样本T检验或单因素方差分析进行统计学分析,并采用Duncan检验进行多重比较分析实验数据间的差异性,其中P<0.05为具有显著性差异,所用分析软件为SPSS 20.0。实验做图均采用Prism8.0软件绘制。
2 结果与分析
2.1 2’-FL对乳酸菌和双歧杆菌增殖的影响
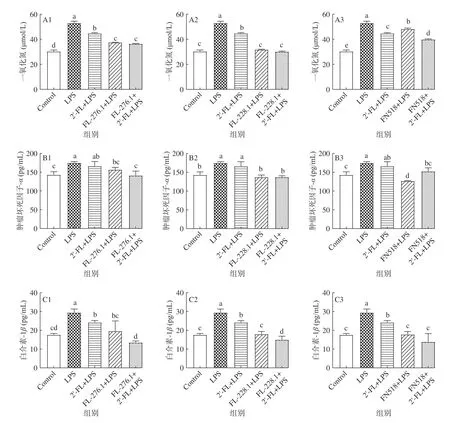
由图1A可以看出,在2’-FL添加培养基中,30株菌中只有两株双歧杆菌FL-276.1和FL-228.1的OD600nm值较不添加碳源培养基显著增加(P<0.05),其他乳酸杆菌和肠球菌的OD600nm值无显著性差异(P˃0.05),因此可以确定2’-FL能促进FL-276.1和FL-228.1增殖。FL-276.1利用2’-FL作为碳源增殖的效率低于利用葡萄糖(P<0.05),而FL-228.1利用2’-FL的增殖效率优于利用葡萄糖(P<0.05),这表明2’-FL促增殖效果具有菌株差异性。Yu等[21]研究了25株菌利用2’-FL进行增殖的情况。结果同本研究结果相一致的是实验中的双歧杆菌可以代谢2’-FL,但鼠李糖乳杆菌、粪肠球菌和梭菌等则不能代谢2’-FL。本实验结果表明2’-FL可以特异性促进两歧双歧杆菌FL-276.1和FL-228.1的增殖,但促进效果具有菌株差异性。

图1 2’-FL对乳酸菌和双歧杆菌OD600 nm(A)和pH下降值(B)的影响Fig.1 Effects of 2’-FL on the OD600 nm(A) and pH drop(B) of lactic acid bacteria and Bifidobacteria
由图1B可以看出,与对菌株增殖的影响相一致,两歧双歧杆菌FL-276.1和FL-228.1在添加2’-FL培养基中的pH下降值显著高于不添加碳源培养基(P<0.05)。其他乳酸杆菌和肠球菌在添加2’-FL培养基中的pH下降值与不添加碳源培养基没有显著性差异(P˃0.05),低于在葡萄糖培养基中的pH下降值。本实验结果表明2’-FL可以被特定的双歧杆菌利用产酸,但是难以被乳酸杆菌、肠球菌等乳酸菌利用。2’-FL是母乳中含量较高的岩藻基低聚糖,其不能被婴儿消化吸收,但可以被肠道中的益生菌利用[29]。本研究结果显示可以利用该糖进行增殖和产酸的益生菌株较少,两歧双歧杆菌可能因为含有可以代谢岩藻基乳糖的糖苷酶[29],因此能够利用2’-FL进行增殖和产酸,这有助于增强其竞争性定殖于婴幼儿肠道的能力。
2.2 2’-FL对乳酸菌和双歧杆菌粘附Caco-2细胞能力的影响
从图2中可以看出2’-FL可以显著提高乳酸菌(ML-1、FN515、FN518、FN249、ML329)和双歧杆菌(FL-276.1)粘附Caco-2细胞的能力(P<0.05)。且2’-FL的促进粘附效果具有菌株差异性,同为双歧杆菌,仅有FL-276.1的粘附能被2’-FL促进。已有的研究结果表明一些母乳低聚糖可以促进益生菌粘附肠道细胞。Zhang等[30]的实验结果显示2’-FL可以促进两歧双歧杆菌在Caco-2细胞上粘附,这与本实验中2’-FL显著促进两歧双歧杆菌FL-276.1粘附的结果相一致。Kong等[7]的研究表明2’-FL可以促进乳杆菌粘附Caco-2细胞。在本实验中2’-FL则显示出对鼠李糖乳杆菌FN518的促进粘附效果。益生菌的粘附能力是其在婴幼儿肠道中定殖的重要影响因素[7]。2’-FL可以促进乳酸菌和双歧杆菌粘附肠道细胞,因此有助于这些菌株在婴幼儿肠道中定殖,更好地发挥益生功能。
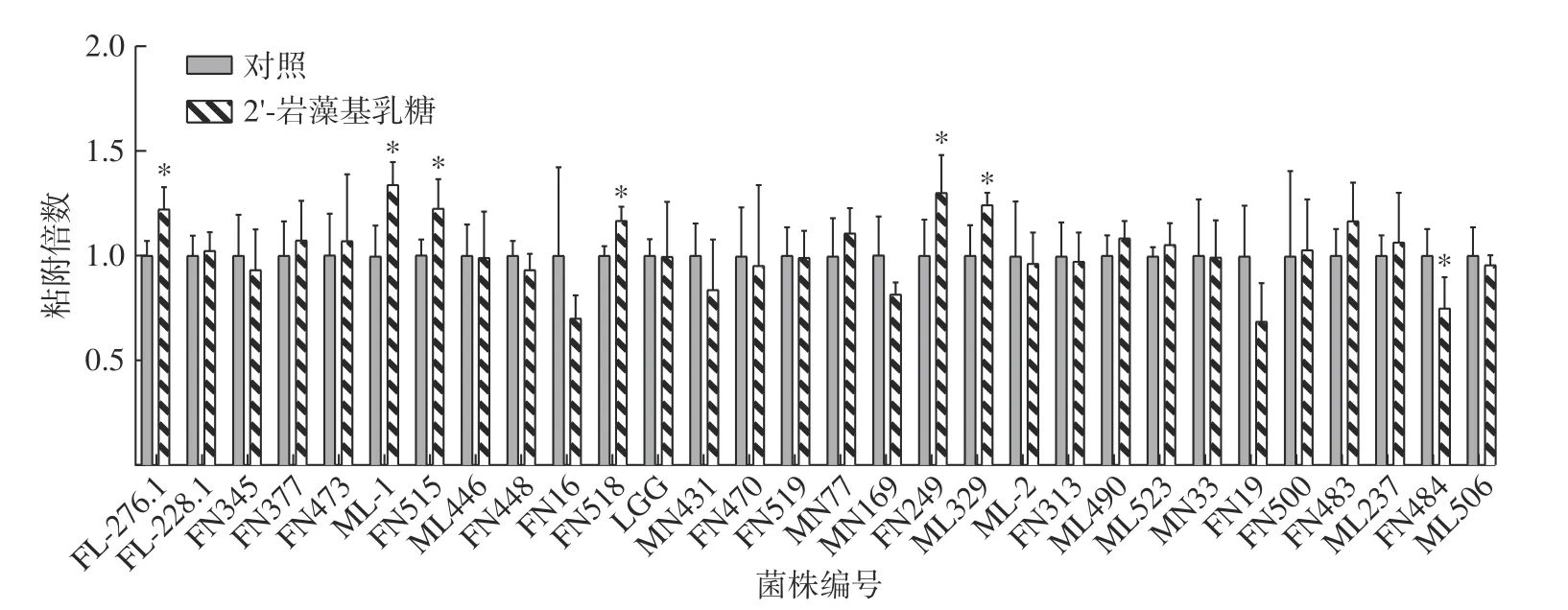
图2 2’-FL对乳酸菌和双歧杆菌粘附Caco-2细胞的能力的影响Fig.2 Effect of 2’-FL on the adhesion of lactic acid bacteria and bifidobacterial to Caco-2 cells
2.3 潜在抗炎菌株的筛选
选择2’-FL可以促进增殖或粘附的菌株,即乳酸菌(ML-1、FN515、FN518、FN249、ML329)和双歧杆菌(FL-276.1、FL-228.1),进一步研究它们对巨噬细胞Raw264.7炎性反应的改善作用。从图3A中可以看出乳酸菌和双歧杆菌不能促进Raw264.7细胞增殖,可能是因为乳酸菌和双歧杆菌在干预细胞的过程中会和细胞竞争营养,并产酸,改变了细胞的生存环境,对其增殖有一定的毒害作用。因此,选取对细胞有害影响相对较小即细胞增值率大于85%的菌株用于后续抗炎菌株的筛选,包括FL-276.1、FL-228.1、FN518、ML-1、ML329和FN515。
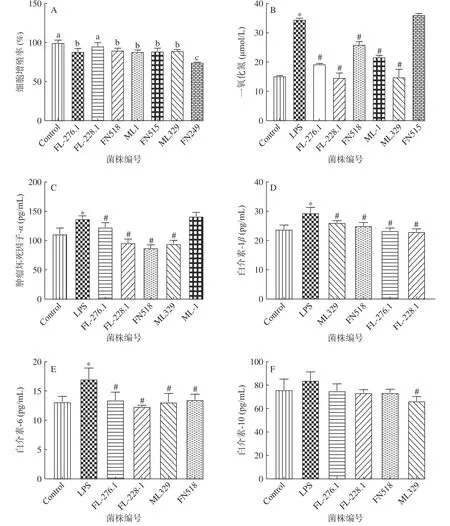
图3 乳酸菌和双歧杆菌对Raw264.7细胞的增殖及细胞因子分泌的调节作用Fig.3 Regulatory effects of lactic acid bacteria and Bifidobacteria on Raw264.7 cell viability and the secretion of cytokines
LPS诱导Raw264.7细胞,刺激细胞产生NO、TNF-α、IL-1β、IL-6等炎症因子,诱导细胞发生炎性反应[18]。本研究选择依次降低炎症因子NO、TNFα、IL-1β、IL-6的顺序筛选抗炎菌株,并依次淘汰不达标菌株。结果从图3B-F中可以看出LPS组的NO、TNF-α、IL-1β、IL-6的浓度显著高于对照组(P<0.05),表明细胞正在进行过度炎症反应。研究表明益生菌能够通过降低细胞炎症因子的分泌和增加抗炎因子的分泌来减轻细胞的炎症损伤[18,26,31]。本研究中的FL-276.1、FL-228.1、FN518能显著降低LPS诱导产生的4种炎性因子NO、TNF-α、IL-1β和IL-6(P<0.05),且对抗炎因子IL-10的产生无显著负面影响。因此,以上3株菌相比于其它实验菌株是潜在的抗炎菌株。它们可能通过抑制炎症因子的产生,进而阻断炎症级联反应的发生,从而减轻细胞的炎症反应[26]。
2.4 2’-FL对Raw264.7细胞的增殖及其细胞因子分泌的调节作用
从图4A中可以看出不高于5 mg/mL的2’-FL对Raw264.7细胞增殖无显著的毒害作用,结合图4B可以看出,2’-FL显著降低(P<0.05)由LPS诱导Raw264.7分泌的炎性指示物NO,且呈剂量效应关系,这一结果与He等[13]的结果相似。因5 mg/mL的2’-FL抑制炎症效果最好,后续实验均采用该浓度。从图4C~图4F中可以看出2’-FL可以降低由LPS刺激产生的IL-6和IL-1β,不能显著降低TNFα和增加IL-10的产量(P<0.05)。研究表明,2’-FL可以通过降低炎症因子的含量,减轻炎症反应[12−13]。本实验结果表明在终浓度为5 mg/mL的体系中,2’-FL可显著降低由LPS诱导的Raw264.7中NO、IL-6和IL-1β的产量(P<0.05),显示了一定的抗炎能力。
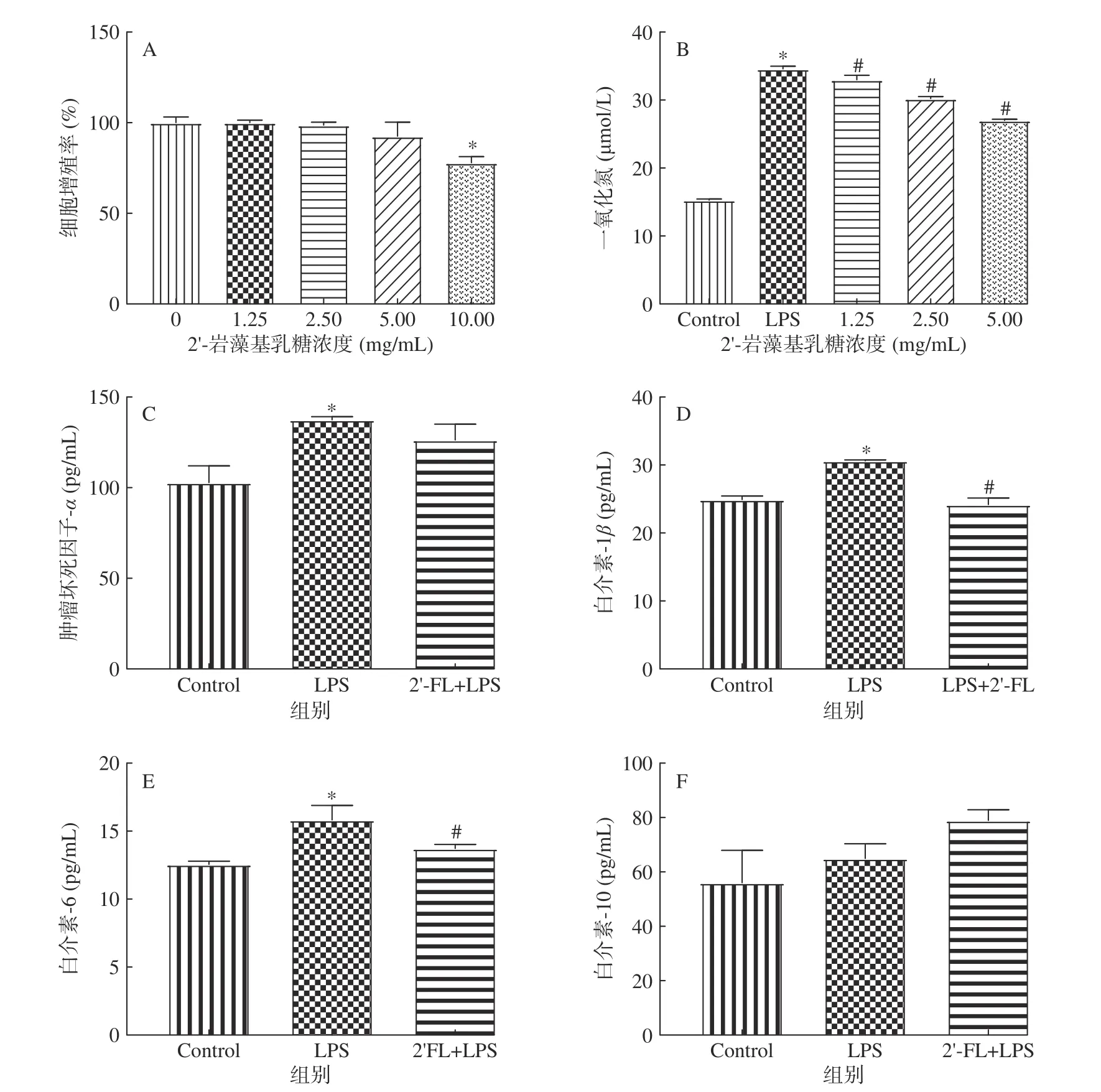
图4 2’-FL对Raw264.7细胞的增殖及细胞因子分泌的调节作用Fig.4 Regulatory effects of 2’-FL on Raw264.7 cell viability and the secretion of cytokines
2.5 潜在抗炎益生菌与2’-FL联用的抗炎效果
由前述结果可知,2’-FL单独使用不会显著降低LPS诱导产生的TNF-α,但从图5B1和图5B2中可以看出2’-FL与FL-276.1或FL-228.1联用后则可以显著降低TNF-α的分泌(P<0.05)。2’-FL单独使用可以显著降低分泌的炎症因子NO和IL-1β在与乳酸菌和双歧杆菌联用后,降低效果更显著(P<0.05)。从图5中还中可以看出2’-FL与FL-276.1、FL-228.1和FN518联用都显著降低了炎症因子的分泌(P<0.05),但因菌株本身的抗炎效果具有差异性,2’-FL与菌株联用后表现为不同的炎症因子的分泌下降。相比单用FL-276.1,联用可显著降低IL-6和IL-1β的分泌(P<0.05);相比FL-228.1,联用可显著降低IL-1β的分泌(P<0.05);相比FN518,联用可显著降低NO的分泌(P<0.05),然而,2’-FL对N518抑制TNF-α的产生却有不利影响。由以上实验结果可知,2’-FL与乳酸菌和双歧杆菌联用,总体可以发挥协同抗炎的效果,但因菌株差异效果有所差别。其中2’-FL与FL-276.1协同降低的炎症因子最多,协同效果最好。Duncan等[32]的实验发现牛乳低聚糖与鼠李糖乳杆菌或罗伊氏乳杆菌联用可以在体外减轻艰难梭菌毒素A对T84细胞的破坏。其结果同本实验中益生菌与低聚糖联用具有协同作用,且联用的保护效果会因为菌株不同而存在差异性的结果相一致。
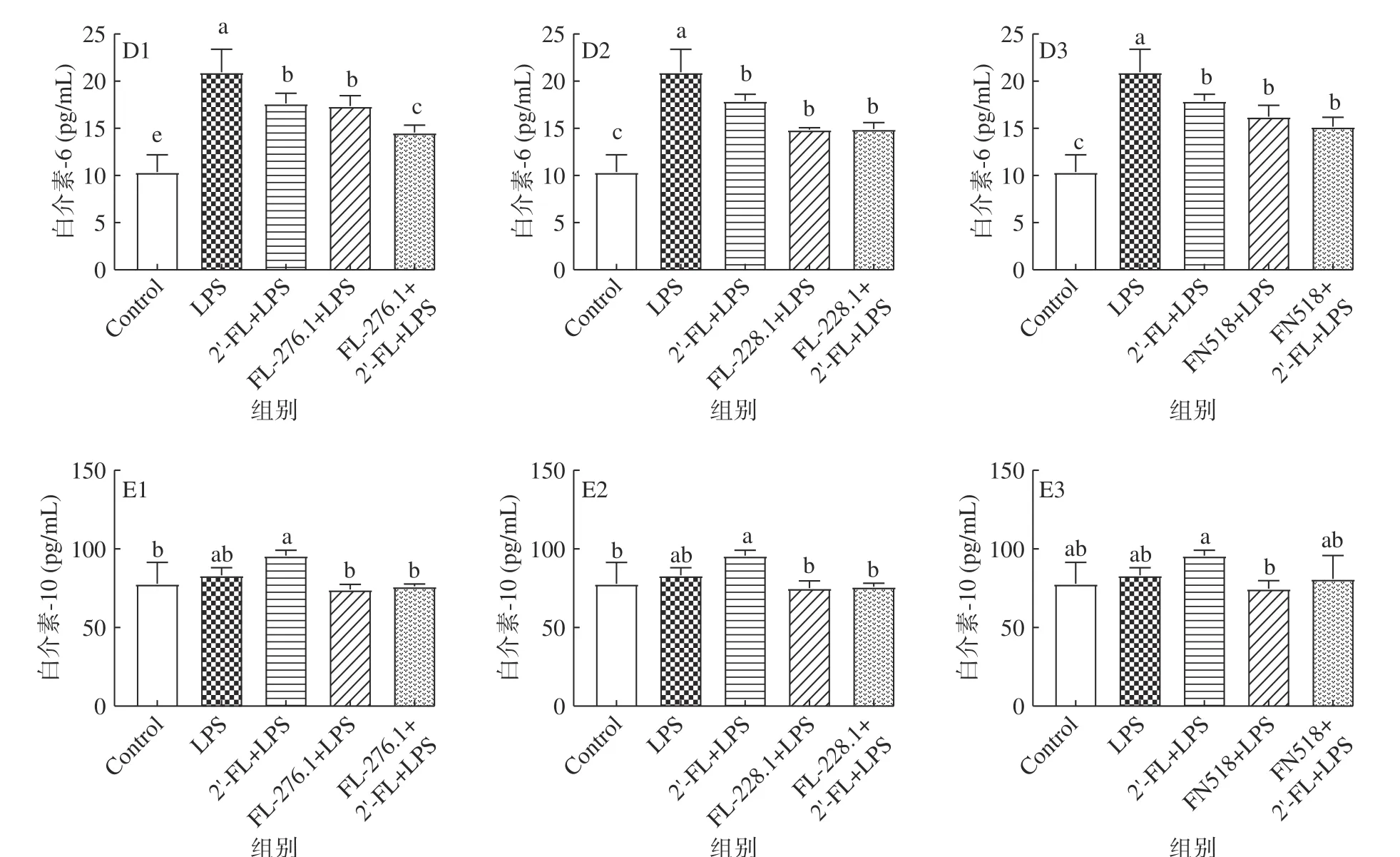
图5 2’-FL与乳酸菌和双歧杆菌联用对Raw264.7细胞的增殖及细胞因子分泌的调节作用Fig.5 Regulatory effects of combined use of 2’-FL and lactic acid bacteria and Bifidobacteria on the secretion of cytokines of Raw264.7
2.6 对Raw264.7细胞形态的影响
从图6中可以看出,对照组Raw264.7细胞为椭圆形,LPS模型组细胞形态不规则且具有伪足,模型构建成功[33]。2’-FL添加组发生不规则变化和产生伪足细胞的比例减少,表明2’-FL可以减弱LPS诱导的细胞形态变化。双歧杆菌FL-276.1、FL-228.1或鼠李糖乳杆菌FN518也可以在一定程度上降低LPS造成细胞形态的不规则变化,但不能完全抑制,且不同菌株的抑制效果不同。2’-FL和菌株联用后对细胞形态变化的抑制效果更好,其中FL-276.1和2’-FL共同干预组抑制细胞形态变化的作用最强。细胞形态发生不规则变化的比例减少的同时,会伴随着炎症因子的分泌减少[33]。这也与本研究中FL-276.1和2’-FL协同降低的炎症因子最多的结果相一致。

图6 乳酸菌和双歧杆菌或2’-FL以及二者联合作用对Raw264.7细胞形态的影响Fig.6 Effects of lactic acid bacteria and Bifidobacteria or 2’-FL and the combination of the two on the morphology of Raw264.7 cells
3 结论
综上所述,2’-FL可以促进双歧杆菌FL-276.1和FL-228.1增殖,可以提高双歧杆菌FL-276.1和乳酸菌(ML-1、FN515、FN518、FN249、ML329)粘附细胞的能力,可以与潜在抗炎菌株(两岐双歧杆菌FL-276.1和FL-228.1、鼠李糖乳杆菌FN518)发挥协同抗炎作用。即2’-FL可以提高乳酸菌和双歧杆菌的定殖(粘附、增殖)能力与抗炎作用,但作用效果具有菌株差异性,该结果可以为缓解坏死性小肠结肠炎的炎症反应提供理论基础,为开发功能性婴儿配方奶粉提供新的思路。但本研究中2’-FL协同菌株抗炎的作用机制,以及2’-FL对益生菌定殖和抗炎作用的影响在体内是否同样可以发挥作用,都有待进行深入的研究。
