Fe3O4@ZrO2磁纳米粒子在酪蛋白磷酸肽富集中的应用
2021-10-24潘玉婷严新宇
潘玉婷,杨 静,严新宇,李 娜
(浙江九安检测科技有限公司,浙江杭州 310053)
酪蛋白磷酸肽(Casein Phosphopeptides,CPP)是一类含有磷酸丝氨酸的短肽,作为食品添加剂使用,安全性很高。目前,国内外有很多CPP生理功能的研究报道。研究表明,CPP可以防止钙在小肠内沉淀,显著促进钙的吸收,并对钙的代谢产生积极的影响[1−3];可防龋齿,作为牙齿抗菌剂和再矿化剂加入牙膏中[4−5];可防牙釉质脱矿,有效恢复牙釉质漂白过程中钙的丢失[6−7];具有抗肿瘤、抗菌、免疫调节和细胞调节等特性[8]。
在食品领域中,传统的CPP分离技术(钙-乙醇沉淀法、离子交换法、膜分离法)步骤复杂、成本高、较难实现工业化[9]。近年来,金属氧化物(如二氧化钛、二氧化锆)涂层吸附剂已被证实为磷酸肽富集的有效材料,和最常用的金属离子亲和吸附法相比,它除了具有亲属离子亲和吸附的所有优点外,还解决了金属离子的残留问题,并且对磷酸肽有更强的特异吸附性,材料也更易重复使用[10−11]。此外,磁性亲和探针因其磁特性而易于从样品溶液中分离出与磁材料特异结合的目标物,极大地缩短了分离所需时间。在磷酸化蛋白质组学中,有诸多关于磁性粒子快速分离一些目标分析物的研究[12]。许多金属氧化物(包括TiO2和SiO2等)包覆的Fe3O4磁性微球被合成,并成功地应用于磷酸化蛋白组学中,进行选择性富集磷酸化肽的研究[13−14],在食品工业磷酸肽富集工艺中的应用却鲜有报道。因此本文采用金属氧化物亲和磁性纳米粒子(Fe3O4@ZrO2)作为富集CPP的载体,对高质量高纯度CPP 的生产具有重要的指导意义。
1 材料与方法
1.1 材料与仪器
七水硫酸亚铁(FeSO4·7H2O)、六水氯化铁(FeCl3·6H2O)、聚乙二醇6000(PEG 6000)、25%氨水、95%乙醇、八水氯氧化锆(ZrOCl2·8H2O)、干酪素、胰蛋白酶、氢氧化钠、冰醋酸、乙酸钠 分析纯,国药集团化学试剂有限公司;实验中所用水 均为GB/T 6682规定的二级水。
H-7650透射电子显微镜 日本Hitachi公司;DK-S28型电热恒温水浴锅 上海精宏实验设备有限公司;AM-6250B型恒温磁力搅拌器 天津奥特赛恩斯仪器有限公司;FE20K型pH计、AB104-N电子分析天平 梅特勒-托利多仪器(上海)有限公司;冷冻干燥机 美国Labconco公司;Sigma 6-15大容量离心机 郑州南北仪器设备有限公司;ZHWY-2102恒温摇床 上海智城分析仪器制造有限公司;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;IKA旋转蒸发仪RV10 上海楚柏实验室设备有限公司;IKA数显加热锅HB10 北京海淀晶晶科技有限公司。
1.2 实验方法
1.2.1 Fe3O4@ZrO2磁纳米粒子的制备 采用化学共沉淀法制备Fe3O4@ZrO2磁性纳米粒子[15−17]。配制水和无水乙醇的混合溶液(体积比5:1)于四口烧瓶中,将一定量的FeSO4·7H2O和FeCl3·6H2O加入四口烧瓶中(总铁离子浓度为0.03 mol/L,Fe2+与Fe3+摩尔比2:3),通入保护气(N2),以800 r/min持续搅拌,待溶解后,加入一定量的聚乙二醇6000,升温至60 ℃,使用滴液漏斗缓慢加入沉淀剂25%NH3·H2O,使体系的pH≥10,水浴恒温15 min后,加入8.5% ZrOCl2·8H2O溶液,升温至80 ℃,恒温1 h后结束反应。用蒸馏水反复洗涤直至中性,倾去上层清液,冷冻干燥48 h后,研磨即得Fe3O4@ZrO2磁纳米粒子,并通过投射电子显微镜获得其微观形态,通过外加磁场观察其磁性。
1.2.2 CPP的制备工艺 参考文献[18]:取500 mL蒸馏水置于酶解器中50 ℃循环水浴预热,再加入25 g干酪素,预热至50 ℃,用10 mol/L NaOH调pH至8.0,稳定15 min后,加入适量胰蛋白酶,即刻计时,用碱式滴定管加入0.5 mol/L的NaOH溶液调pH至8.0并在反应中保持该pH;记录消耗NaOH的量V(NaOH);反应3 h后将样品溶液转移至大烧杯中,于90 ℃水浴锅中加热灭酶10 min,冷却至室温,用冰醋酸调pH至4.5,离心(8000 r/min,4 ℃)20 min,取上清液置于40 ℃恒温水浴,压强600 mm汞柱的旋转蒸发仪中,80 r/min浓缩约3 h,至20 min内不再有冷凝液滴出,再冷冻干燥,研磨混匀制得CPP粗品。
采用pH-Stat法,记录酶解期间消耗的0.5 mol/L NaOH溶液的量V(NaOH),计算水解度(DH,%):
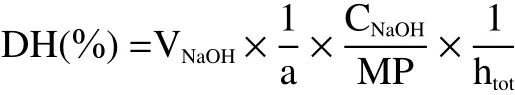
式中:VNaOH为水解过程中用去的NaOH的量(mL);CNaOH为NaOH的浓度(mol/L);MP为蛋白质总量(g);htot为每克蛋白质中肽键的克当量,即原料蛋白质中肽键被裂解的百分数,其表示蛋白质被酶催化水解的程度,对于某一特定的蛋白质来说是一个常数,酪蛋白htot=8.2;1/a为氨基酸解离度(pH8.0,50 ℃时,1/a=1.13)。
1.2.3 用金属氧化物磁性材料Fe3O4@ZrO2纳米粒子富集CPP 在预先配制的乙酸-乙酸钠缓冲液(0.2 mol/L)中加入一定质量的CPP制成CPP溶液,并置于一定温度恒温摇床中进行预热,之后加入适量Fe3O4@ZrO2磁性材料在恒温摇床中进行吸附。吸附结束后,在磁场作用下,将吸附有CPP的材料从肽溶液中分离取其上清液,即未被吸附的CPP的量。
酪蛋白分子含有的磷酸基数量是一定的,N/P较小则产品中不含磷酸基的肽段被切除和分离的越多,CPP制品的磷酸基含量相对较高。冯凤琴等[19]对不同来源的CPP的N/P、分子大小及结合钙的最大量进行分析和测定,得出N/P越小,则CPP制品的纯度越高或磷酸基密度越大。因此,CPP中氮与磷的摩尔比值(即N/P)能客观、综合地反映CPP肽链的长短、磷酸基密度、产品的纯度及结合钙能力等理化性质,本实验以N/P和吸附量作为评价指标[20]。
用缓冲液冲洗材料,再加入一定pH的NaOH溶液,置于一定温度恒温摇床中进行洗脱。洗脱结束后,在磁场作用下,将材料从溶液中分离出来,得到上清液,此即解析下来的CPP的量,测其N/P及洗脱率[21−22]。
1.2.4 实验设计 影响金属氧化物磁性材料Fe3O4@ZrO2磁纳米粒子富集CPP的因素很多,需进行单因素实验来选取最佳工艺。首先恒定CPP溶液的pH为6、CPP溶液的初始浓度为40 mg/mL、吸附时间为30 min、吸附温度为30 ℃等实验条件,研究酪蛋白水解度对富集实验的影响,CPP水解度区间范围选择为12%~22%。之后依次确定CPP溶液pH、吸附时间、吸附温度、CPP溶液初始浓度的最佳条件。
1.3 数据处理
1.3.1 N/P的计算 用N/P(摩尔比)来衡量CPP的纯度,按下式计算:

式中,R为最终得到产物的N/P;CoN为原溶液中N的质量浓度(mg/mL);CeN为磁纳米粒子吸附后的上清液中N的质量浓度(mg/mL);CoP为原溶液中P的质量浓度(mg/mL);CeP为磁纳米粒子吸附后的上清液中P的质量浓度(mg/mL);31为P的相对分子质量;14为N的相对分子质量。
1.3.2 吸附量的计算

CoN:原溶液中N的质量浓度(mg/mL);CeN:磁纳米粒子吸附后的上清液中N的质量浓度(mg/mL)。
1.3.3 洗脱率的计算

X:洗脱率,%;m1:磁纳米粒子上吸附的蛋白质的含量(g);m2:洗脱下来的蛋白质的含量(g)。
2 结果与分析
2.1 Fe3O4@ZrO2纳米粒子的表征
用透射电子显微镜(TEM)表征Fe3O4@ZrO2纳米粒子。
由图1可知,Fe3O4@ZrO2磁纳米粒子呈球形,粒径约为50 nm。由图2可知,在外加磁场的作用下,具有超顺磁性的纳米粒子可向磁场方向聚集,撤去磁场后,又可迅速分散,不会被永久磁化。

图1 Fe3O4在修饰ZrO2后的TEM照片Fig.1 TEM graph of Fe3O4 after coating with ZrO2

图2 水溶液中的Fe3O4@ZrO2磁纳米粒子在磁场辅助下的超顺磁性Fig.2 Superparamagnetism of Fe3O4@ZrO2 magnetic nanoparticles in aqueous solution assisted by applied magnetic field
2.2 水解度对Fe3O4@ZrO2磁纳米粒子富集CPP的影响
采用pH-Stat法,测定CPP水解度。水解时间对水解度的影响结果见图3,由图3可知,水解度随酶解时间的增加而增加,但是随着后期时间的延长,到达一定时间后,曲线的斜率变化不是很明显,说明水解反应基本结束,故本实验选用的水解度区间范围为12%~22%。而水解度与NaOH的消耗量为正比,因此,可以通过控制滴加碱液量来控制水解度大小[23]。
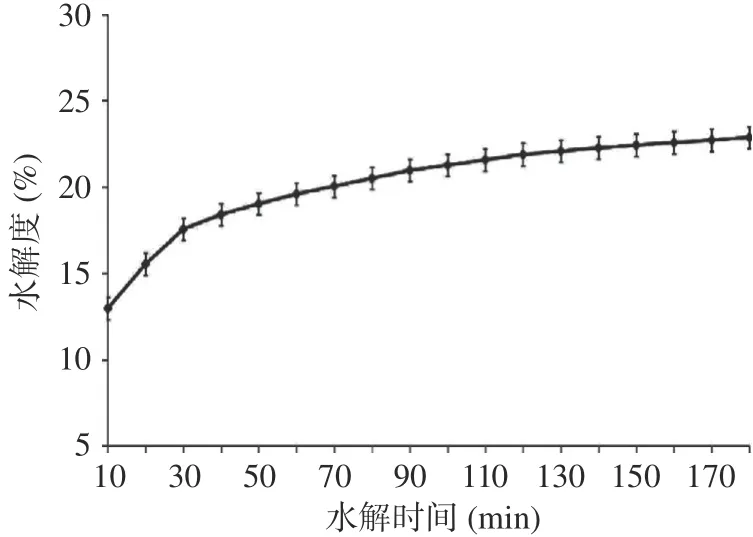
图3 不同酶解时间对CPP水解度的影响Fig.3 Effect of different enzymatic hydrolysis time on the degree of hydrolysis of CPP
水解度对N/P和吸附量的影响见图4,由图4可知,在实验所选择的水解度范围内,随着水解度的升高,被Fe3O4@ZrO2磁纳米粒子吸附上的CPP的N/P随之降低,当水解度22%时N/P达到最低。因为随着水解度提高,高分子量组分降低,CPP肽链缩短,而CPP含有的磷酸基数量是一定的,所以N/P越小则产品中不含磷酸基的肽段被切除和分离的越多,CPP制品的磷酸基含量相对越高,纯度越高[24]。

图4 水解度对Fe3O4@ZrO2磁纳米粒子富集CPP N/P与吸附量的影响Fig.4 Effects of degrees of hydrolysis on the N/P and adsorption capacity of CPP enriched by Fe3O4@ZrO2 magnetic nanoparticles
被Fe3O4@ZrO2磁纳米粒子吸附上的CPP的吸附量变化随水解度的提高大致呈现上升趋势,当水解度达到22%时,所能达到的N/P最低且吸附量最高。可能是肽链越短的CPP越容易被本材料吸附。综上表明,富集CPP的最适酪蛋白水解度为22%。
2.3 肽溶液pH对Fe3O4@ZrO2磁纳米粒子富集CPP的影响
从图5中可知,被Fe3O4@ZrO2磁纳米粒子吸附上的CPP的N/P先随着pH的升高而逐渐降低,当pH为4.5时N/P达到最低,随后随着pH的升高而升高。同时从吸附量上分析,pH为4.5和5时较低,其他pH条件下较高,应该是Fe3O4@ZrO2磁纳米粒子吸附了磷酸肽的同时,也吸附了非磷酸肽。再来比较pH为4.5和5时的吸附量可知,pH为4.5时的吸附量较高,这说明pH4.5的吸附条件所富集的CPP纯度最高,且吸附量也较pH5时的高。在酸性条件下,ZrO2能够选择性吸附磷酸肽是因为ZrO2具有强路易斯酸的性质,随着pH的升高,ZrO2的路易斯酸性能损耗更多,磷酸肽不再是主导品种,所以CPP的纯度降低,N/P值就随之升高[11]。

图5 pH对Fe3O4@ZrO2磁纳米粒子富集CPP N/P与吸附量的影响Fig.5 Effect of pH on the N/P and adsorption capacity of CPP enriched by Fe3O4@ZrO2 magnetic nanoparticles
综上表明,CPP溶液的pH对Fe3O4@ZrO2磁纳米粒子富集CPP的能力影响较大,该材料富集CPP的最适pH为4.5。
2.4 吸附时间对Fe3O4@ZrO2磁纳米粒子富集CPP的影响
介于磁纳米粒子的优点:具有较小的粒径和较大的比表面积,从图6中可知,初始阶段吸附速率较快,N/P值下降较快,随着时间的继续延长,N/P值趋于平稳。原因是在反应进程中,底物不断减少,同时吸附剂的作用位点逐渐饱和,使得吸附速度逐渐下降,经过30 min,所吸附的CPP纯度基本达到平衡[17]。

图6 吸附时间对Fe3O4@ZrO2磁纳米粒子富集CPP N/P与吸附量的影响Fig.6 Effects of adsorption time on the N/P and adsorption capacity of CPP enriched by Fe3O4@ZrO2 magnetic nanoparticles
在25 min之前,随着时间的延长,吸附量不断下降,当N/P较高时,CPP的肽链较长,纯度较低,而随着CPP的肽链缩短,N/P不断降低,磁纳米粒子的吸附量也随之降低;25 min之后,吸附量逐渐增大,到了50 min后趋于水平,说明50 min时磁纳米粒子的吸附能力已达到饱和。且吸附时间过长不仅会导致能量的浪费,还对磁纳米粒子的使用寿命也有一定的影响。所以吸附时间设定为50 min最优。
2.5 吸附温度对Fe3O4@ZrO2磁纳米粒子富集CPP的影响
从图7中可知:在30 ℃之前,N/P下降很快,吸附量也相应降低,30 ℃之后,随着温度的进一步提高,N/P却略有升高,吸附量变化不明显。说明适当的吸附温度,有利于提高富集效果。一方面应该是磁纳米粒子与CPP之间的相互作用力随温度的升高而增加,另一方面应该分子运动随温度的升高而加速,磁纳米粒子与 CPP 之间的碰撞几率会增大,从而也有利于CPP 的富集[25]。结果表明,吸附温度设定为30 ℃最优。
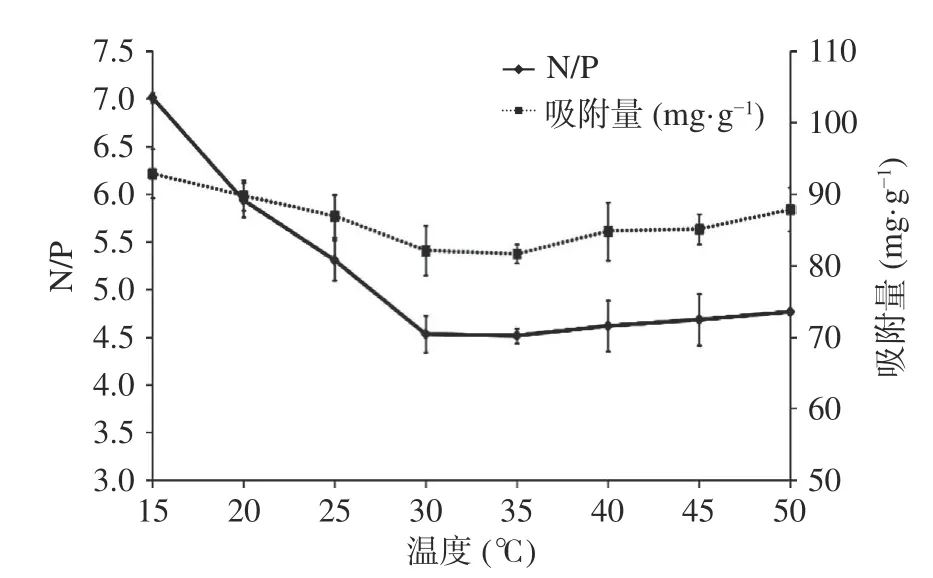
图7 吸附温度对Fe3O4@ZrO2磁纳米粒子富集CPP N/P与吸附量的影响Fig.7 Effects of adsorption temperature on the N/P and adsorption capacity of CPP enriched by Fe3O4@ZrO2 magnetic nanoparticles
2.6 肽溶液初始浓度对Fe3O4@ZrO2磁纳米粒子富集CPP的影响
从图8中可知,随着CPP溶液初始浓度的增加,所得CPP的N/P变化较大,最低达到4.87,而当初始浓度大于50 mg/mL时,所得肽的N/P趋于平衡。因为初始浓度较低,载体与底物之间的碰撞几率较小,结合机率也相应较小,因此富集效果较差,导致所得CPP的纯度较低,因此适宜浓度的CPP溶液有利于提高富集效果。

图8 Fe3O4@ZrO2磁纳米粒子富集CPP初始浓度对N/P与吸附量的影响Fig.8 Effects of different initial concentration on the N/P and adsorption capacity of CPP enriched by Fe3O4@ZrO2 magnetic nanoparticles
吸附量在肽溶液浓度为30 mg/mL之前呈上升趋势,在30 mg/mL时达到最大,之后下降,40 mg/mL之后趋于水平。在肽溶液浓度为30mg/mL之前,由于浓度太低,Fe3O4@ZrO2磁纳米粒子所吸附的非磷酸肽随着浓度的增加也增多。在肽溶液浓度为50 mg/mL之后,N/P趋于水平,吸附量也相应基本不变。
综上表明,在本实验条件下,当CPP溶液的初始浓度为50 mg/mL时,Fe3O4@ZrO2磁纳米粒子对CPP产生有效吸附的位点已经基本达到饱和。
2.7 洗脱实验
将富集得到的含有CPP的Fe3O4@ZrO2磁纳米粒子溶于不同pH的NaOH溶液中进行洗脱,分别以N含量和P含量作为评价指标,洗脱效果见图9。结果表明,无论从N含量分析还是从P含量分析,其趋势都相同:当NaOH溶液的pH达到13时,超过95%的CPP即可被有效洗脱。

图9 不同pH条件下N含量和P含量的洗脱率Fig.9 Elution rate of N content and P content at different pH
3 结论
综合上述研究,所得结果:采用Fe3O4@ZrO2磁纳米粒子富集CPP,过程便捷,N/P下降明显,所得CPP的纯度较高,说明所用Fe3O4@ZrO2磁纳米粒子对CPP具有较好的特异吸附性能,Fe3O4@ZrO2磁纳米粒子在CPP分离纯化中具有广阔的应用潜力。
由于实验室与工业化的生产有一定的区别,工业化生产的操作过程较粗糙、简陋一些,因此结果会有一定的不同,但总的生产工艺是相同的。因此应该在实验室研究的基础上进行工厂试验,以得到良好的社会效益。此外,本实验的洗脱液采用浓碱,之后必须进行酸碱中和过程,造成脱盐的问题,为后续工艺增加了繁琐性。且采用浓碱作为洗脱液的确会对最终所得CPP产品带来影响,因为CPP在碱性条件下,稳定性较差,所以洗脱之后必须马上对CPP溶液进行酸碱中和处理。希望后续研究者能找到更好的洗脱液来提高材料的重复利用率和CPP的产品质量。
