豇豆淀粉的提取及理化性质研究
2021-10-24李家豪张善英任赛豪章程辉
李家豪,张善英,任赛豪,王 萌 ,章程辉,
(1.海南大学食品科学与工程学院,海南海口 570228;2.农业农村部农产品质量安全风险评估实验室(海口),海南海口 570228;3.海南大学植物保护学院,海南海口 570228)
豇豆(Vigna unguiculata(L.)Walp.)是一种在世界范围内广泛种植的重要豆科植物,特别是在热带和亚热带地区广泛种植[1−2]。长豇豆(Vigna unguiculata(L.)Walp. ssp.unguiculatacv.-gr.sesquipedalis)(2n=2x=22)是豇豆的一种,是在我国广泛种植的重要栽培亚种[3]。在西非等地区,豇豆籽被单独蒸煮作为主粮或者与其他作物混合食用,而在我国,豇豆长期以来被广泛地作为蔬菜食用。
据报道,豇豆籽含有50%~66%的淀粉和16%~31%的蛋白质,是淀粉和蛋白质的优质廉价来源[4]。豇豆淀粉因为直链淀粉含量高、抗剪切能力强、老化速度快并且抗性淀粉高(9.42%~32.14%),越来越受到研究人员的关注[5]。豇豆淀粉也是一种适合于食品工业的质构改良剂[6],其具有良好的耐酸和耐酶解的能力,并且老化特性突出[7]。随着食品市场的进一步发展,人们对具有较好新功能的替代淀粉来源需求激增,豇豆非常适合作为一种新型的工业淀粉新来源[8]。
长豇豆长期被作为一种蔬菜食用,研究人员对长豇豆的关注点主要集中在农药残留等方面,而对其潜在应用前景缺乏研究。其中对长豇豆淀粉的研究更是极为有限,特别是在提取、结构和性质等方面鲜有报道。本文以长豇豆为主要研究对象,研究豇豆淀粉的提取工艺及其结构与理化性质,为豇豆淀粉在食品工业及其他相关领域的研究和应用提供一定的理论基础与数据支撑。
1 材料与方法
1.1 材料与仪器
长豇豆 于2020年收获自海南大学实验基地(N20°03′22″,E110°19′20″),平均温度与相对湿度为27~34 ℃和63%~82%,收获时长豇豆处于开花结荚期,种子完全成熟,籽粒饱满;总淀粉含量测定试剂盒(Total Starch Assay Kit) 爱尔兰Megazyme;其余化学试剂 均为分析纯。
Verios G4 UC型场发射扫描电子显微镜 美国赛默飞世尔科技公司;T27型傅立叶变换红外光谱仪德国布鲁克公司;Q600型热重分析仪、DSC250型差示扫描量热仪 美国TA公司;Smart Lab X射线衍射仪 日本理学株式会社;ZS90型激光粒度仪英国马尔文公司;FiveEasy Plus FE28型pH计美国梅特勒-托利多公司;QUINTIX124型电子天平德国赛多利斯科学仪器公司。
1.2 实验方法
1.2.1 豇豆淀粉的提取工艺 豇豆淀粉的提取工艺改进自Ratnaningsih等[9]、王苗苗等[10]的方法。去除长豇豆的荚,得到豇豆样品,将100 g豇豆4 ℃下浸泡于0.05 mol/L NaOH溶液中一定时间,加500 mL水两次磨浆后过150目筛收集豆浆,在豆浆中加入酸调节pH为6左右静置过夜,离心(3000×g,10 min)后取沉淀,用乙醚除脂肪后置干燥箱中烘干过夜,即得粗提物。取粗提物加水配制成乳液,加入一定量的无水乙醇于三角瓶中,在摇床中振荡后取出,离心(3000×g,10 min),沉淀中加入水洗涤3次后烘干过夜。平行实验三次后计算平均提取率。豇豆淀粉的提取路线如图1:

图1 豇豆淀粉的提取流程图Fig.1 Flow chart of extraction of cowpea starch
1.2.2 单因素实验 目前,豆类淀粉提取方面研究通常参照薯类淀粉提取方面的研究指标,以得率与提取率为衡量提取工艺的指标。因此本文根据此基础进行了修改,将所提取淀粉的纯度引入计算中,亦使用得率与提取率这一指标,以下式表示:
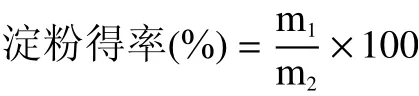
式中:m1:提取淀粉的质量(干基),g;m2:原料干重,g。
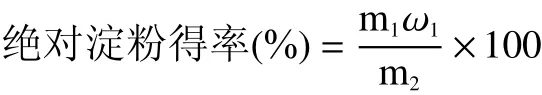
式中:m1:提取淀粉的质量(干基),g;ω1:提取淀粉的纯度,%;m2:原料干重,g。

式中:f:绝对淀粉得率,%;w:原料中淀粉的质量分数,%。
本文采用湿磨法结合酸浆法提取路线,考察NaOH溶液的体积(200、400、600、800、1000 mL)、浸泡时间(8、12、16、20、24 h)、乙醇的体积(40、60、80、100、120 mL)、振荡时间(20、40、60、80、100 min)以及振荡转速(40、80、120、160、200 r/min)五个因素对豇豆淀粉提取率的影响,实验中均选取中值为固定因素水平,所有实验均进行三次重复。
1.2.3 响应面优化设计 使用Design-expert8.2软件,采用Box-Behnken(BBD)设计方法,根据单因素实验结果,选取五因素三水平实验设计方案优化淀粉提取工艺。Box-Behnken设计响应面试验设计因素水平及编码见表1。

表1 响应面试验因素水平表Table 1 Factors and levels of response surface test
1.2.4 豇豆淀粉组分含量测定 水分含量参照AOAC(1997)标准方法进行测定;蛋白质含量参照GB/T 5009.5-2016进行测定;脂肪含量参照GB/T 5009.6-2016进行测定;灰分含量参照GB/T 5009.4-2016进行测定;粗纤维含量参照GB/T 5515-2008进行测定;淀粉含量使用Total Starch Assay Kit试剂盒进行测定。
1.2.5 淀粉pH、溶解度和膨润力的测定 称取一定量的淀粉样品,配制样品干基含量5%(w/w)的淀粉乳,用FiveEasy Plus FE28型pH计测量样品pH。
称取质量记为W的淀粉样品,配制样品干基含量5%(w/w)的淀粉乳,30 ℃搅拌30 min后,至于离心管中,3000×g离心15 min。取上清液在蒸发皿中100 ℃蒸干后,放入105 ℃烘箱中烘干称重,记为W1;取下层称重为W2。溶解度(SI)与膨润力(SP)计算公式如下:

1.2.6 淀粉颗粒表面形貌的测定 使用Verios G4 UC场发射扫描电子显微镜观察淀粉的颗粒形态。取适量淀粉干基样品黏附于样品台的双面导电胶上,在离子溅射装置中喷金后,使用电子显微镜对淀粉颗粒进行成像观察,选择代表性颗粒拍摄成像。
1.2.7 淀粉颗粒粒径分布的测定 使用激光粒径分析仪测定淀粉样品颗粒的粒度分布。在室温下用乙醇分散样品,并将样品超声处理5 min,以避免结块的形成[11]。
1.2.8 淀粉傅里叶变换红外光谱(FTIR)测定 使用傅里叶变换红外光谱仪测定淀粉的红外光谱。采用KBr压片法,将预平衡水分的样品以一定比例(1%,w/w)加入KBr粉末中充分研磨混匀后压片,置于红外光谱仪中进行扫描。测试条件为分辨率4 cm−1,空气为空白,扫描64次。利用OPUS 6.5软件对谱图进行基线校正和归一化处理,所有测量均一式三份。
1.2.9 淀粉结晶结构的测定 使用Smart Lab X射线衍射仪(XRD)进行结晶结构分析。将待测样品置于饱和NaCl条件下平衡7 d,取一定量的待测样品平铺于样品池中制样。采用单色Cu-Kα射线,测试条件为:扫描区域2θ=4°~30°,扫描步长0.02°,扫描速度4°/min,扫描方式为连续,获得衍射图谱。使用软件Origin 2018,定量计算衍射图下结晶面积与总面积之间的比率表征淀粉的相对结晶度[12]。
1.2.10 淀粉热力学性质的测定 使用Q600型热重分析仪和DSC250型差示扫描量热仪测定样品的热力学性质。将样品装入坩锅中,以10 ℃/min的速率从30 ℃加热到600 ℃,在氮气流速为50 mL/min的条件下进行热重分析。称取样品约2 mg,用超纯水配制20%(w/w)的混合液,直接将悬浮液放入铝锅中进行分析。差示扫描量热法分析程序为在氮气下以5 ℃/min的速率从30 ℃加热到120 ℃。用软件TRIOS5.1计算起始温度(To)、峰值温度(Tp)和结束温度(Tc)以及糊化焓(ΔH)。
1.3 数据处理
实验数据为至少三次重复测量的平均值和标准偏差,采用IBM SPSS Statistics 23.0软件进行统计分析(P<0.05),采用Origin 9.5软件进行分析作图。
2 结果与分析
2.1 豇豆淀粉提取的单因素实验结果
图2 分别展示了各因素对豇豆淀粉提取率的影响。由图2A能够看出,NaOH溶液体积在200~1000 mL的范围内,豇豆淀粉的提取率随着NaOH溶液体积的增大呈现先上升后下降的趋势,在400 mL出现最大值,但与200、600 mL时没有显著差异,在800 mL之后出现了明显的下降趋势;由图2B能够看出,在8~24 h范围内,提取率随着时间的增加呈现先上升再下降的趋势,在16 h达到最大值。出现这一现象的原因,推测可能是因为随着溶液的增多与浸泡时间的延长,豇豆在浸泡过程中淀粉与蛋白质等复合结构逐渐解开,使淀粉更易提取,直到豇豆结构遭到较大破坏,使淀粉溶出流失等因素导致的[13]。因此,选取NaOH溶液的体积400 mL与浸泡时间16 h为最佳值进行响应面优化。
由图2C能够看出,在乙醇体积为40~120 mL范围内,提取率呈现上升后下降的趋势,在80 mL处达到最大值,之后出现小幅下降并波动;由图2D可以看出,在振荡时间20~100 min范围内,提取率的影响呈现上升后下降的趋势,在60 min左右达到最大值;由图2E可以看出,在振荡转速40~200 r/min范围内,提取率呈现先上升后逐渐保持平稳的趋势,在160 r/min附近达到最大值。出现这一结果的原因,推测可能是因为乙醇振荡过程中使淀粉中的蛋白质变性,蛋白质表层失去水化层相互聚集而沉淀,但当条件在一定程度时可能会导致蛋白聚沉时包裹一部分淀粉造成损失[4]。综合考虑提取率结果与经济性后,选取乙醇的体积80 mL、振荡时间60 min与振荡转速160 r/min为最佳值进行响应面优化。
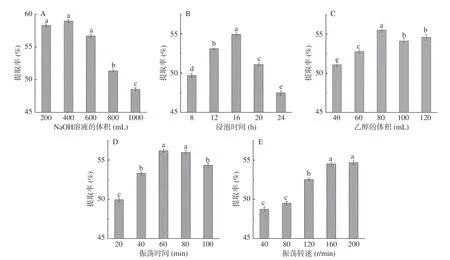
图2 各单因素对豇豆淀粉提取率的影响Fig.2 Effect of single factor on extraction rate of cowpea starch
2.2 豇豆淀粉提取的响应面优化结果
根据设计的Box-Behnken试验进行实验,结果如表2所示。采用Design-Expert软件对结果进行响应面分析,得到回归方程:
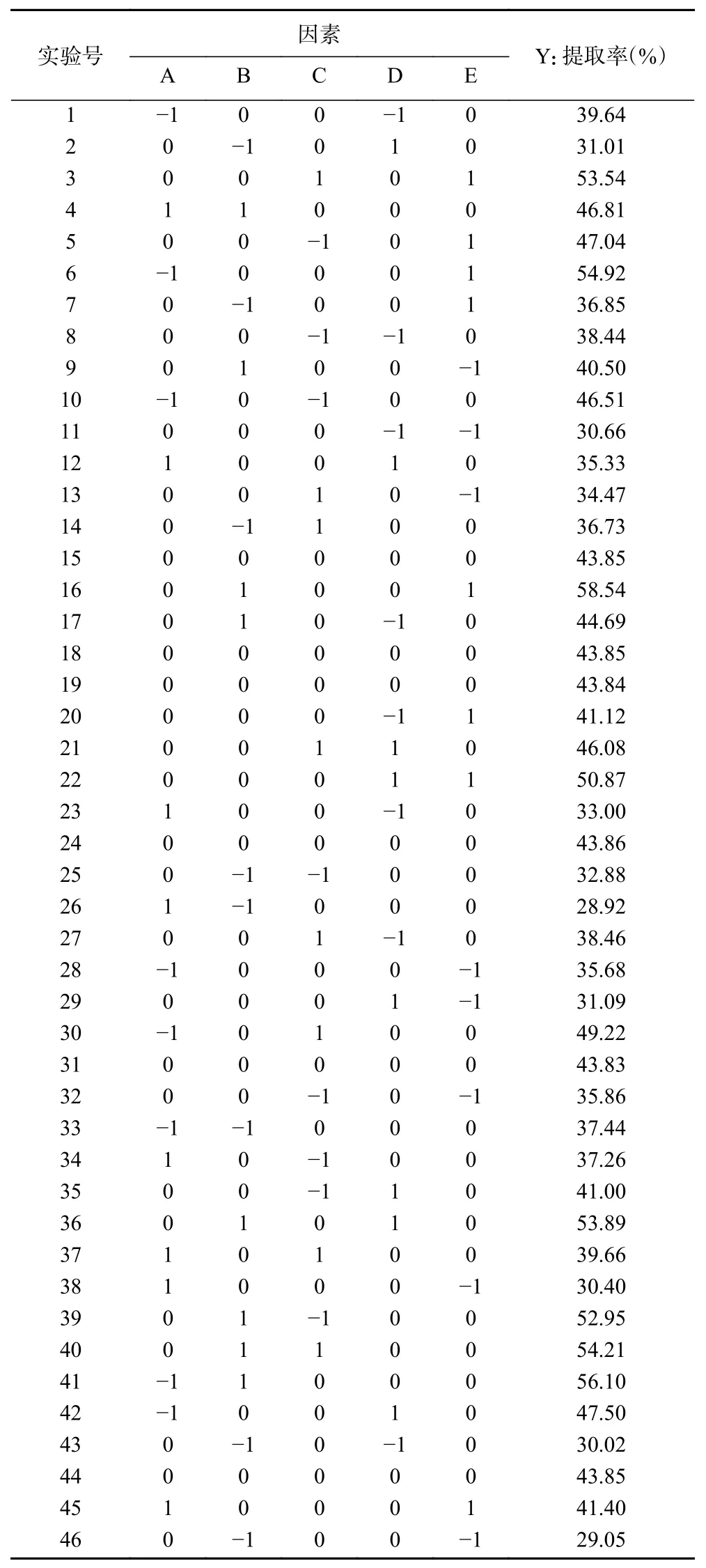
表2 Box-Behnken试验设计及结果Table 2 Design and results of Box-Behnken experiments
提取率(%)=43.85−4.64A+9.05B+1.28C+2.55D+7.29E−0.19AB−0.078AC−1.38AD−2.06AE−0.65BC+2.05BD+2.56BE+1.26CD+1.97CE+2.33DE−1.31A2−0.41B2+0.73C2−3.56D2−1.96E2
根据实验结果进行方差分析,如表3所示,此拟合模型中F值为473.241,P<0.0001,为极显著水平,决定系数R2为0.9929,调整后R2为0.9872,失拟项不显著,这说明该回归方程对试验拟合程度良好。对回归方程的显著性进行检验分析,表明在提取过程中,一次项NaOH溶液的体积A、浸泡时间B、乙醇的体积C、振荡转速D、振荡时间E,交互项AD、AE、BD、BE、CD、CE、DE,以及二次项A2、C2、D2、E2对响应值的影响极显著(P<0.001),BC、B2对响应值的影响显著(P<0.05),其它因素对响应值的影响不显著。这些结果表明此模型对豇豆淀粉提取的分析和预测是可靠的。
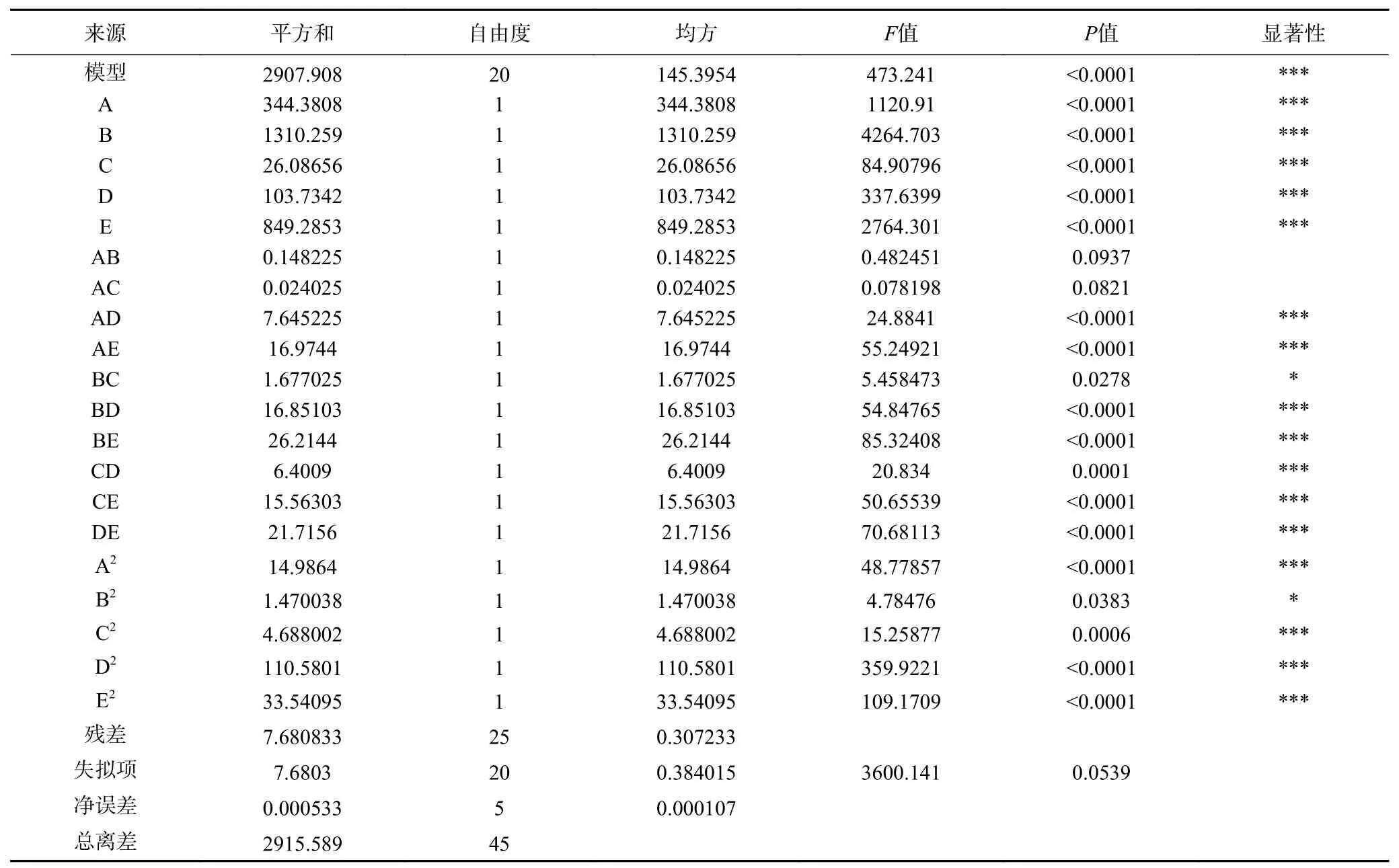
表3 响应面二次回归方程模型方差分析表Table 3 ANOVA for response surface quadratic model analysis of variance table
根据所拟合的回归方程,考察交互项对淀粉提取率的影响,经Design-Expert软件分析,根据模型求响应面的最大极值点,根据实验条件实际进行调整,最佳提取条件为:NaOH溶液的体积420 mL、浸泡时间17 h、乙醇的体积74 mL、振荡转速167 r/min、振荡时间70 min,此条件下最大提取率为62.13%。以模型预测最佳提取条件进行实验验证,得到提取率61.69%±0.07%,与预测值十分接近,表明该模型具有一定的实践价值,可行度较好。但值得注意的是,此方法得到的提取率并不突出,推测是因为豇豆中蛋白质、纤维素等含量较高,致使淀粉较难提取等因素导致,实验还有一定的改进空间,有待于进一步探索研究酶辅助等方法进一步提取纯化。
2.3 豇豆及豇豆淀粉的成分组成与性质
豇豆及豇豆淀粉的化学成分和直链淀粉含量如表4所示。淀粉的质量可以通过纯度来判断,而纯度又取决于灰分、脂肪、蛋白质含量等[14]。结果表明,豇豆淀粉的灰分及蛋白质等含量较低,总淀粉含量较高,表明所提取的豇豆淀粉质量合格,满足后续研究需求。从豆科植物中提取淀粉是困难的,因为水合纤维和淀粉同时存在于细胞壁中,而且植物蛋白含量很高,这可能是豇豆淀粉比其他植物淀粉含有更多杂质的原因[15]。本文所得豇豆淀粉的直链淀粉含量在18.72%~49.50%之间,平均值为37.52%,直链淀粉含量高于国内报道的其他品种,但与印度和尼日利亚的品种相似[16−17]。

表4 豇豆及豇豆淀粉的成分组成与性质Table 4 Composition and properties of cowpea and cowpea starch
豇豆淀粉相对较低的溶解度和溶胀度,证实了豇豆颗粒结构较强,相对结晶度较高,直链淀粉含量较高。对淀粉的糊化、回生、溶胀等功能和理化性质影响极大,应引起重视。
2.4 豇豆淀粉颗粒场发射扫描电子显微镜观察结果
豇豆淀粉的扫描电镜照片如图3所示。豇豆淀粉粒呈球形或椭球形,有少量不规则颗粒。豇豆淀粉表面光滑,没有裂纹或针孔,与其他豆类淀粉颗粒一样,有少量的团聚结构[18]。显微照片显示,一小部分豇豆淀粉颗粒表面有轻微损伤,考虑是提取方法的影响,其数量少,损伤相对较小,对后续研究结果不会有明显影响。在豇豆淀粉中观察到与Kaptso等[19]报道的相似的少量颗粒聚集,这可能是由于干燥方法导致颗粒表面的轻微糊化,或者可能归因于粗蛋白残留物的存在而导致颗粒形成聚集体。显微照片显示提取的淀粉中含有少量的蛋白质和纤维基质,这与化学分析结果一致,说明淀粉提取工艺是可行的。

图3 豇豆淀粉扫描电镜照片Fig.3 Scanning electron microscope photos of cowpea starch
淀粉的颗粒结构对其性质影响很大。根据来源的不同,豇豆淀粉呈现出椭圆形、肾形、不规则球形等多种结构。根据报道,豇豆淀粉颗粒通常被发现是光滑的,没有孔洞或裂缝[20]。这可能是豇豆淀粉具有优异的热稳定性和功能性的原因,也很可能是其具有较强抗消化能力的原因。因为豇豆淀粉颗粒结构坚固,没有裂缝,可以推测豇豆淀粉的糊化温度相对较高,膨胀力较低。
2.5 豇豆淀粉颗粒粒径分布
图4 描述了豇豆淀粉的粒径分布结果,总体呈现一个中等尺寸的颗粒尺寸分布[21]。豇豆淀粉呈现了一个近似于双峰的分布形态,主峰位于10.5 μm附近,在12.5 μm附近有一个较大的肩峰。据报道,豇豆淀粉的颗粒大小为1.89~48.60 μm,本文中样品符合文献报道的粒径分布[22]。然而,之前的研究大多报道了豇豆淀粉呈单峰粒度分布。在提取过程中的NaOH溶液浸泡过程,可能会使部分淀粉被浸出,导致一定的淀粉颗粒聚集,这可能是本文中豇豆淀粉样品呈近似双峰分布的原因,这一现象在之前的电镜照片中也有所体现。同时淀粉粒度分布的差异也受谷物来源、种植环境条件等多种因素的影响[23]。

图4 豇豆淀粉粒径分布图Fig.4 Particle size distribution of cowpea starch
2.6 豇豆淀粉的FTIR谱图分析
豇豆淀粉的FTIR图谱如图5所示,呈现典型的淀粉类多糖特征。淀粉在3330 cm−1左右的强吸收峰被认为归属于自由羟基的伸缩振动,约2930 cm−1处的吸收峰被认为是主要由亚甲基C-H伸缩贡献。在925 cm−1处的吸收峰被认为是C-O-C基团的α-1,4糖苷键和C-O的伸缩振动。它可以表征淀粉的亲水性,如溶解度和溶胀度。在这个波数,豇豆淀粉的吸收峰相对较弱,这可以表明豇豆淀粉相对较低的溶解度和溶胀度,本文的相关研究也证实了这一点。1635和1000 cm−1左右的吸收峰分别为C-O和C-O伸缩振动,1050 cm−1左右的吸收峰与淀粉的晶体结构有关。这些谱带上的较强峰可以证明豇豆淀粉具有较强的结晶结构[24−27]。

图5 豇豆淀粉FTIR谱图Fig.5 FTIR spectrum of cowpea starch
2.7 豇豆淀粉的结晶结构分析
X射线衍射图谱的研究为淀粉颗粒的有序结构提供了重要的参考。采用X射线衍射仪对豇豆淀粉颗粒进行了测定,并计算了淀粉颗粒的相对结晶度,结果如图6与表5所示。豇豆淀粉的衍射图在15°、17°、18°和23°处有较强的峰,在5.6°和20°处有微弱但可分辨的峰,表明豇豆淀粉具有典型的C型晶体结构[21]。根据所得谱图计算,豇豆淀粉样品的相对结晶度为31.57%±0.23%,与Oyeyinka等[5]观察到的10.57%~32.70%的范围一致。较高的结晶度与前期FTIR的研究结果相印证。

图6 豇豆淀粉XRD谱图Fig.6 XRD spectrum of cowpea starch
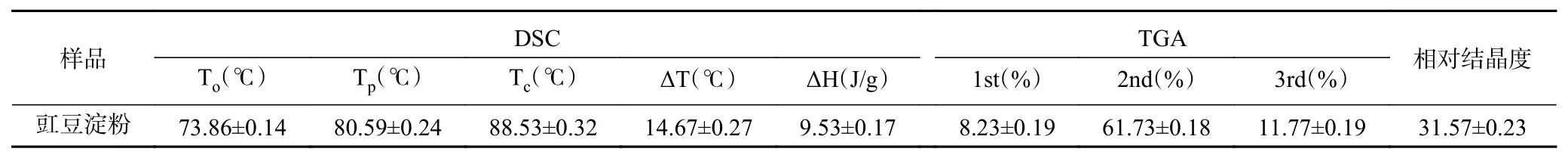
表5 豇豆淀粉热力学性质表Table 5 Thermodynamic properties of cowpea starch
一般来说,淀粉有三种类型的多晶型(A、B和C),这取决于淀粉的来源和淀粉晶体片层的排列[28]。A型和B型的不同之处在于水化程度和支链中双螺旋的堆积排列。据报道,与具有更多水合核心的B型多晶型相比,A型多晶型的水化程度较低。豆类淀粉以C型为主,被认为是A型和B型的混合体。C型通常被分为三种类型:CA型、CB型和CC型(典型的C型),分类取决于图谱性质更类似于A型或B型。C型明显更为复杂,其理化和功能性质在很大程度上取决于A型和B型的比例。一般来说,C型结晶度的淀粉更耐消化,热力学性质稳定[29]。
根据报道,大多数豇豆淀粉是C型淀粉,特别是CC型淀粉,然而,一些作者发现,A型结晶淀粉也存在于豇豆中。Ratnaningsih等[8]将豇豆淀粉归类为CA型,因为它更接近A型结晶,这表明其中A型淀粉比B型淀粉含量占优势。然而,本文中豇豆淀粉样品几乎没有明显的趋向,而是具有典型的C型结构(CC型)。淀粉结晶型的差异可能受来源作物基因型、生长条件、生长位置等因素影响。
淀粉的相对结晶度受到支链淀粉链的含量和长度、结晶区中双螺旋的取向以及双螺旋之间的相互作用程度等因素影响。这在一定程度上表明,直链淀粉含量越高,淀粉的相对结晶度越低,无定形区域所占比例越大,即淀粉中的结晶结构主要由支链淀粉贡献。然而本文中豇豆淀粉样品具有较高的直链淀粉含量的同时,也具有较高的相对结晶度。这可能是因为直链淀粉可以位于支链淀粉分子之间,支链淀粉分子在支链淀粉分子的结晶区具有很高的有序度。在其他类型的淀粉中也发现了这种现象,如蜡质淀粉和木薯淀粉[30−31]。
2.8 豇豆淀粉的热力学性质的测定
豇豆淀粉样品的热重分析(TGA)和差示扫描量热分析(DSC)的结果如表5所示。TGA结果显示了典型的淀粉类多糖的三段失重特征。第一阶段失重峰在45~80 ℃左右,被普遍认为是淀粉结合水的损失[32],第二阶段失重峰在300~340 ℃左右,被认为是碳链分解的结果[33]。DSC结果表明,淀粉样品出现一个吸热峰,这代表着淀粉的糊化过程[34]。其起始糊化温度(To)为(73.86±0.14)℃,峰值温度(Tp)为(80.59±0.24)℃,结束温度(Tc)为(88.53±0.32)℃。淀粉的糊化焓(ΔH)被认为是支链淀粉晶体熔融的标志,豇豆的淀粉糊化温度范围(ΔT)也较宽,这可能与其较高的相对结晶度有关,这些结果与早先报道的豇豆淀粉的热性质一致,也与前期研究中电镜、XRD等结果一致。
淀粉的糊化温度受许多参数的影响,如直链淀粉含量、相对结晶度、淀粉结构等。较高的糊化温度、较宽的糊化范围和较大的糊化焓表明豇豆淀粉具有较好的抗糊化性能,这可能是由于淀粉颗粒中的晶体结构完整而牢固,支链淀粉与直链淀粉链之间的结合力较强,其相对结晶度较高等[35]。豇豆淀粉拥有较为优秀的抗糊化性质,这表明豇豆淀粉在食品工业中具有广阔的应用前景。
3 结论
本研究采用湿磨法工艺,在单因素实验的基础上,采用五因素三水平的响应面曲面分析法确定长豇豆淀粉提取工艺的的最佳参数,并对长豇豆淀粉的精细结构与物化性质进行了一定的研究。实验结果得到豇豆淀粉最佳提取工艺:NaOH溶液420 mL、浸泡时间17 h、乙醇体积74 mL、振荡转速167 r/min、振荡时间70 min,此条件下理论提取率为62.13%,实际提取率为61.69%±0.07%。
提取的豇豆淀粉灰分含量为0.17%,蛋白质含量0.87%,脂质含量0.25%,纤维素1.59%,溶解度0.73%,溶胀度1.85 g/g;扫描电镜图像表明,豇豆淀粉颗粒呈球型或椭球形,粒径大多分布在9~13 μm范围内;傅里叶变换红外光谱与X射线衍射分析分析表明,豇豆淀粉具有较强的结晶结构,具有较高的相对结晶度,呈现典型C型结晶淀粉形态;热力学分析表明,起始糊化温度(To)为73.86 ℃,峰值温度(Tp)为80.59 ℃,结束温度(Tc)为88.53 ℃,豇豆淀粉具有较强的抗糊化性质。
实验结果表明,豇豆淀粉具有紧密的结构与独特的热力学性质。较高的糊化温度与较低的溶胀度以及较高的直链淀粉含量表明豇豆淀粉在食品改良剂等领域中有着良好的发展潜力。本实验结果为豇豆淀粉的进一步分离纯化和形态结构与物化性质的分析提供了参考,为豇豆淀粉作为特定领域食品专用产品加工及其他相关领域的产品开发与应用等提供理论指导与数据支撑。
