银耳芽孢多糖发酵培养基配方、发酵条件的优化及其放大发酵试验
2021-10-24林俊芳郭丽琼叶志伟郑倩望
唐 睿,林俊芳,郭丽琼,叶志伟,郑倩望,
(1.华南农业大学,广东广州 510640;2.广东省微生态制剂工程技术研究中心,广东广州 510642)
银耳(Tremella fuciformisBerk),又称雪耳、白木耳,属二态型真菌,营养体具有芽孢(酵母相)和菌丝(丝状体相)两种细胞型态,银耳芽孢可以通过菌丝胶质化而成的银耳子实体组织分离后获得的节孢子反复芽植而得[1]。银耳多糖是银耳的主要活性成分,银耳芽孢多糖与银耳子实体多糖都是银耳多糖的重要来源[2],研究表明两种多糖具有相似的单糖组成,主要成分为木糖、甘露糖、葡萄糖,通过(1→3)-D-甘露糖骨架连接[3−7]。同时银耳芽孢多糖与银耳子实体多糖具有如抗肿瘤[8−9]、抗氧化活性[10−11]、降血糖血脂[12−13]等相似的生物活性[14−15],可以广泛应用在医药、食品等领域,具有巨大的市场价值[16]。
目前银耳多糖一般是从银耳子实体中提取,但银耳子实体的栽培占地广、周期长、受气候季节地区性影响[17],且其提取过程耗能大、得率低[5,18−19],因此银耳子实体并非银耳多糖的合适来源途径。银耳芽孢可以进行液态深层发酵,能够在较短的时间内迅速富集胞外多糖(Extracellular polysaccharides,EPS)[20],符合工业化发展趋势,通过提高银耳芽孢发酵多糖的效率能够有效促进银耳多糖相关产品的开发。目前银耳芽孢多糖摇瓶液态发酵已有研究,阮玲云等[21]发现低氮高盐且pH5时有助于胞外多糖的分泌,Ma等[22]则通过响应面法优化了银耳芽孢发酵多糖马铃薯培养基的添加量;但是总体来说银耳芽孢多糖的摇瓶液态发酵体系仍未完善,所得培养基仍有如马铃薯淀粉等对银耳芽孢多糖提取纯度和最终产量造成干扰的因素存在。除此之外,银耳芽孢多糖的放大发酵多集中在5 L发酵罐规模上[23−24],缺乏更大规模的放大发酵工艺参数研究。
本研究采用单因素法探索不同来源的碳氮源及营养元素对银耳多糖产量的影响,并结合Plackett-Burman和Box-Behnken响应面设计,得到高产EPS的发酵培养基配方和发酵条件,进一步使用50 L发酵罐进行发酵工艺的验证,旨在为银耳芽孢多糖液态发酵培养基所需的营养元素进行筛选以及为其工业化生产提供理论支持。
1 材料与方法
1.1 材料与仪器
银耳芽孢菌株Y2菌种 保藏在华南农业大学微生态制剂工程技术研究中心,提取Y2菌株的基因组进行ITS鉴定,结果显示Y2菌株与Tremellasp.相似度达99%以上,可以确定本次使用的Y2菌株为银耳芽孢菌种;PDA培养基:马铃薯200 g、葡萄糖20 g、KH2PO43 g、MgSO4·7H2O 1.5 g、琼脂粉20 g、蒸馏水1000 mL,115 ℃灭菌30 min后备用;种子培养基:葡萄糖20 g、蛋白胨4 g、K2HPO41 g、KH2PO40.46 g,MgSO4·7H2O 0.5 g,蒸馏水1000 mL,115 ℃灭菌30 min后备用;基础发酵培养基:葡萄糖20 g、蛋白胨4 g、K2HPO41.5 g、MgSO4·7H2O 0.5 g、蒸馏水1000 mL、115 ℃灭菌30 min后备用;发酵条件优化培养基:葡萄糖20 g、酵母浸膏2 g、玉米浆干粉2 g、KH2PO41.5 g、MgSO4·7H2O 0.5 g、蒸馏水1000 mL,115 ℃灭菌30 min后备用;甘露醇分析纯,上海源叶生物科技有限公司;酵母浸膏 分析纯,广东环凯微生物氪金有限公司;蛋白胨 分析纯,北京奥博星生物科技有限公司;葡萄糖、蔗糖、KH2PO4、NaCl、浓硫酸 分析纯,广州化学试剂厂;无水乙醇 分析纯,天津富宇精细化有限公司;重蒸试剂 分析纯,Solarbio公司。
5804R高速冷冻离心机 德国Eppendorf公司;RV8旋转蒸发仪 德国IKA公司;UV2310Ⅱ双光束紫外分光光度计 杭州奥盛;真空冷冻干燥机北京博医康;高压蒸汽灭菌锅 江阴滨江医疗设备。
1.2 实验方法
1.2.1 菌株的活化与种子液培养 菌株活化:在无菌环境下用平板划线法将冷冻管保藏的Y2菌液接种在PDA平板培养基上,于25 ℃恒温箱中培养3 d。
种子液制备:取出恒温箱中的平板培养基,在无菌环境下挑出单菌落,加入到预先备好的种子培养基中,放入25 ℃、150 r/min摇床中培养4 d,而后置于4 ℃冰箱备用。
1.2.2 指标测定 Y2 EPS的收集:收集发酵完毕的摇瓶里所有菌液,8000 r/min离心20 min后,收集上清,通过旋蒸仪浓缩到适当体积后用3倍体积的95%乙醇沉淀过夜,收集沉淀,复溶冷冻干燥后即为粗EPS。
标准葡萄糖曲线的绘制:精密称取无水葡萄糖0.10 g,用超纯水定容至1000 mL后准确吸取0、0.2、0.4、0.6、0.8、1 mL至具塞试管中,分别用超纯水补足至1 mL,混匀;往试管中加入1 mL 5%苯酚和5 mL浓硫酸,涡旋振荡5 s,40 ℃水浴30 min后取出冷却至室温,在OD490处测量吸光度。以吸光度为横坐标,葡萄糖含量为纵坐标,制得葡萄糖标准曲线回归方程为:y=0.1071x+0.0011,R2=0.9996。
银耳芽孢多糖产量测定:称取从发酵液(V1)中提取出的全部粗多糖样品冻干后的干重(M),从中选取适当重量的粗多糖样品(m)用超纯水定容至一定体积(V2),得到合适浓度的多糖溶液。移取适当体积的定容后的多糖溶液至具塞试管中(v),并用超纯水补足至1 mL,往试管中加入1 mL 5%苯酚和5 mL浓硫酸,涡旋振荡5 s,40 ℃水浴30 min后取出冷却至室温,在OD490处测量吸光度。多糖产量按下式计算:

式中:Y表示发酵液(V1=100 mL)中EPS的产量,mg/100 mL;V1表示用于提取多糖的发酵液体积,mL;V2表示样品定容体积,mL;M表示所得粗EPS的干重,mg;y表示根据吸光值从标准曲线上求得的测定液中含糖量,mg;v表示移取样品测定液的体积,mL;m表示定容时溶解粗EPS的质量,mg;0.9表示葡萄糖换算成葡聚糖的校正系数[25]。
1.2.3 发酵培养基配方优化 初始发酵培养基的配方为:葡萄糖20 g,酵母浸膏4 g,K2HPO41.5 g,MgSO4·7H2O 0.5 g,加入纯水搅拌溶解,定容至1000 mL;初始发酵条件为:装液量100 mL/250 mL、接种量为1%(v/v)、自然pH、25 ℃、150 r/min摇床、发酵时间6 d。
1.2.3.1 发酵培养基氮源筛选 单一氮源筛选:在供试基础发酵培养基的基础上进行总添加量为0.4%的不同氮源替换(NaNO3、NH4Cl、豆粕提取粉、黄豆饼粉、玉米浆干分、酵母浸膏、酵母提提取粉、胰蛋白胨、蛋白胨),保持其他成分不变,6 d后测量EPS的产量。
复合氮源筛选:在供试基础发酵培养基的基础上,两种氮源以1:1的比例,总添加量为0.4%进行复合氮源的搭配替换,其他成分保持不变,发酵完成后测量EPS的产量。以最优复合氮源为研究对象,进行复合氮源比例(0.75:1.25、1:1、1.25:0.75)以及总添加量(0.3%、0.4%、0.5%、0.6%(w/v))的筛选,6 d后测量EPS的产量。
1.2.3.2 发酵培养基碳源筛选 以上述筛选后的氮源培养基为基础,进行总添加量为2%的不同碳源的替换(葡萄糖、果糖、乳糖、蔗糖、山梨糖醇、甘露醇),保持其他成分和发酵条件不变,发酵完成后测量EPS的产量。以最优碳源为研究对象,进行碳源添加量(0.5%、1%、2%、3%、4%(w/v))的筛选,发酵完成后测量EPS产量。
1.2.3.3 发酵培养基无机盐筛选 以上述筛选后的培养基为基础,无机盐分别替换为无无机盐组、只添加磷酸氢二钾(0.10%)组、磷酸二氢钾(0.10%)组、硫酸镁(0.05%)组、氯化钠(0.05%)组。发酵完成后测量EPS产量,选取明显促进EPS产量的盐离子进行添加量的优化,其中磷酸盐的优化范围为0.05%、0.10%、0.15%;其余无机盐优化范围为0.025%、0.05%、0.075%。
1.2.3.4 Plackett-Burman设计 在工艺优化中,采用Plackett-Burman设计能用较少的实验次数在众多的因素中快速筛选出对目的指标影响最显著的因素,对节约实验材料和缩短试验时间有着重要的作用[26]。依据实验结果,选取复合氮源(X1)、葡萄糖(X2)、磷酸二氢钾(X3)、硫酸镁(X4)、氯化钠(X5)5个因素,用Design-Expert软件进行Plackett-Burman设计,筛选出对Y2发酵ESP影响较显著的3个因素,PB试验因素与水平见表1。

表1 PB试验设计因素水平Table 1 Plackett-Burman experimental design factor level
1.2.3.5 Box-Behnken设计 根据PB试验结果选择对多糖产量影响最显著的3个因素,以EPS产量为响应值,用Design-Expert进行Box-Behnken设计3因素3水平响应面试验。响应面设计因素与水平见表2:
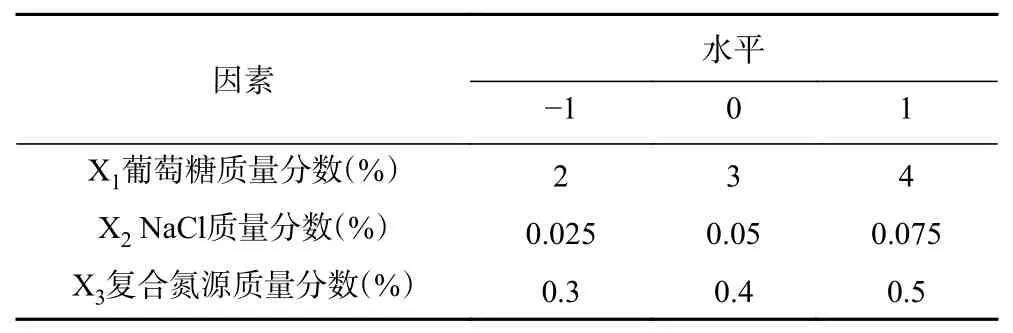
表2 Box-Behnken试验设计因素与水平Table 2 Factors and levels of Box-Behnken design
1.2.4 发酵条件优化 发酵条件优化培养基的配方为:葡萄糖20 g,玉米浆干粉2 g,酵母浸膏4 g,KH2PO41.5 g,MgSO4·7H2O 0.5 g,加入纯水搅拌溶解,定容至1000 mL;初始发酵条件为:装液量100 mL/250 mL、接种量为1%(v/v)、自然pH、25 ℃、150 r/min摇床、发酵时间6 d。
在上述发酵条件优化培养基及发酵条件为前提,进行发酵时间(4、5、6、7、8 d);发酵温度(21、23、25、27、30 ℃);初始发酵pH(4、5、6、7、8);接种量(0.5%、1%、2%、3%、4%(v/v));摇床转速(100、125、150、175、200 r/min)的优化,发酵后测定ESP产量。
1.2.5 发酵罐放大模拟发酵验证 为更好的将上述发酵工艺优化结果应用于实际生产,以最佳培养基配方及条件进行50 L的发酵罐发酵。发酵罐参数为:装料量30 L,接种量为3%(v/v),转速100 r/min,初始pH5.5,初始通气量为800 L/h,12 h后提高至2500 L/h,60 h后恢复到1000 L/h,培养温度27 ℃,从发酵罐中每12 h取50 mL样至无菌离心管中,分别测定菌体干重及EPS产量。
1.3 数据处理
本研究涉及的数据均设计三次平行,用SPSS 22.0软件对数据进行ANOVA同时加入Duncan多重比较进行显著性分析,用Origin 9.5软件进行绘图,用Design-Expert 10.0进行Plackett-Burman试验与Box-Behnken试验设计的数据处理。
2 结果与分析
2.1 发酵培养基氮源筛选
氮源对微生物的生长至关重要,而不同的微生物有自身的氮源需求,从图1得知,在单一氮源添加时Y2利用不同氮源产EPS的能力差异较大,对于无机氮源以及部分蛋白类氮源利用率不高,其中酵母浸膏和玉米浆干粉对Y2产EPS有较好的提升。

图1 单一氮源种类对Y2产EPS的影响Fig.1 Effect of the type of single nitrogen source on Y2 EPS production
在一些微生物深层发酵的过程中,复合氮源提供了更多元的营养物质,对促进微生物的生长和活性物质的分泌效果优于单一氮源[27]。由图2可知酵母浸膏与其他氮源组合后能有效促进银耳芽孢EPS的分泌,这可能是由于在不同氮源下Y2固碳效率或碳平衡控制有差异[28],有酵母浸膏存在的复合氮源不仅能为培养基提供了更多元的氮源成分,还能进一步刺激Y2分泌胞外多糖。在所有复合氮源的组合中,酵母浸膏与玉米浆干粉组合时孢子干重和EPS产量是最优的,同时农副氮源玉米浆干粉的选择也能降低培养基成本,因此选取此组合为最佳氮源。

图2 复合氮源种类对Y2产EPS的影响Fig.2 Effect of the type of compound nitrogen source on Y2 EPS production
根据表3筛选结果可知在两种氮源以1:1的比例添加时EPS的产量更优,由此选择这个比例的复合氮源进行添加量的筛选,结果如图3所示,在氮源添加量为0.4%(w/v)的时候EPS产量最高,故选择添加量为0.4%(w/v)。

表3 复合氮源比例对Y2产EPS的影响Table 3 Effect of compound nitrogen source ratio on Y2 production of EPS

图3 复合氮源添加量对Y2产EPS的影响Fig.3 Effect of compound nitrogen source addition on Y2 production of EPS
2.2 发酵培养基碳源筛选
碳源是构成细胞物质的基本元素和提供其生长发育所需要的基本能量,合适的碳源对微生物液体深层发酵合成多糖有明显影响[29]。由图4A可知,与不添加碳源试验组比较,供试碳源除了乳糖外均能显著(P<0.05) 促进Y2菌体的生长和EPS的分泌,其中当碳源为葡萄糖的时候多糖产量最高,同样为单糖的果糖次之。可以表明银耳芽孢能利用单糖和糖醇以及部分二糖来生产EPS,但单糖对Y2产EPS的诱导效果更好。
从图4B可以看出培养基中葡萄糖浓度对Y2分泌EPS有较明显的影响,碳源浓度过低时不足以提供细胞生长所需营养,EPS的分泌受限;而高浓度的碳源,又会引发碳源阻遏效应降低EPS的合成[30]。在添加量为3%(w/v)的时候EPS产量最高,因此葡萄糖的最佳添加量为3%(w/v)。

图4 碳源种类(A)及碳源添加量(B)对Y2产EPS的影响Fig.4 Effect of type(A)and addition(B)of carbon sources on Y2 Production of EPS
2.3 发酵培养基无机盐筛选
从图5中可知,玉米浆干粉作为农副氮源,其内含有一定的矿质元素,所以在不添加无机盐的培养基中依然有EPS的分泌,但磷酸二氢钾、硫酸镁和氯化钠的添加能进一步促进Y2产EPS,而磷酸氢二钾的添加会减少EPS的产量。

图5 无机盐对Y2产EPS的影响Fig.5 Effect of inorganic salt on Y2 Production of EPS
选取了能提高EPS产量的三种无机盐加入培养基中替换原有无机盐成分,从表4可知,添加了氯化钠后Y2的EPS产量为173.87 mg/100 mL左右,比未添加氯化钠的培养基产量高了1.19倍。有研究表明,Na+是银耳芽孢生长所必要的元素[31],除此之外NaCl还具有诱导胞外多糖的分泌的能力[32],说明氯化钠也是银耳芽孢分泌EPS的关键有效成分,而此前银耳芽孢发酵多糖的培养基的报道中均无此成分。磷酸二氢钾、硫酸镁、氯化钠的最优添加量分别为0.1%、0.05%、0.05%。

表4 无机盐添加量对Y2产EPS的影响Table 4 Effect of addition of Inorganic salt on Y2 production of EPS
2.4 Plackett-Burman试验结果
利用Design-Expert10.0.4软件对表5数据进行处理,结果如表6所见。模型F值为78.15,表明该设计模型具有重要意义,R2=0.9949表明存在99.49%的数据能用此模型解释。葡萄糖对EPS的合成影响极显著(P<0.01),NaCl、复合氮源对EPS合成影响显著(P<0.05),KH2PO4和MgSO4对EPS合成影响不显著。因此,选择葡萄糖、NaCl以及复合氮源这3个因素及其对应的取值水平进行响应面试验。

表5 Plackett-Burman试验设计矩阵与结果Table 5 Plackett-Burman design matrix and results
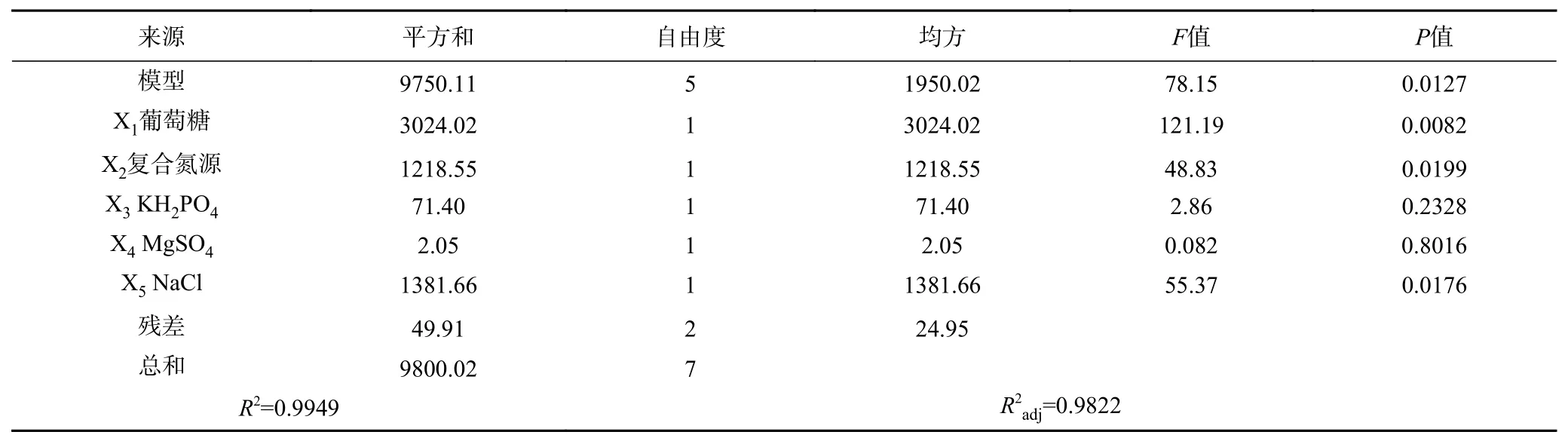
表6 Plackett-Burman试验回归方程方差分析Table 6 Analysis of variance of Plackett-Burman test regression equation
2.5 Box-Behnken试验结果
对葡萄糖(X1)、NaCl(X2)、复合氮源(X3)3个单因素进行回归拟合,响应面结果见表7,得出EPS产量(Y)回归方程:Y=191.00+17.69X1+2.85X2−6.0X3−3.45X1X2−8.53X1X3−13.39X2X3−18.77X12−8.19X22−18.55X32。

表7 Box-Behnken试验设计矩阵与结果Table 7 Box-Behnken experimental design matrix and results
利用Design-Expert10.0.4软件对回归方程进行方差分析,结果见表8。模型“Prob>F”值为0.0003,表明该模型具有统计学上的显著性,同时失拟项检验P>0.05,模型决定系数R2=0.9634,说明实际数值能与模型预测吻合。回归方程各项方差分析表明,因素X1对EPS产量的线性效应影响极显著,X12对EPS产量的曲面效应影响也极显著,表明葡萄糖添加量是Y2产EPS的关键因素,另外X2X3对EPS产量影响也极显著,表明复合氮源和氯化钠添加量的交互作用对EPS产量也极显著影响。此外,对表8进行分析可得到交互影响作用大小排序为:NaCl和复合氮源>葡萄糖和复合氮源>葡萄糖和NaCl。三因素对多糖含量的影响大小依次是:葡萄糖>复合氮源>NaCl。
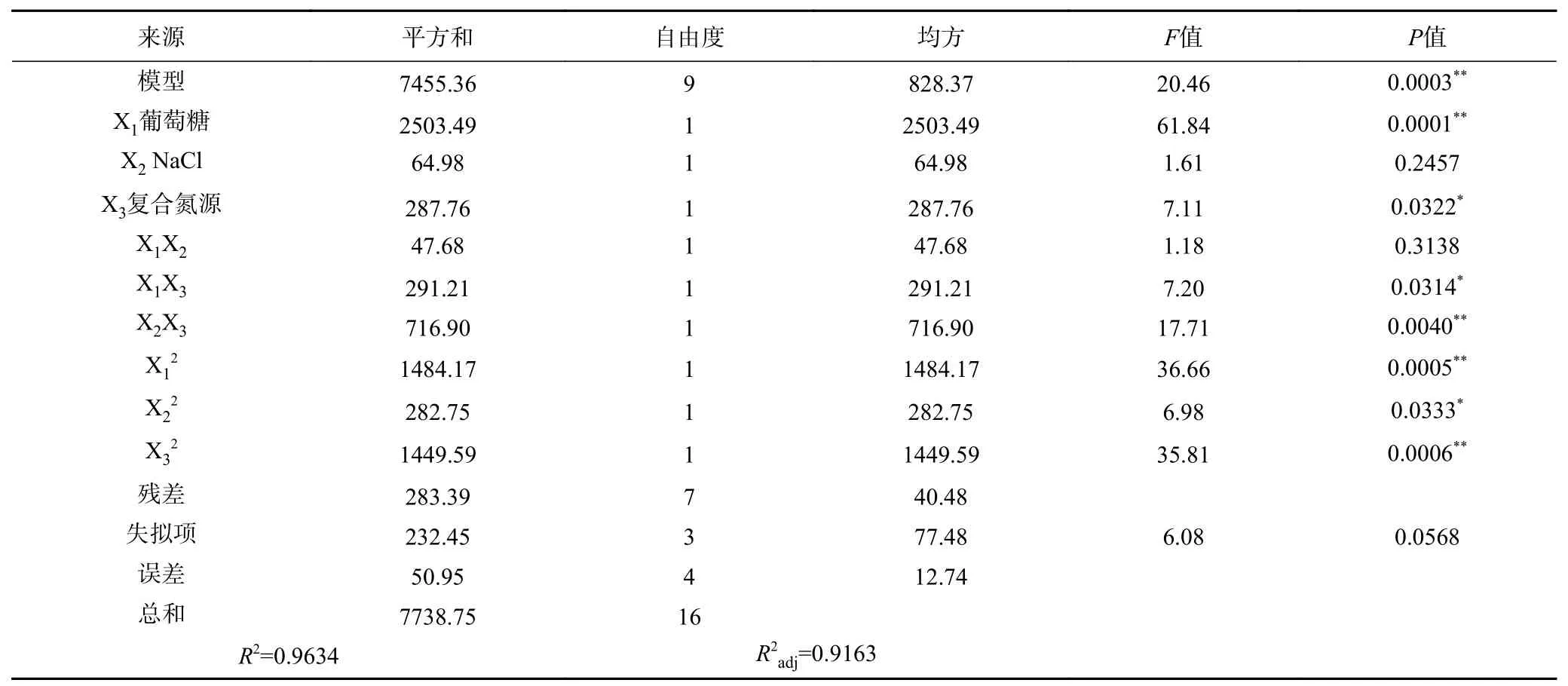
表8 回归模型方差分析Table 8 Analysis of variance in regression model
固定其中一个因素,利用Design-Expert对另外两个因素的交互作用作曲面图和等高线图,如图6所示。可知葡萄糖浓度、NaCl浓度以及复合氮源浓度相互作用时对Y2的EPS产量影响均为凸面抛物线型关系,所得的响应面都存在极大值点。
从图6A中可以看出,X1和X2的交互作用等高线近似圆形,说明两者之间的交互作用比较弱。从响应曲面上看,当葡萄糖浓度维持不变时,EPS产量随NaCl浓度的变化不显著,当NaCl的浓度维持不变时,EPS产量随着葡萄糖浓度的升高而显著增大,且葡萄糖浓度在3%~4%之间时EPS产量最大,说明葡萄糖浓度对EPS产量的影响比NaCl浓度更显著。
从图6B中可以看出,X1和X3的交互作用等高线近似椭圆形,说明两者之间的的交互作用较强。从响应曲面上看,当葡萄糖浓度维持不变时,EPS产量随复合氮源浓度的变化不显著,当复合氮源的浓度维持不变时,EPS产量随着葡萄糖浓度的升高而增大,说明葡萄糖浓度对EPS产量的影响比复合氮源的浓度更显著。

图6 各因素交互作用对EPS产量影响的响应面图Fig.6 Response surface plots showing the interactive effects of various factors on EPS production
从图6C中可以看出,X2和X3的交互作用等高线近似椭圆形,等高线较为扁平,说明两者之间的的交互作用较强,即复合氮源与NaCl的浓度间有明显的交互作用。从响应曲面上看,当NaCl浓度一定时,EPS产量随复合氮源浓度的增加呈现先上升后下降的趋势;而当复合氮源浓度一定时,EPS产量随NaCl浓度的增加而缓慢增长,直至达到最大值后逐渐减小,且响应曲面上X3面的陡峭程度要大于X2面,因此说明复合氮源浓度对EPS产量的影响比NaCl的浓度更显著。综上所述,3个因素对EPS产量的影响显著性顺序为:葡萄糖浓度>复合氮源浓度>NaCl浓度,与方差分析结果一致。
对回归模型进行优化分析,获得银耳芽孢Y2产EPS最佳培养基配方为葡萄糖添加量35.32 g/L、NaCl添加量0.60 g/L、复合氮源添加量3.57 g/L,在此优化条件下得出的EPS产量理论预测值为198 mg/100 mL。结合实际情况,最终选取葡萄糖添加量35 g/L、NaCl添加量0.6 g/L、复合氮源添加量3.6 g/L来对此优化条件进行验证,通过3次验证实验,最终EPS的平均产量为201.61 mg/100 mL,与预期结果相当,说明此回归模型能够良好地对银耳芽孢高效发酵培养基产胞外多糖进行预测。
2.6 发酵条件筛选
在发酵过程中,温度主要通过影响细胞膜的流动性和生物大分子的活性,进而影响微生物生命活动及产物代谢[30]。从图7A可知,随着发酵温度的升高EPS产量也有所上升,27 ℃的发酵温度适合Y2产EPS,过高的温度不利于EPS的分泌。因此选取最适发酵温度为27 ℃。
发酵液起始pH的变化会直接影响食用菌菌丝体细胞内pH的变化,进而影响到细胞内酶的活性以及菌株对培养基基质的利用速率,因此过酸和过碱的培养及环境对EPS的生产有所抑制[33]。从图7B中可知,pH为5时的初始发酵pH下Y2 EPS产量最高。故而选取pH5为最适起始发酵pH。
从图7C中可知,发酵时间较短时,EPS产量不高,因为在发酵前期,培养基中的营养物质大多用于菌种自身的繁殖生长,代谢产物分泌较少,而随着发酵时间的延长,Y2生长开始减缓,EPS开始累积,在第6 d的时候达到EPS产量的最大,而后随着培养基营养物质的消耗以及有毒物质的积累,EPS产量开始下降。因此选择最适发酵时间为6 d。
从图7D中可知,当接种量在3%(v/v)时,Y2产EPS达到最优,可能是由于较少的接种量会推迟Y2大量分泌代谢产物的时期,减缓Y2对培养基基质的利用效率;而过高的接种量会导致菌株生长过快,培养基黏度升高,溶氧量下降,导致EPS分泌下降。因此选择最佳接种量为3%(v/v)。
从图7E可见,150 r/min左右的转速下Y2产EPS没有明显差异,150 r/min的转速要比其他转速稍微高一点,而过高或过低的摇床转速都不利于Y2产胞外多糖,可能是由于转速低时,培养基溶氧量低,芽孢生长缓慢;当转速增加,高剪切速率不适宜芽孢发酵分泌多糖。因此选择最佳摇床转速为150 r/min。

图7 发酵条件对Y2产EPS影响Fig.7 Effect of Fermentation conditions on Y2 Production of EPS
综上结果,最终确定银耳芽孢多糖发酵条件为:培养时间6 d,初始pH5,发酵温度27 ℃,接种量3%,摇床转速为150 r/min。采用此最优发酵条件以及最优发酵培养基配方进行发酵,测得EPS产量为214.45±11.26 mg/100 mL,在摇瓶发酵阶段达到了较高的产量水平。
2.7 发酵罐扩大模拟发酵验证
应用最佳发酵培养基配方,在50 L搅拌式发酵罐中进行扩大分批发酵,从图8中可见在发酵罐中Y2生长迅速,在72 h后达到了生长的稳定期;此时EPS也开始加速积累,在132 h达到最高,之后EPS的产量开始下降。此刻Y2的孢子产量为15.03 g/L、EPS的产量为258.78 mg/100 mL,EPS的产量比摇瓶实验产量提高了21.03%,说明此发酵工艺成功在50 L发酵罐中进行了扩大发酵。

图8 50 L发酵罐中孢子及多糖产量的变化曲线Fig.8 Variation curve of spores and ESP yield in 50 L fermentation tank
3 结论
本研究采用单因素实验,发现酵母浸膏和玉米浆干粉1:1的复合氮源组合以及氯化钠组分能有效提高银耳芽孢胞外多糖产量。随后结合Plackett-Burman和Box-Behnken响应面设计优化了培养基各组分的最适添加量,开发了高产银耳芽孢胞外多糖的发酵培养基,其配方为:葡萄糖35 g/L,NaCl 0.6 g/L,复合氮源3.6 g/L,MgSO40.5 g/L,KH2PO41 g/L。同时,最适发酵条件为:27 ℃,pH5,发酵时间6 d、接种量3%(v/v)、摇床转速150 r/min。优化后银耳芽孢胞外多糖的产量为214.45 mg/100 mL。应用优化后的发酵培养基成分在50 L发酵罐扩大发酵中验证多糖得率为258.78 mg/100 mL,比摇瓶实验得率提高了21.03%。本次实验探索了不同营养物质对银耳芽孢发酵EPS的影响,得到了高效发酵EPS的银耳芽孢发酵培养基添加配方及发酵条件,同时中试放大发酵试验也为银耳芽孢多糖的大规模工业生产提供了工艺参数参考和理论支持。
