抗幽门螺旋杆菌乳酸菌的筛选与益生特性评价
2021-10-24梁竟一胡子毅王伟军刘建新任大喜
梁竟一,胡子毅,王伟军,陈 波,刘建新,任大喜,
(1.浙江大学动物科学学院奶业科学研究所,浙江杭州 310058;2.浙江一鸣食品股份有限公司,浙江温州 325000)
幽门螺旋杆菌(Helicobacter pylori,HP)可定植在人的胃部,长期感染还会引起慢性胃炎、胃溃疡、十二指肠溃疡甚至是胃癌[1]。幽门螺旋杆菌传染性高,并能在人体中长期存活[2]。目前,市面上还没有预防幽门螺旋杆菌感染的疫苗,临床上治疗幽门螺旋杆菌感染的方法主要有标准三联法和标准四联法两种[3],但使用抗生素可能会增加幽门螺旋杆菌耐药性并引起胃肠道菌群失调等药物反应。
研究表明,使用益生菌辅助三联/四联法能显著提高三联/四联法对幽门螺旋杆菌的根除率[4],服用乳酸菌及其相关制品可以减少胃内幽门螺旋杆菌的数量,缓解胃部炎症和损伤,提高幽门螺旋杆菌的根除率[5−6]。部分益生菌可通过产细菌素、有机酸及竞争粘附等抑制幽门螺旋杆菌的生长。Shiro等[7]分离到一株副干酪乳杆菌06TCa19产生大量的乳酸抑制幽门螺旋杆菌的生长,并可以显著减小鼠胃内定植的幽门螺旋杆菌的数目。Maleki等[8]证明了植物乳杆菌可以通过一些特定的免疫细胞信号通路来抑制幽门螺旋杆菌引发的胃癌。谭晓林等[9]使用复合乳酸菌联合抗生素三联、四联治疗幽门螺旋杆菌感染,与单纯的使用抗生素治疗组相比,既降低了不良药物反应的发生,同时也提高了幽门螺旋杆菌的根除率。然而,目前相关菌株的功效及机制还有待进一步研究[10−11],开发具有抗幽门螺旋杆菌活性的新型乳酸菌株,对于预防和治疗幽门螺旋感染意义重大。抗幽门螺旋杆菌体外筛选,主要以体外抑菌试验(如采用牛津杯法测抑菌圈)结果为依据,结合尿素酶活性抑制及对胃酸及胃蛋白酶的抵抗力进一步筛选。此外,益生菌的益生特性如疏水作用力、自凝集率[12]、交互凝集率以及乳酸菌耐受性[13](如耐酸、耐胆盐)等对益生菌能否到达和定植肠道并改善肠道菌群,从而进一步发挥其他益生功效至关重要。
本研究从发酵食品、乳制品和婴儿粪便中筛选具有拮抗幽门螺旋杆菌活性且益生特性良好的乳酸菌,旨在为后续动物试验和临床研究,及相关功能性乳制品的开发提供菌株和依据。
1 材料和方法
1.1 材料与仪器
供试菌株 本实验室筛选的各地自酿发酵蔬菜、甘南青海地区乳制品、杭州地区新生婴儿粪便的遗传稳定性优良的疑似乳酸菌菌株39株;指示菌株:幽门螺旋杆菌(Helicobacter Pylori)ATCC43504,大肠杆菌O157:H7(Escherichia coliO157:H7)ATCC 25922、鼠伤寒沙门氏菌(Salmonella typhimurium)ATCC 13311 美国典型培养物保藏中心;单核细胞增生李斯特菌(Listeria monocytogenes)CMCC 54007、金黄色葡萄球菌(Staphylococcus aureus)CMCC 26003 中国医学细菌保藏管理中心;甲硝唑、尿素酶、细菌基因组DNA抽提试剂盒、幽门螺旋杆菌液体培养基、胃蛋白酶(≥2500 U/mg) 生工生物工程(上海)有限公司;脱脂棉羊血、胆盐、幽门螺旋杆菌抑菌剂、营养琼脂培养基 青岛海博生物技术有限公司;抗生素药敏试纸 杭州微生物试剂有限公司;MRS肉汤培养基、琼脂培养基、LB琼脂培养基 北京陆桥技术股份有限公司;哥伦比亚血琼脂培养基赛默飞世尔科技公司;其余试剂 均为国产分析纯。TGL-16M低温高速离心机 上海卢湘仪离心机仪器有限公司;ES-315高压灭菌锅 日本TOMY公司;YS100光学显微镜 日本Nikon公司;WXJFTFG/1200QG标准实验室通风橱 无锡聚峰实验系统有限公司;SW-CJ-IF超净工作台 苏州安泰空气技术有限公司。
1.2 实验方法
1.2.1 乳酸菌发酵上清液与菌悬液的制备 将39株疑似乳酸菌分别接于MRS液体培养基中,37 ℃静置培养24 h后取出,8000 r/min,15 min,4 ℃离心,分别收集上清液和沉淀。上清液采用0.22 μm的滤器除菌,菌体沉淀用无菌PBS洗涤两次并重悬,使活菌数达到108CFU/mL。
1.2.2 幽门螺旋杆菌菌悬液的制备 取100 μL幽门螺旋杆菌涂布于哥伦比亚血琼脂培养基中,微需氧环境中(7%氧气、10%二氧化碳、83%氮气),37 ℃培养72~96 h,挑取纯化培养三代后的单菌落接入幽门螺旋杆菌液体培养基中培养。液体培养后的混合液于8000 r/min,15 min,4 ℃条件下离心,分别收集上清液和菌体沉淀,菌体沉淀用干净的幽门螺旋杆菌液体培养基洗涤两次并重悬,使活菌数达到107CFU/mL。
1.2.3 乳酸菌对幽门螺旋杆菌抑制率的测定 采用琼脂扩散法来测量菌株对幽门螺旋杆菌的抑菌活性[14]。本试验以浓度为0.05 mg/mL的甲硝唑溶液为阳性对照,MRS液体培养基作为空白对照。
取100 μL幽门螺旋杆菌的菌悬液均匀涂布于不含抗生素的哥伦比亚血琼脂平板上,每孔加入待测液体100 μL(待测液体分别为乳酸菌发酵上清液、乳酸菌菌悬液、阳性对照和空白对照)。将接好发酵液的平板置于37 ℃、微需氧环境下培养72~96 h,培养结束后,用游标卡尺测量抑菌圈直径。
乳酸菌对幽门螺旋杆菌的抑制率计算公式如下:
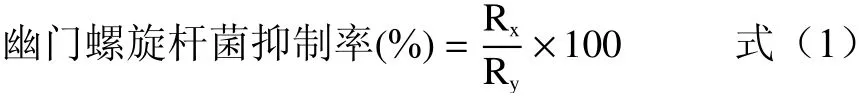
式中:Rx表示乳酸菌对幽门螺旋杆菌的抑菌圈直径,cm;Ry表示阳性对照对幽门螺旋杆菌的抑菌圈直径,cm。
1.2.4 尿素酶活性的测定 采用比色法测定样品的尿素酶活性[15],取40 μL幽门螺旋杆菌菌悬液分别与10 μL乳酸菌的发酵上清液或菌悬液混匀,以10 μL的无菌幽门螺旋杆菌液体培养基为对照。混合液加入至干净无菌的96孔板中,37 ℃微需氧环境培养48 h。将培养好的混合液体取出,每个孔内加入150 μL的尿素酶试剂(0.9% NaCl,20 mmol/L尿素,14 μg/mL苯酚红,用HCl调至pH为6.8),观察颜色变化并测定其OD550的数值。
1.2.5 乳酸菌的鉴定 将筛选到的疑似乳酸菌在MRS平板上传代,记录平板上的菌落大小及形态,用革兰氏染色法处理菌株并与光学显微镜下观察菌株形态。采用试剂盒提取基因组DNA,并采用细菌通用引物(Forward primer(27f):AGTTTGATCMTGG CTCAG;Reverse primer(1492r):GGTTACCTTGTT ACGACT)进行PCR,PCR程序见表1。取PCR产物送至生工生物工程(上海)有限公司进行测序,将所得到的序列于NCBI数据库中通过BLAST进行同源性比较确定菌株。通过MEGA软件对两株菌的系统发育树进行构建,采用邻接法(Neighbor-joining),自展分析1000次重复构建两株菌的系统发育树。

表1 PCR程序Table 1 PCR program
1.2.6 乳酸菌酸对模拟胃液的耐受性 以10%(v/v)的量将活菌数为108CFU/mL的乳酸菌菌悬液接种于pH为1.5的模拟胃液中[16](0.2% NaCl,胃蛋白酶0.35%,用HCl调至pH为1.5,0.22 μm过滤除菌备用),并分别在试验进行的0、3 h采样。为保证数值准确,使用倾注法进行活菌数的计数,取100 μL的乳酸菌菌悬液注入15 mL的55 ℃左右MRS固体培养基内,冷却至平皿内培养基定型,37 ℃静置培养24 h后进行计数,并基于所得数值分别计算两株乳酸菌3 h后在模拟胃液中的存活率,计算公式如下:

式中:A3表示乳酸菌株3 h的活菌数,CFU;A0表示乳酸菌株初始溶液的活菌数,CFU。
1.2.7 乳酸菌酸耐受性能测定 以10%(v/v)的量将活菌数为108CFU/mL的乳酸菌菌悬液接种于pH为3.0的MRS液体培养基中(液体培养基pH使用1 mol/L的NaOH与HCl调节),分别在0、3 h采样。为保证数值准确,使用倾注法进行活菌数的计数,取100 μL的乳酸菌菌悬液注入15 mL的55 ℃左右MRS固体培养基内,冷却后37 ℃静置培养24 h后进行计数,并基于所得数值分别计算两株乳酸菌3 h后的酸耐受率[17],酸耐受率计算公式如下:

式中:A3为乳酸菌株3 h的活菌数,CFU/mL;A0为乳酸菌株初始溶液的活菌数,CFU/mL。
1.2.8 乳酸菌胆盐耐受性能测定 以10%(v/v)的量将活菌数为108CFU/mL的乳酸菌菌悬液接种于0.3%牛胆盐(v/v)的MRS液体培养基中,在0、3 h采样。为保证数值准确,使用倾注法分别计数,取100 μL的乳酸菌菌悬液注入15 mL的55 ℃左右MRS固体培养基内,冷却后37 ℃静置培养24 h后进行计数,并基于所得数值计算3 h后的胆盐耐受率[18],胆盐耐受率计算公式如下:

式中:T3为胆盐处理3 h时的乳酸菌株的活菌数,CFU;T0为未被胆盐处理的乳酸菌株的活菌数,CFU。
1.2.9 乳酸菌疏水性能测定 取2 mL乳酸菌和2 mL二甲苯彻底混合,37 ℃水浴充分振荡5 min后,并在2 h后测量水相的吸光值[19],乳酸菌疏水性计算公式如下:

式中:A0代表乳酸菌株0 h的吸光值;At代表乳酸菌株t h的吸光值。
1.2.10 乳酸菌自凝集性能测定 选取活菌数为108CFU/mL的乳酸菌发酵液,8000 r/min,15 min离心收集沉淀,用干净的PBS洗涤两次后加入PBS调至与原发酵液相同体积。涡旋振荡器混合均匀后置混合液体于37 ℃培养,测试24 h内的OD620nm处的吸光值[17],乳酸菌自凝集率计算公式如下:

式中:A0为乳酸菌株0 h的吸光值;At为乳酸菌株t h的吸光值。
1.2.11 乳酸菌与幽门螺旋杆菌交互凝集性能测定幽门螺旋杆菌和乳酸菌的培养和收集同1.2.1,选取活菌数为108CFU/mL的乳酸菌发酵液,8000 r/min,15 min离心收集沉淀,用干净的PBS洗涤两次后加入PBS调至与原发酵液相同体积。涡旋振荡器混合均匀后置混合液体,加入等体积的幽门螺旋杆菌菌悬液混合,上下颠倒温和混匀后置于微需氧环境于37 ℃培养,测试24 h内的OD620处的吸光值[17],乳酸菌与幽门螺旋杆菌交互凝集率计算公式如下:

式中:Ax为乳酸菌株0 h吸光值;Ay为幽门螺旋杆菌0 h的吸光值;Amix为乳酸菌株与幽门螺旋杆菌t h后的混合吸光值。
1.2.12 乳酸菌对常见致病菌的抑菌活性研究 将四种指示菌株从−80 ℃冰箱取出,放置室温中解冻,分别挑取少量大肠杆菌和沙门氏菌的菌液于LB固体培养基上活化[20],挑取少量金黄葡萄球菌和单核细胞增生李斯特菌的菌液于营养琼脂平板上活化[21],24 h后挑取固体培养机上的指示菌株单菌落划线传代3次,将最后一次活化的单菌落接于对应的液体培养基中,37 ℃静置培养24 h后取出,8000 r/min,15 min,4 ℃离心,弃去上清液保留下层菌体沉淀并重悬,使活菌数达到108CFU/mL。
使用倾注法测试不同浓度的指示菌悬液的活菌数,操作方法如下:吸取不同浓度的菌悬液100 μL注入55 ℃液体状未凝固的LB固体培养基,摇晃至混合均匀,静置待混合培养基凝固后,37 ℃培养48 h,培养后计数。选取活菌数为108CFU/mL的混合液体并测试其OD620nm的吸光值,以此作为初始参照数值进行后续数据结果的处理。
1.2.13 抗生素敏感性研究 采用纸片扩散法测量乳酸菌株的抗生素敏感性[22],本研究方法参考临床和实验室标准研究所技术指南(CLSI)。10种抗生素分别为诺氟沙星(NOR)、环丙沙星(CIP)、复方新诺明(SXT)、庆大霉素(GM)、氯霉素(C)、青霉素(P)、红霉素(E)、氨苄青霉素(AM)、丁胺卡那(AK)和头孢唑林(CZ)。
使用广口锥形瓶配制MRS固体培养基,待培养基灭菌后置于55 ℃水浴保温,待温度降下来取出置于灭菌后的超净台中,将乳酸菌菌悬液(108CFU/mL)按照1%的量接入锥形瓶中,摇晃至混合均匀,将乳酸菌菌悬液与MRS固体培养基混合好后倒入无菌平皿中制成15 mL/皿的LB平板。待MRS平板凝固后,每个平板上均匀的用镊子轻轻贴上两只抗生素纸片。将贴好抗生素纸片的平板置于37 ℃,培养24 h。培养结束后,用游标卡尺测量抑菌圈直径(cm)并记录。
1.3 数据处理
所有试验中每个处理都重复三次。采用SPSS 19.0软件进行单因素方差分析及显著性分析(oneway ANOVA),使用Tukey进行多重比较,以P<0.05被认为是差异性显著,试验结果以平均值±标准偏差表示,作图软件为Origin9.1。
2 结果与分析
2.1 乳酸菌抑制幽门螺旋杆菌生长的测定
将本试验中筛选到的39株疑似乳酸菌逐一进行抑菌试验,通过比较抑菌圈直径的大小筛选具有抑制幽门螺旋杆菌功能的乳酸菌。本试验以乳酸菌菌悬液与发酵上清液的抑菌圈大小与阳性对照的比值百分数作为抑菌率,最终筛选到具有抑菌效果的9株乳酸菌,其抑菌结果见表2。其中菌株D1与GQ1702的乳酸菌菌悬液对幽门螺旋杆菌的抑制率显著(P<0.05)高于其他乳酸菌,这两株菌的发酵上清液对幽门螺旋杆菌的抑制率与菌株YF0101不显著。

表2 乳酸菌对幽门螺旋杆菌的抑制率和尿素酶活力Table 2 Anti-Helicobacter pylori activity of LAB and urease activity
多数菌株的菌悬液抑制率高于上清液,其中,D1、GQ1702的菌悬液和YF0101上清液对幽门螺旋杆菌抑制率最高,这三株菌的抑菌圈效果如图1。

图1 乳酸菌株对幽门螺旋杆菌的抑菌圈效果图Fig.1 Inhibitory zone of lactic acid strains against Helicobacter pylori
通过乳酸菌对幽门螺旋杆菌的抑菌圈效果的观察,发现MRS液体培养基也具有对幽门螺旋杆菌生长的抑制效果,但这种抑制效果要远低于乳酸菌的菌悬液和上清液。乳酸菌的菌悬液与上清液对幽门螺旋杆菌的抑制效果低于阳性对照,植物乳杆菌D1的菌悬液对幽门螺旋杆菌的抑制作用与阳性对照持平。
2.2 乳酸菌对尿素酶活性的抑制
幽门螺旋杆菌的尿素酶活性是通过测定尿素酶分解尿素溶液产生氨提高pH,从而使酚红由黄色变为红色。乳酸菌对尿素酶活性抑制结果见表1,所有菌株菌悬液的抑制率均优于发酵上清液,且菌株D1、GQ1702、GQ1501等菌悬液对尿素酶活性的抑制效果最佳。
基于上述结果,可知菌株D1和GQ1702抗幽门螺旋杆菌抑菌圈和尿素酶抑制效果均较好,因此选取这两株菌进行后续的研究。
2.3 菌株的鉴定
GQ1702与D1的菌落和菌株形态见图2。传代纯化培养后的GQ1702单菌落表面光滑,边缘不规则有轻微毛边形状,有很强烈的酸乳味道,经过革兰氏染色后该菌株在电子显微镜下观察呈杆状;D1菌落表面边缘均光滑,有酸味,形状规则呈圆形,中间凸起,该菌株在电子显微镜下观察呈杆状。

图2 菌株的菌落形态和菌体形态(400×)Fig.2 Colony morphology and cell morphology(400×)
分别对D1和GQ1702两株乳酸菌进行培养后,提取两株乳酸菌的DNA进行琼脂糖凝胶电泳处理,将电泳检测后的条带进行PCR处理,再次电泳后分别获得两条特异的扩增条带,大小为1.5 kb左右结果见图3。将PCR产物送至生工生物工程(上海)有限公司进行测序,根据GQ1702与D1的测序结果构建系统发育树,结果见图4和图5,并将测序结果进行BLAST序列比对。综合16S rDNA和系统发育树的结果可知,菌株GQ1702为瑞士乳杆菌(Lactobacillus helveticusstrain),菌株D1为植物乳杆菌(Lactobacillus plantarumstrain)。

图3 PCR扩增片段电泳检测图Fig.3 Electrophoresis detection diagram of PCR amplified fragments

图4 菌株GQ1702的系统发育树Fig.4 Phylogenetic tree of strain GQ1702

图5 菌株D1的系统发育树Fig.5 Phylogenetic tree of strain D1
2.4 乳酸菌在模拟胃液中的存活率、酸耐受率、胆盐耐受率和疏水作用力
在本试验中,GQ1702和D1在模拟胃液中的存活率、酸耐受率、胆盐耐受率和疏水作用力见表3。菌株D1在pH=1.5的模拟胃液中的存活率和对胆盐的耐受性更高,但对酸的耐受性及疏水作用力低于GQ1702。

表3 乳酸菌的酸、胆盐耐受率和疏水作用力Table 3 Acid and bile salt tolerance rate and hydrophobic force of lactic acid bacteria
2.5 乳酸菌株自凝集能力
本试验中分别对菌株D1和GQ1702的自凝集率进行了测试,结果见图6。在培养时间达到16 h时,菌株GQ1702的自凝集率高于D1,且两者的自凝集率均达到最大值,分别为84.67%和71.79%,然而,20 h后两株菌的自凝集率有下降趋势且差异不显著(P>0.05),在24 h时趋于稳定,分别为75.53%和68.61%,说明20 h前后两株乳酸菌具有最高的凝集成团能力且稳定聚集。
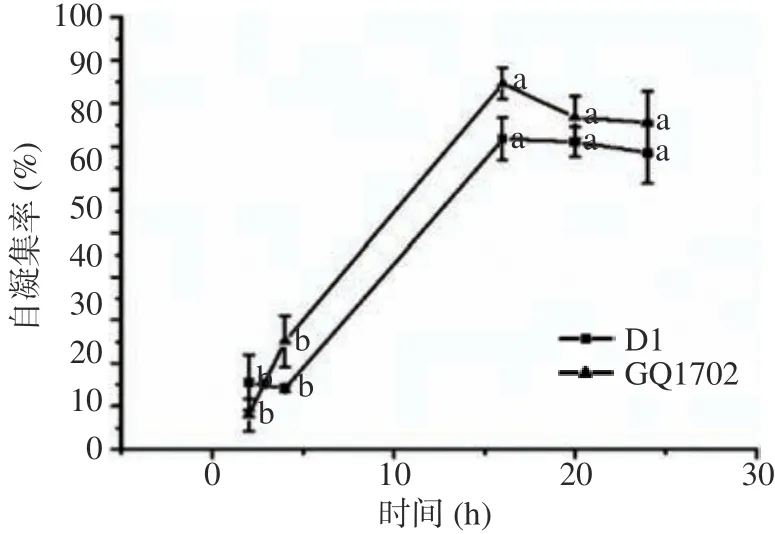
图6 乳酸菌自凝集作用Fig.6 Self agglutination of lactic acid bacteria
2.6 乳酸菌与幽门螺旋杆菌的交互凝集力
本试验分别对D1和GQ1702与幽门螺旋杆菌的交互凝集率进行了测试,试验结果见图7。在培养期间,两株菌交互凝集能力无显著性差异。在培养时间达到16 h时,菌株GQ1702与菌株D1的交互凝集率均达到最大值,之后趋于稳定。这说明这两株菌与幽门螺旋杆菌在16 h前后结合最为紧密且不易松散。
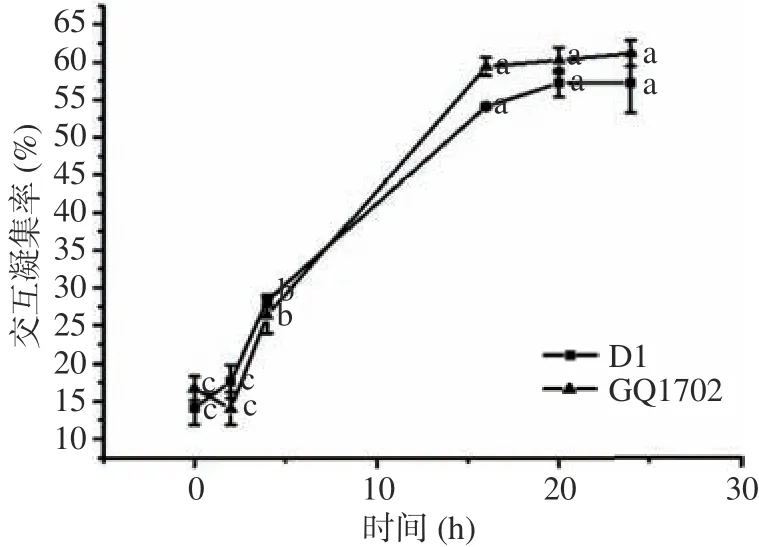
图7 乳酸菌交互凝集作用Fig.7 Cross agglutination of lactic acid bacteria
2.7 乳酸菌对其他致病菌的抗菌活性
在本试验中,采用4种肠道致病菌作为指示菌,分别检测菌株D1和GQ1702的菌悬液与发酵上清液的抑菌活性,数据结果见表4。
表4 结果表明GQ1702和D1对四种致病菌均有抑制作用,尤其是对革兰氏阳性细菌单核细胞增生李斯特菌的抑制作用最强,但对鼠伤寒沙门氏菌的抑制作用最小。 D1和GQ1702的上清液抑菌效果均高于其对应的菌悬液的抑菌效果。

表4 乳酸菌GQ1702和D1的抑菌活性Table 4 Antibacterial activity of strain GQ1702 and D1
2.8 乳酸菌的抗生素敏感性
本试验中分别对D1和GQ1702的常见药物的敏感性试验,结果见图8。

图8 乳酸菌的抗生素敏感性Fig.8 Antibiotic sensitivity of lactic acid bacteria
10种抗生素中,GQ1702对其中9种抗生素的敏感性大于D1,GQ1702和D1均对氯霉素、青霉素、红霉素、氨苄青霉素和头孢唑林都表现出极高的敏感性,对诺氟沙星、环丙沙星和丁胺卡那不敏感。这两株乳酸菌对复方新诺明和庆大霉素具有不同的敏感性。
3 讨论
乳酸菌抑制幽门螺旋杆菌生长研究受到越来越多的关注,研究表明某些乳酸菌的菌悬液或发酵上清液具有抑制幽门螺旋杆菌生长的作用。Techo等[23]对从泰国发酵米粉中筛选到的32株乳酸菌进行幽门螺旋杆菌的抑制试验,结果表明,其中15株菌对幽门螺旋杆菌具有抑制作用;Lactobacillus reuteriC234、Lactobacillus plantarum18和Lactobacillus caseiBD-II等乳酸菌的抑制效果相当于0.05 mg/mL的甲硝唑抑菌效果的46.25%~100%[17]。本研究中瑞士乳杆菌GQ1702发酵上清液和菌悬液的抑制率分别为76.52%和85.01%,植物乳杆菌D1的发酵上清液和菌悬液的抑制率分别为72.39%和100.68%。研究表明乳酸菌在体外抑制幽门螺旋杆菌的生长可能与其产生的抑菌物质有关,这些物质包括有机酸比如乳酸[24]和抗菌肽[25]等。本研究两株菌的抑菌效果优于其他菌株,可能是由于这两株乳酸菌产生了较高的抑制幽门螺旋杆菌的物质如抗菌肽所致。
幽门螺旋杆菌能够产生尿素酶,提高胃内环境中的pH,增加幽门螺旋杆菌在胃内的存活率[26]。尿素酶还能影响幽门螺旋杆菌的能量代谢,使幽门螺旋杆菌更容易粘附于胃部,并持续性的对胃部细胞产生直接毒性效应[27]。乳酸菌的发酵产物可以抑制尿素酶的活性,从而对幽门螺旋杆菌的生长起到抑制作用[28−30]。在本研究中,乳酸菌菌悬液对尿素酶活性抑制效果并不明显,与某些乳酸菌菌悬液的抑菌效果差异较大,这可能是由于乳杆菌起到抑制幽门螺旋杆菌作用的物质全部处于发酵上清液中,如乳酸等[23]。
在人体中,胃酸能杀死大部分微生物,而胃液中的蛋白酶对微生物也有一定的影响。因此在模拟胃液中的存活率和耐酸性是乳酸菌停留或通过胃液的重要指标。本试验中的两株乳酸菌在模拟胃液中均能存活,其中植物乳杆菌D1的存活率要远高于瑞士乳杆菌GQ1702,说明菌株D1比GQ1702更容易在胃中存活。这两株乳酸菌耐酸性极强,与嗜酸乳杆菌相当[31],这可能是由于乳酸菌本身复杂的耐酸机制,如细胞膜组成变化、调节细胞内外pH[32]、自动调节双组份信号转导系统等[33]。胆盐耐受性试验旨在测试乳酸菌是否能够通过模拟人体肠道环境,从而提高存活的定植概率。大部分乳酸菌的在胆盐中的存活率都处于0.2%~0.4%之间[34−36],而本试验中的植物乳杆菌D1和瑞士乳杆菌GQ1702在胆盐中的存活率都在1%左右,这说明GQ1702与D1比起大多数已发现的具有抗幽门螺旋杆菌活性的乳酸菌,更有可能在肠道中存活甚至定植。
微生物的自凝集能力是指其在水溶液中自主聚集成团的能力,且具有可逆性[37]。拮抗幽门螺旋杆菌的乳酸菌[17]和高粘附性乳酸菌[38]的自凝集率通常在45%~66%左右,而本试验中两株乳酸菌的自凝集率为75.53%和68.61%,这说明本试验的两株乳酸菌与幽门螺旋杆菌的结合更为紧密,探究可能的原因是菌体的静电作用或者是疏水作用。研究发现某些乳酸菌的自凝集率与粘附性正相关,自凝集率高的菌株往往能聚集成膜,并通过竞争抑制阻碍了有害菌群在胃肠道上的定植以及对黏膜的侵害[19]。
交互凝集现象指的是不同菌株之间的凝集现象,乳酸菌与幽门螺旋杆菌之间的凝集作用被认为与抑制幽门螺旋杆菌的能力相关[39]。靳彩娟[40]测定了乳酸菌与副溶血性弧菌、大肠杆菌和金黄葡萄球菌的交互凝集能力,发现交互凝集能力较好的乳酸菌的与致病菌的交互凝集率通常在35%~45%。陈晓华等[17]测试了16株乳酸菌与幽门螺旋杆菌的交互凝集率,交互凝集率在43.71%~59.25%之间。与上述菌株相比,本试验中瑞士乳杆菌GQ1702与植物乳杆菌D1的交互凝集率分别为61.18%和57.25%,都达到了较高的水平,猜测这两株乳酸菌与幽门螺旋杆菌可能存在表面结合位点,可以在人体内与幽门螺旋杆菌紧密结合,并促进幽门螺旋杆菌排出体外。
综上所述,本研究通过抗幽门螺旋杆菌和抑制尿素酶活性筛选到2株乳酸菌D1和GQ1702,结果表明,这两株菌具有良好抑制幽门螺旋杆菌能力。此外,这两株菌具有良好益生性能,比如耐酸、耐胆盐,表明该菌株能够到达肠道;良好的自凝集性和交互凝集性及抗菌特性表明这两株菌能一定程度上抵御肠道有害菌的侵害;较好的表面疏水性表明该菌株可能在肠道粘附;抗生素敏感性结果表明该菌株安全性较好。因此,乳酸菌D1和GQ1702具有良好的抗幽门和益生性能,具有开发抗幽门螺旋杆菌产品的潜力。
4 结论
本研究通过幽门螺旋杆菌抑制率及尿素酶活性试验筛选到2株具有潜在拮抗幽门螺旋杆菌的功效的乳酸菌,瑞士乳杆菌GQ1702和植物乳杆菌D1。其发酵产物的抗幽门螺旋杆菌活性分别相当于浓度为0.038和0.034 mg/mL甲硝唑的抑制率。菌株D1和GQ1702都能在模拟胃液中存活,并且D1的存活率(12.04%)要远高于GQ1702(0.11%)。菌株GQ1702和D1具有较好的酸耐受性和胆盐耐受性,其中GQ1702的胆盐耐受率为1.08%。这两株菌均有较高的自凝集性和与幽门螺旋杆菌的交互凝集性,且对常见8种抗生素不耐受并有较好的抗菌活性。本研究筛选的瑞士乳杆菌GQ1702和植物乳杆菌D1具有良好的拮抗幽门螺旋杆菌的功效及益生性能,具有进一步开发功能性乳制品潜力。
