梨炭疽菌拮抗细菌CL01的鉴定及其抗菌活性
2021-10-22李朝辉苗成琪孙伟波赵延存徐会永刘凤权
李朝辉,包 艳,苗成琪,凌 军,孙伟波,赵延存,徐会永,刘凤权
(江苏省农业科学院植物保护研究所/江苏省食品质量安全重点实验室-省部共建国家重点实验室培育基地,南京 210014)
梨是世界第三大水果,我国梨产量约占世界总产量的2/3,出口量占世界总出口量的1/6[1]。梨作为我国最主要的水果产业之一,在农业经济中占有重要地位,但在梨的生产过程中会受到多种病原真菌的危害,造成巨大的经济损失[2]。近年来,梨炭疽病在中国发生频繁且危害严重,已经严重制约了我国梨产业的健康发展[3]。2008年,梨炭疽病在砀山大爆发,部分发病严重的梨园,采前病果率为100%,烂果率高达70%以上,全县直接经济损失7~8亿元,当地梨产业经济损失惨重[4,5]。如何对梨炭疽病进行安全有效的防治已成为梨生产上亟待解决的问题之一。
目前,梨炭疽病的防治主要依赖化学农药,但是长期单一用药等因素造成病原菌的抗药性逐渐增强,农药施用剂量盲目增加,且防治效果不理想[6,7]。此外,化学农药的使用也容易造成残留危害人们的健康,在日趋严格的残留检测标准下,也降低梨的经济价值,给果农带来损失[8,9]。因此,对环境友好的生物防治方法在梨的生产中已经越来越被重视。梨炭疽病的生物防治方面,钱鑫磊等[10]报道了一株甲基营养型芽胞杆菌能够抑制梨胶孢炭疽病菌的菌丝生长和孢子萌发,刘邮洲等[11]报道了一株枯草芽胞杆菌对梨炭疽病菌有较好的拮抗作用,郭志华等[12]从砀山梨中分离得到一株内生的枯草芽胞杆菌可提高砀山梨果实对病菌的抗性。通常来源不同的菌株在生物学特性、抗菌谱等方面存在明显差异,具有菌株特异性。发掘能够对梨常见真菌病害具有与防治效果的生防菌株对于开发新的微生物杀菌剂具有重要的意义和价值。
根据中国农药信息网的农药登记数据[13],目前我国已登记的有效成分包含芽胞杆菌和类芽胞杆菌的生物杀菌剂已达138个。其中枯草芽胞杆菌已登记用于苹果炭疽病的防治,多粘类芽胞杆菌已登记用于西瓜炭疽病的防治。目前,梨树上尚无生防菌剂登记,类芽胞杆菌属细菌用于梨炭疽病的防治还无相关报道。本研究的目的是进一步发掘生防菌株资源,为梨炭疽病的防治提供新的选择。本研究通过对梨根际土壤细菌的分离,得到了1株对梨炭疽病菌具有较好拮抗效果的生防细菌CL01,通过形态学和分子生物学手段对生防菌株CL01进行了鉴定,并初步明确了CL01抑制梨炭疽菌的作用机制,评估了CL01发酵液及其正丁醇粗提物对梨果实炭疽病的防治效果,以期为类芽胞杆菌CL01开发成为防治梨真菌病害的生防菌剂提供参考。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 生防菌株CL01为本实验室从江苏句容梨园根际土壤分离筛选获得。供试病原真菌包括梨炭疽病菌Colletotrichum fructicola、梨黑斑病菌Alternaria alternata、梨轮纹病菌Botryosphaeria dothidea、梨梨腐烂病菌Valsa mali var.pyri、水稻纹枯病菌Rhizoctonia solani、马铃薯晚疫病菌Phytophthora infestans、番茄灰霉病菌Botrytis cinerea和油菜菌核病菌Sclerotinia scleotiorum,均由江苏省农业科学院植物保护研究所提供。
1.1.2 培养基 蛋白胨牛肉粉固体培养基(NA)[14]用于活化、纯培养细菌;蛋白胨牛肉粉液体培养基(NB)用于活化摇培细菌;马铃薯葡萄糖培养基(PDA)[15]用于活化、培养病原菌及拮抗谱测定;马铃薯葡萄糖液体培养基(PDB)用于摇培诱导梨炭疽菌产生分生孢子;M3S培养基[16,17]用于梨炭疽菌孢子萌发试验。
1.2 试验方法
1.2.1 生防菌株CL01的形态学观察和生理生化特征鉴定 将菌株CL01划线接种到NA平板上,将平板倒置于28 ℃培养箱中培养24 h,观察菌落形态。菌体的透射电镜形态观察参考魏荷芬等[18]方法进行,取NA培养基上的CL01单菌落,用NB培养基摇培12 h后离心收集菌体,首先用2.5%的戊二醛固定12 h,然后用PBS(磷酸盐缓冲液)漂洗3次,15 min/次,4 ℃、3000 r/min离心10 min收集菌体,钨酸铵负染色,干燥后用透射电镜观察。革兰氏染色和菌株的生理生化反应参照《常见细菌系统鉴定手册》[19]进行。
1.2.2 生防菌株CL01的分子鉴定 收集CL01菌体后使用细菌基因组DNA提取试剂盒(购自北京天根生化科技有限公司 货号:DP302-02)按照操作说明书提取菌株CL01的基因组DNA。采用16S rDNA通用引物 27F(5′−AGAGTTTGATCCTGGCTCAG−3′)和 1492R(5′−TACGGCTACCTTGTTACGACTT−3′)[19]扩增 CL01的 16S rDNA 序列。采用引物对 rpoB1689f_AW(5′−AACATTGGTTTGATCAAC−3′)和rpoB2335_R(5′−AACATTGGTTTGATCAAC−3′)[20]扩增 CL01 的 rpoB 基因序列。 PCR 反应体系(50 μL):ddH2O 21 μL,2×Es Taq MasterMix(Dye)25 μL,27F 和 1492R 引物各 1 μL,模板 2 μL。PCR 反应程序为:94 ℃预变性4 min;94 ℃变性1 min,50 ℃退火1 min,72 ℃复性1 min,重复35个循环,72 ℃下延伸 10 min。PCR 产物经琼脂糖凝胶电泳检测无误后送至上海生工测序,所测的序列在GenBank中进行BLASTA 序列相似性比对。选取比对结果中相似性高的模式菌株序列,使用MEGA 7.0.26软件进行序列分析和系统发育树的构建。
1.2.3 生防菌株CL01对梨炭疽菌菌丝生长的抑菌活性测定 采用平板对峙法[21]测定CL01对梨炭疽菌菌丝生长的抑制活性。将梨炭疽菌接种于PDA上进行活化,置于28 ℃培养箱倒置培养3 d后备用。将CL01单菌落接种于NB培养基中28 ℃摇培24 h备用。用直径为5 mm的打孔器在梨炭疽菌菌落边缘处打取菌饼,接种于新的PDA平板中央。在接种的菌饼两侧距培养皿边缘为皿直径 1/4处用灭菌的平头牙签蘸取CL01菌液画两道平行的线,然后将培养皿放入28 ℃培养箱中。培养4 d后,测量抑菌带宽度,并用光学显微镜(OLYMPUS CX31)拍摄受抑制一侧真菌菌落边缘菌丝的分支情况。
1.2.4 生防菌株CL01对梨炭疽菌分生孢子萌发的抑菌活性测定 用PDB液体培养基摇培梨炭疽菌的菌饼诱导其产生分生孢子[22]。摇培3 d后用无菌滤布过滤,离心收集分生孢子备用。将CL01单菌落接种于NB培养基中28 ℃摇培24 h后备用。将分生孢子加入M3S培养基中,浓度调为2×105分生孢子/mL。分别吸取15 μL分生孢子悬浮液和15 μL生防菌CL01菌液滴加在载玻片上混合均匀,放入铺有吸水滤纸的保鲜盒中,于28 ℃保湿培养。以不加生防菌液和加入无生防作用的大肠杆菌Escherichia coli菌液的分生孢子悬浮液作为两组对照。分别在孵育后4、8、12、24 h用光学显微镜观察拍照并统计孢子萌发率。
1.2.5 扫描电镜观察生防菌株CL01处理对梨炭疽菌菌丝的影响 同1.2.4的方法获得浓度为2×105孢子/mL的梨炭疽菌分生孢子悬浮液和CL01摇瓶发酵菌液。吸取20 μL分生孢子悬浮液滴加在盖玻片上孵育12 h使其萌发形成菌丝,然后在每个菌丝培养物液滴中加入10 μL的CL01发酵液继续共培养6 h。以不加生防菌液和加入无生防作用的大肠杆菌菌液的分生孢子悬浮液作为两组对照。将处理组和对照组的盖玻片分别放入盛有1×PBS的培养皿中轻柔漂洗3遍,然后滴加500 μL 2.5%的戊二醛到盖玻片上,放入4 ℃冰箱固定过夜。样品的后续处理过程参考范瑛阁等[23]的方法进行,磷酸缓冲液浸泡2次,每次15 min;然后在10%、20%、30%、50%、70%、90%梯度酒精浸泡,每次15 min;最后100%酒精浸泡2次,每次20 min;叔丁醇冲洗2次,最后1次放4 ℃冰箱固化;K750X冷冻干燥机冷冻干燥;ETD-2000小型离子溅射仪镀金;ZEISS EVO-LS10扫描电镜观察,拍照。
1.2.6 生防菌株CL01抑菌活性物质的粗提取及其在PDA平板上的抑菌活性测定 菌株CL01发酵液的粗提取参考王雨等[24]的研究方法进行。将菌株CL01接种于LB液体培养基中,置 28 ℃、180 r/min 培养 48 h后,得到菌株 CL01 发酵液。分别采用正丁醇萃取法、乙酸乙酯萃取法和硫酸铵饱和沉淀法获得相应的发酵液提取物。正丁醇萃取法[24]:用正丁醇有机溶剂对CL01发酵液按照 1:1 的比例进行萃取,得到上层正丁醇萃取液,旋转蒸发后冷冻干燥得到正丁醇粗提物,用甲醇作为溶解剂将正丁醇粗提物调至浓度为50 mg/mL。乙酸乙酯萃取法[25]:用乙酸乙酯有机溶剂对CL01发酵液按照 1:1 的比例进行萃取,得到上层乙酸乙酯萃取液,旋转蒸发后冷冻干燥得到乙酸乙酯粗提物,用甲醇作为溶解剂将乙酸乙酯粗提物调至浓度为50 mg/mL。硫酸铵饱和沉淀法[24]:取菌株CL01发酵液离心上清液,缓慢加入硫酸铵直至饱和,于4 ℃冰箱静置过夜,4 ℃、10000 r/min离心 30 min,进行干燥得CL01蛋白粗提物,用Tris-HCl作为溶解剂将蛋白粗提物调至浓度为50 mg/mL。
粗提物在PDA平板上的抑菌活性测定:向PDA平板中央接入直径为5 mm的梨炭疽菌菌饼,在以菌饼为中心的十字交叉对角线上距离培养皿边缘为皿直径1/4处的4个点各打一直径为5 mm的孔,其中3个孔注入粗提物30 μL(粗提物浓度为50 mg/mL),另外一个孔注入等体积的粗提物相对应的溶解剂作为对照。每处理重复3次。于28 ℃恒温培养4 d,测量各皿抑菌带宽度。
1.2.7 生防菌株CL01发酵液及其正丁醇粗提物对果实上梨炭疽病斑扩展的抑制效果测定 参考Kim等[26]的方法进行防效测定,取新鲜的香梨,用水冲洗干净,用70%酒精进行表面消毒后创伤接种梨炭疽病菌分生孢子液,保湿培养12 h后将CL01发酵液(2×109cfu/mL)和发酵液正丁醇粗提物(50 mg/mL)分别用长、宽为5 mm的灭菌滤纸蘸取后贴在果实创伤接种处,然后继续放入盛水保湿的保鲜盒中室温培养5 d,观察病斑扩展大小并测量病斑直径。CL01发酵液处理组以无菌水处理作为对照,发酵液正丁醇粗提物处理组以溶解剂甲醇处理作为对照。参考古丽孜热·曼合木提等[27]的方法计算防治效果,防治效果(%)=[(对照病斑面积-处理病斑面积)/(对照病斑面积)]×100,病斑面积=π(d/2)2,d为果实病斑直径平均值。
1.2.8 菌株CL01的抑菌谱测定 采用平板对峙法,参考杨晓蕾等[28]的研究方法,在PDA平板中央接种新鲜的梨炭疽菌菌饼(直径5 mm),在以菌饼为中心的十字交叉对角线上距离培养皿边缘为皿直径1/4处的4个点上分别接种3个生防菌CL01菌悬液和1个无菌水对照各2 μL,28 ℃培养4 d,拍照观察抑菌效果并测定抑菌带宽。同样的方法测定和评估生防菌CL01对梨黑斑病菌、梨轮纹病菌、梨腐烂病菌3种梨树重要病原菌及水稻纹枯病菌、番茄灰霉病菌、油菜菌核病菌、马铃薯晚疫病菌4种重要植物病原菌的拮抗活性。
1.2.9 数据统计与分析 试验数据统计分析采用GraphPad Prism软件和 Excel软件,差异显著性检验法采用 Duncan新复极差法。
2 结果与分析
2.1 生防菌株CL01的鉴定
菌株CL01在NA平板上形成圆形乳白色单菌落,菌落表面隆起、边缘整齐、中间乳白色边缘半透明(图 1A)。CL01单个菌体为杆状,革兰氏染色不定(gram variable)(图1B),长3~6 μm,宽0.6~0.8 μm,周生鞭毛(图1C)。生理生化实验结果表明(表1),CL01在接触酶试验、淀粉水解、V-P反应、硝酸盐还原试验、柠檬酸钠利用、明胶液化试验中呈阳性,而氧化酶试验、甲基红试验、硫化氢试验、吲哚试验为阴性。在耐盐性测试中,CL01在1%和2%的NaCl中能够生长,而在5%和10%的NaCl中不能生长。综合其形态特征和生理生化特性可初步将菌株CL01归于类芽胞杆菌属。16S rDNA和rpoB基因序列Blast分析结果表明,菌株CL01与模式菌株奥托威类芽胞杆菌MS2379的序列一致性最高,分别达到99.35%和96.47%。基于16S rDNA和rpoB基因序列采用最大似然法分别构建类芽胞杆菌属模式菌株的系统发育树,结果如图2和图3所示,CL01均与奥托威类芽胞杆菌亲缘关系最近,聚成一个分支。菌株CL01的16S rDNA和rpoB基因序列已提交至GenBank数据库,序列检索号为MW332460和MW590224。综合其形态特征、生理生化特征及系统发育分析的结果,将CL01鉴定为奥托威类芽胞杆菌。
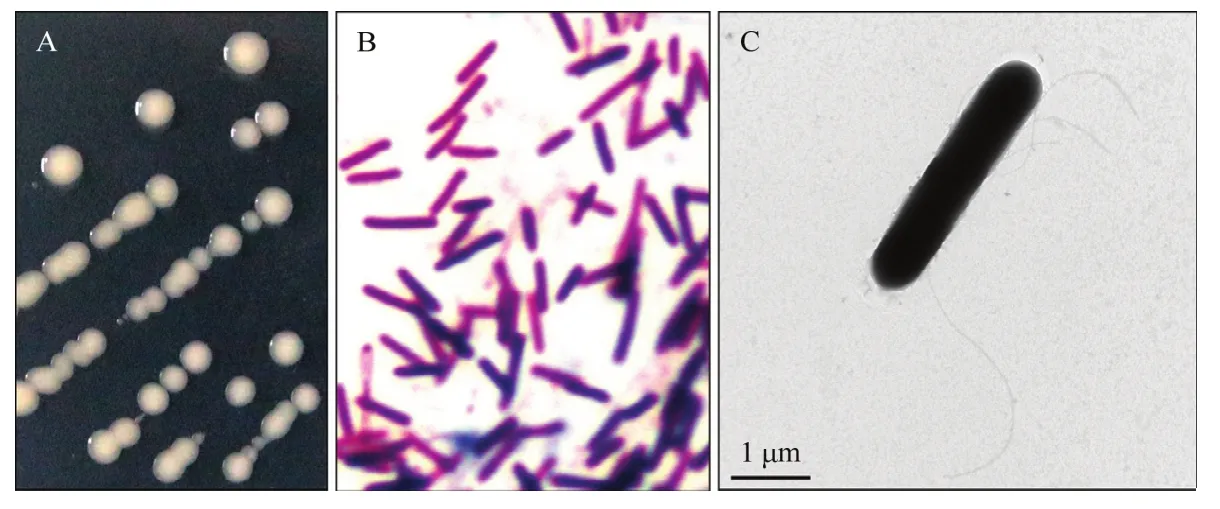
图1 菌株CL01的菌落和菌体形态观察Fig.1 Morphological observation of strain CL01
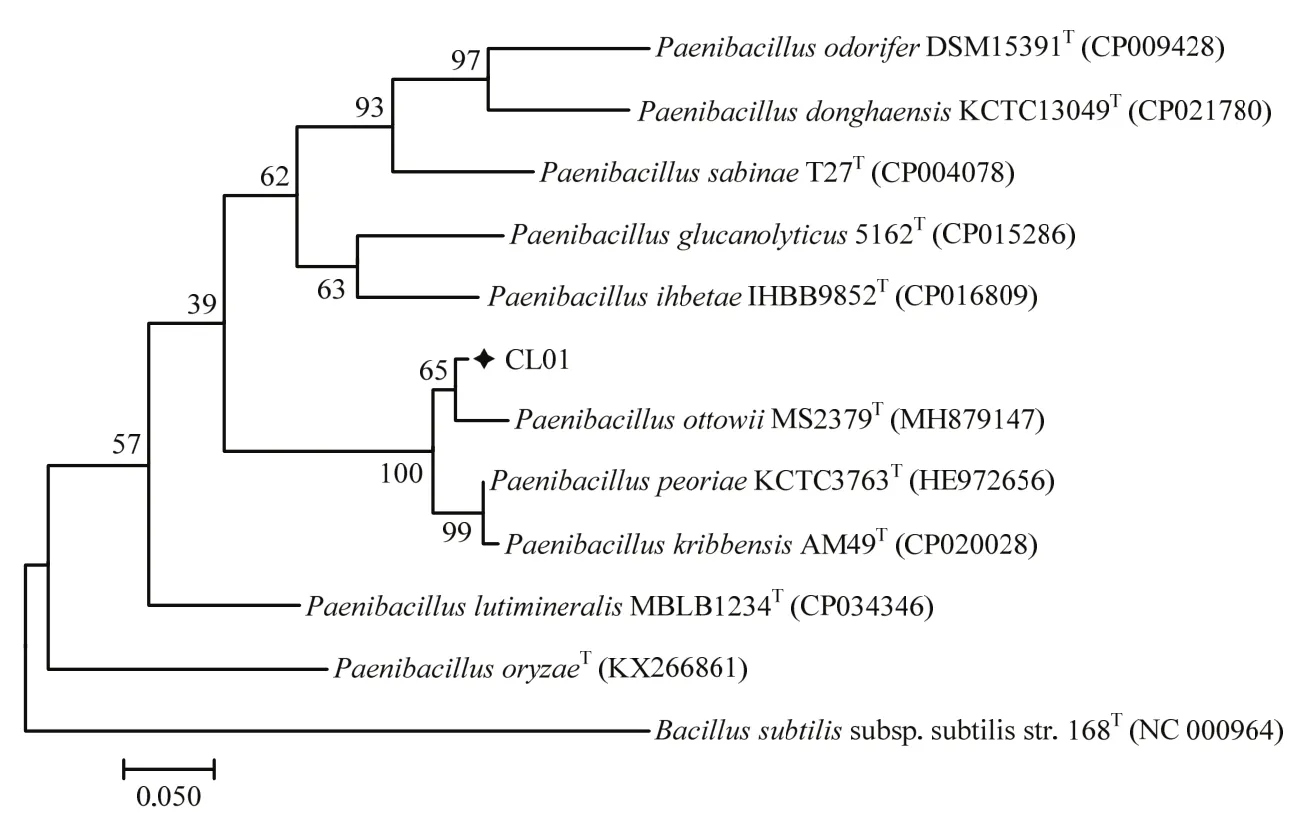
图3 基于rpoB基因序列采用最大似然法构建的菌株CL01系统发育树Fig.3 Phylogenetic tree of strain CL01 constructed based on rpoB gene sequence using maximum likelihood method
2.2 菌株CL01对梨炭疽菌菌丝生长的抑制作用
CL01在PDA平板上可以明显抑制梨炭疽菌的菌丝生长,抑菌带宽达8 mm以上(图4A,表2)。通过显微观察发现,在 PDA平板上靠近CL01一侧的菌落边缘,菌丝稠密,分支增多,生长方向紊乱(图4B)。进一步通过扫描电镜观察发现,CL01处理后的梨炭疽菌菌丝皱缩、凹陷,而未经细菌处理的对照组菌丝和经无生防作用的大肠杆菌处理的菌丝均呈现出圆润饱满的形态(图4C)。这些结果说明CL01产生的拮抗活性物质能够抑制菌丝的生长、干扰菌丝的分支方式、破坏菌丝细胞壁的完整性。
2.3 对梨炭疽菌孢子萌发的抑制作用
分生孢子萌发试验结果表明,生防菌CL01可以有效地抑制梨炭疽菌分生孢子的萌发。如图5所示,未经细菌处理的对照组分生孢子悬浮液在孵育后4 h,萌发率即可达到80%以上;加入无生防作用的大肠杆菌处理组中,分生孢子的萌发率在8 h时,能达到80%以上,并且随着孵育时间的延长,对照组和大肠杆菌处理组的芽管均在伸长。而CL01发酵液处理的孢子悬浮液,萌发率和芽管长度均明显低于对照组,并且即使延长孵育时间至24 h,CL01发酵液处理的分生孢子仍有50%以上不能萌发,萌发形成的芽管也不能充分延伸。
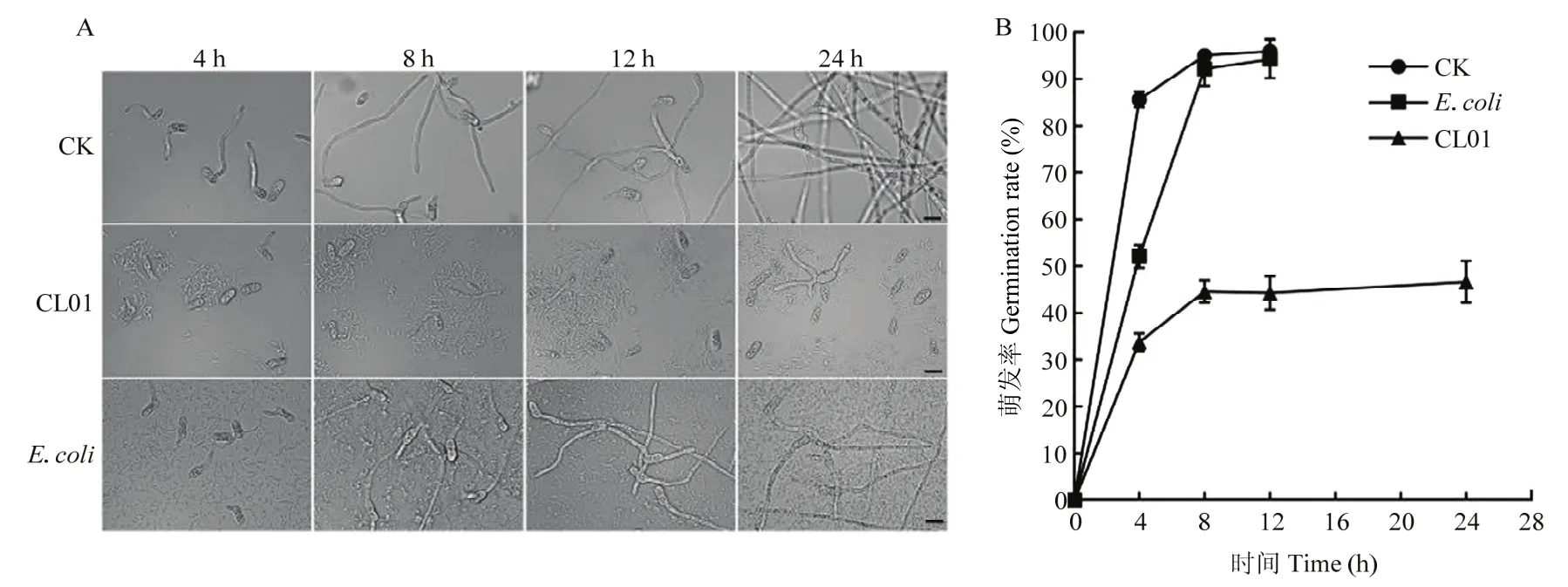
图5 CL01对梨炭疽菌孢子萌发的抑制效果Fig.5 Inhibitory effect of CL01 on conidia germination of C.fructicola
2.4 菌株CL01的发酵液粗提物对梨炭疽菌的抑制效果
如图6所示,CL01发酵液经正丁醇萃取后的粗提物表现出抑菌活性,抑菌带宽为(7.3±0.2)mm。而乙酸乙酯萃取后的粗提物和硫酸铵沉淀的方法得到的粗提物均无明显的抑菌活性(图6B,C)。这些结果表明CL01产生的抑菌活性物质存在于正丁醇有机相中。
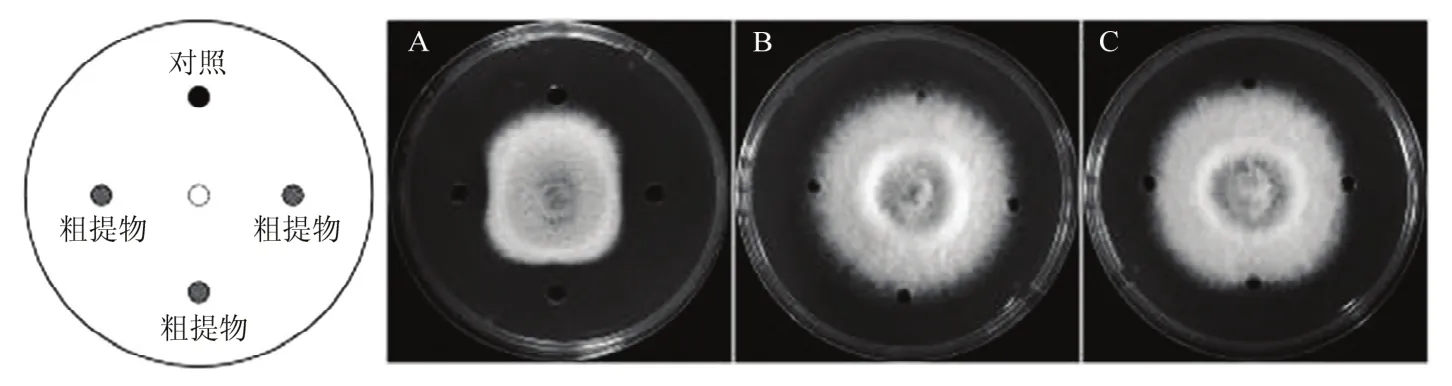
图6 CL01发酵液粗提物对梨炭疽菌的抑制效果Fig.6 The inhibitory effect of crude extract of CL01 fermentation broth on C.fructicola
2.5 菌株CL01发酵液及其正丁醇粗提物对果实上梨炭疽病斑扩展的抑制效果
果实接种试验结果如图7所示,直接进行伤口接种的果实上炭疽病病斑的直径在接种5 d后达(2.11±0.13)cm,而同样条件下经过CL01发酵液处理后接种的果实炭疽病病斑直径为(1.30±0.45)cm(图7A,C)。用CL01发酵液的正丁醇粗提物处理得到了类似的抑制效果(图7B,C)表明,用粗提物溶解剂甲醇处理后的果实接种梨炭疽菌5 d后,病斑直径可达到(1.99±0.16)cm,而用发酵液粗提物处理后的果实在同样的条件下病斑直径仅为(0.82±0.19)cm,CL01发酵液和发酵液正丁醇粗提物的防治效果分别达62.0%和83.0%。这些试验结果表明,CL01及其发酵液的正丁醇粗提物在梨果实上均能够有效地抑制梨炭疽病斑的扩展,且正丁醇粗提物的效果好于CL01发酵液。
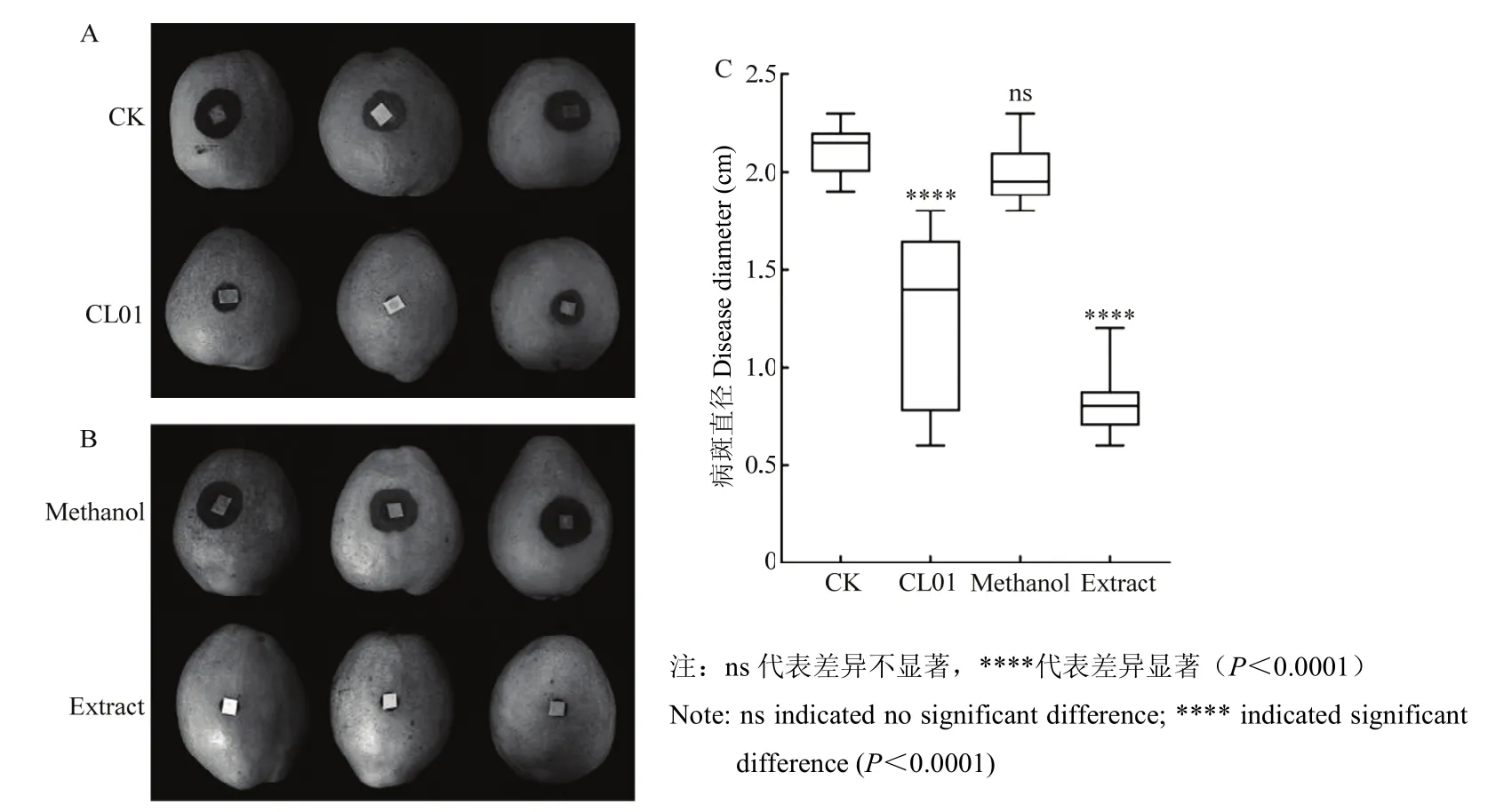
图7 CL01发酵液(A)和发酵液正丁醇粗提物(B)对梨炭疽病病斑扩展的抑制效果(C)Fig.7 Inhibitory effect of CL01 fermentation broth (A) or its n-butanol crude extract (B) on pear anthracnose lesion expansion (C)
2.6 菌株CL01的抑菌谱测定
结果如表2所示,CL01对梨树上4种供试病原真菌的抑菌带宽均在6 mm以上,对其他4种供试作物病原菌的抑菌带宽在4 mm以上。这些结果说明CL01不仅对梨炭疽菌具有较好抑制作用,还对梨上的其他3种常见病原真菌梨黑斑病菌、梨轮纹病菌、梨梨腐烂病菌,以及其他作物常见的病原真菌水稻纹枯病菌、大豆疫霉病菌、番茄灰霉病菌、油菜菌核病菌的菌丝生长均表现出较强的抑制作用。

表2 奥托威类芽胞杆菌CL01对8种植物病原菌的抑菌活性Table 2 Diameter of the inhibitory zone after inoculating the P.ottowii strain CL01 against 8 phytopathogens
3 讨论
随着生活水平的提高,人们对果品的消费逐渐由数量型向质量型转变,优质安全的果品越来越受到人们的青睐,无公害梨、绿色梨及有机梨在发达国家及国内高档市场的消费需求越来越旺盛[1]。近年来,随着化学农药的大量使用,农药对果品和果园环境的污染越来越严重,病害防治与农药污染的矛盾已成为果树生产中亟待解决的问题。提高果品质量,控制农药污染,生产无公害果品和绿色果品,已是当务之急。微生物杀菌剂因具有相对安全、无残留、环境友好等优点已经越来越被重视,成为国际绿色农药发展的重点。本研究从江苏省句容梨园的根际土壤中分离得到一株对梨炭疽病等真菌病害具有良好拮抗效果的奥托威类芽胞杆菌CL01,在对峙试验中CL01菌液对梨炭疽病的抑制带宽达到(8.2±0.4)mm,室内防效测定试验表明CL01的发酵液对果实炭疽病的防效可达到62.0%。梨炭疽病菌主要以菌丝和分生孢子的形式在果园中越冬,翌年,温度和湿度适宜时产生大量的分生孢子,随风雨传播。分生孢子是梨炭疽病病害循环中的初侵染源和再侵染源,因此筛选对于梨炭疽病菌分生孢子具有显著抑制作用的防治手段是梨炭疽病菌防治过程的关键。本研究中,奥托威类芽胞杆菌CL01对梨炭疽菌的菌丝生长和分生孢子萌发具有较强的抑制作用,显示出防治炭疽病的能力,具有进一步开发应用的潜力。
类芽胞杆菌Paenibacillus spp.广泛分布于土壤、植物表面、水体、农业废弃物等各种生境中,具有广谱的抗菌活性和较强的逆境适应性,和芽胞杆菌 Bacillus spp.一起被认为是最具有应用开发潜力的有益微生物之一。类芽胞杆菌作为重要的生防资源,对植物病害的防控机理包括拮抗作用、竞争定殖、促生作用和诱导抗性等。目前,类芽胞杆菌属的多粘类芽胞杆菌已被登记为微生物杀菌剂的有效成分,用于西瓜炭疽病、黄瓜角斑病、水稻纹枯病、小麦赤霉病、烟草赤星病等病害的防治[13]。奥托威类芽胞杆菌是Velazquez等[20]从处理过牛粪厌氧发酵系统的巴氏消毒液中首次分离报道的类芽胞杆菌属新成员。目前关于奥托威类芽胞杆菌用于植物病害防治方面还未有报道。本研究从梨园根际土壤中分离得到的奥托威类芽胞杆菌菌株CL01在抑菌谱测定试验中,对梨黑斑病菌、梨轮纹病菌、梨梨腐烂病菌、水稻纹枯病菌、大豆疫霉病菌、番茄灰霉病菌、油菜菌核病菌7种其他植物病原菌也有较好的抗性,有较好应用前景。然而,其在田间的定殖能力和防效还有待进一步的验证。
梨炭疽病的防治药剂较少,目前中国农药信息网登记的仅有嘧菌酯和苯醚·噻霉酮用于该病害的防治[13]。化学防治药剂种类单一,长时间连续使用容易导致病原菌产生抗药性。由于开发安全、高效化学杀菌剂的成本高昂,投资风险巨大,近年来,登记用于防治梨树真菌病害的新型化学杀菌剂也很少。类芽胞杆菌在代谢过程中会产生多种抗菌活性物质,从中分离纯化出的抗菌活性物质,可作为农药先导化合物开发出新型的环境友好型生物农药[29]。类芽胞杆菌产的抗菌物质种类较多,除了有机酸、过氧化氢和酯类物质外,研究较多的是细菌素和抗菌肽[30]。范磊等[31]从多粘类芽胞杆菌中分离到了Fusaricidins类抗真菌活性物质,Fusaricidins粗提物对黄瓜灰霉病的防效可达到 98.3%。沈小波等[32]从类芽胞杆菌 B69中分离得到了Pelgipeptins类抗菌物质,能够有效地抑制多种土传病害病原真菌的生长。本研究中对比CL01活性物质不同的粗提取方法,发现CL01的抑菌活性物质可以通过正丁醇萃取获得,其粗提物在平板上的抑菌带宽达到了(7.3±0.2)mm,对接种果实的梨炭疽病的防效可达到83.0%,表现出较好的抑菌活性。本研究为纯化和鉴定奥托威类芽胞杆菌的抑菌活性物质奠定了前期基础,粗提物中抑菌活性物质的明确仍需进行系统的分离和鉴定。
