RNA干扰下调PTEN表达对体外活化肝星状细胞α-微管蛋白及γ-微管蛋白表达的影响*
2021-10-22郝礼森季景秀蒋美钰张明婷张晓岚展宗媛杨小师陈盼盼
郝礼森, 季景秀, 蒋美钰, 张明婷, 张晓岚, 展宗媛, 杨小师, 陈盼盼
(1. 华北理工大学附属医院消化内科, 河北 唐山 063000; 2. 河北医科大学第二医院东院消化内科, 石家庄 050000)
肝星状细胞 (hepatic stellate cell, HSC) 是参与肝纤维病理过程中的最重要细胞[1,2]。当肝脏受到损伤时,静止的HSC活化为肌成纤维细胞,向肝损伤部位迁移,并在肝损伤部位大量增殖,导致肝内细胞外基质产生过多而降解减少,引起细胞外基质在肝脏过度沉积而导致肝纤维化[1-3]。因此,活化HSC迁移在肝纤维化病理过程中发挥重要作用。有研究证实[4, 5],细胞迁移与细胞骨架的聚合与解聚密切相关,细胞只有顺利完成其骨架的聚合与解聚才能实现迁移。而细胞骨架则是细胞内的一种蛋白纤维网状结构,由微丝、微管和中间纤维组成。其中,微管是一中空管状结构,是由α-微管蛋白(α-tubulin)和β-微管蛋白(β-tubulin)组成的异二聚体为基本单位构成,其不仅参与维持细胞形态,还在调控细胞迁移方面发挥作用[6]。γ-微管蛋白 (γ-tubulin)则是微管蛋白家族中的另一重要成员,参与微管的起始组装及促进α-tubulin与β-tubulin聚合[6-8]。第10号染色体缺失的磷酸酶张力蛋白同源物基因 (phosphatase and tensin homology detected on chromosome ten, PTEN)是具有磷酸酶活性的肿瘤抑制基因,可通过负性调控细胞内多条信号转导影响细胞的增殖、黏附、迁移等细胞生物学行为[9]。本课题组前期研究发现[10, 11],PTEN表达下调可显著增强体外活化HSC的迁移能力,并显著增强体外活化肝星状细胞骨架的重构及构成微丝的重要骨架蛋白—纤维状肌动蛋白(filamentous actin, F-actin)的形成。但有关PTEN表达下调对体外活化肝星状细胞α-tubulin及γ-tubulin的影响,目前仍不清楚。因此,本研究以大鼠肝星状细胞系HSC-T6为研究对象,利用RNA干扰技术下调HSC-T6细胞的PTEN表达,探讨PTEN表达下调对体外活化肝星状细胞α-tubulin及γ-tubulin表达的影响,为深化对肝纤维化病理生理机制的认识提供实验依据。
1 材料与方法
1.1 细胞与试剂
大鼠肝星状细胞系HSC-T6购于中国医学科学院肿瘤医院;表达绿色荧光蛋白(green fluorescent protein, GFP)的空病毒Ad-GFP及携带靶向PTEN的RNA干扰序列—短发夹RNA(short hairpin RNA, shRNA)并表达GFP的重组腺病毒Ad-shRNA/PTEN由武汉浙玛生物技术公司协助构建,通过反复感染AD293细胞获得实验所需的腺病毒;兔抗3-磷酸甘油醛脱氢酶(glyseral-dehyde- 3-phosphate dehydrogenase, GAPDH)单克隆抗体及小鼠抗PTEN单克隆抗体购于英国Abcam公司;兔抗α-tubulin单克隆抗体及小鼠抗γ-tubulin多克隆抗体购于美国Affinity公司;荧光素四甲基异硫氰酸罗丹明 (tetramethylrhodamine isothiocyanate, TRITC)标记的山羊抗兔及山羊抗小鼠IgG、辣根过氧化物酶 (horseradish peroxidase, HRP) 标记的山羊抗小鼠及山羊抗兔IgG均购于美国KPL公司。
1.2 腺病毒转染体外培养的活化肝星状细胞
以5×104cells/ml密度在培养器皿中接种活化大鼠肝星状细胞系HSC-T6,加入含10%胎牛血清的DMEM于5% CO2、37℃的孵育箱中培养,当细胞生长至80%-%90%密度时,以感染倍数100进行腺病毒转染。腺病毒转染前先确定感染所需的病毒量(所需病毒量=细胞数×感染倍数),然后去除细胞培养器皿中的培养基并用无血清无抗生素的DMEM清洗细胞,将无血清无抗生素DMEM稀释的腺病毒液加入培养器皿中,于5% CO2、37℃的孵育箱中孵育2 h后补充完全培养基继续孵育24 h,更换培养基继续培养。
1.3 实验分组
(1)对照组(Control组):以DMEM代替腺病毒液进行腺病毒转染;(2)Ad-GFP组:以对照空病毒Ad-GFP转染体外活化HSC;(3)Ad-shRNA/PTEN组:以携带靶向PTEN的shRNA的重组腺病毒Ad-shRNA/PTEN转染体外活化HSC。上述HSC在腺病毒转染12、24、48、72 h后于倒置荧光显微镜下观察其荧光表达,并通过计数表达荧光的HSC计算腺病毒转染效率。转染48 h后荧光表达阳性的HSC数达80%以上,72 h与48 h比较无明显增强,且细胞出现广泛病变并有明显脱落,本实验相关检测均采用腺病毒转染48 h的活化肝星状细胞。
1.4 实时荧光定量PCR技术检测体外活化HSC的PTEN mRNA表达
由上海生工生物公司协助设计合成目的基因PTEN及内参照基因GAPDH引物(PTEN:上游引物为5’-TCC TGC AGA AAG ACT TGA AGG T-3’,下游引物为5’-GCT GTG GTG GGT TAT GGT CT-3’,扩增产物为182 bp;GAPDH:上游引物为5’-GGC TCA TGA CCA CAG TCC AT-3’,下游引物为5’-ACA TTG GGG GTA GGA ACA CG-3’,扩增产物为202 bp)后,应用TRizol试剂盒并按操作说明提取3组HSC的总RNA,逆转录合成cDNA,然后在Master cycler ep Real Plex4 实时荧光定量PCR仪上进行实时定量扩增,采用相对定量2-△△Ct法比较3组HSC的PTEN mRNA表达差异[12]。
1.5 Western blot技术检测体外活化HSC的PTEN蛋白表达
应用细胞裂解液裂解上述各组HSC,然后提取细胞蛋白并测定蛋白含量,SDS-PAGE电泳后在含5%的BSA的TBST中封闭2 h,加入兔抗GAPDH单克隆抗体(1∶1 000)、小鼠抗PTEN单克隆抗体 (1∶100),4℃过夜后置于摇床上,TBST振摇洗膜,共4次,每次10 min;分别加入 HRP标记的山羊抗兔及山羊抗小鼠IgG (1∶5 000) 于室温下孵育2 h,置于摇床上TBST振摇洗膜,共4次,每次10 min;加入ECL显色液,用生物分子显像仪进行免疫显色。采用Image JV1.47软件对Western blot结果进行定量分析,结果用PTEN蛋白与GAPDH蛋白的积分光密度值(integral optical density, IOD)的比值表示。
1.6 免疫荧光技术检测体外活化肝星状细胞的α-tubulin及γ-tubulin表达
共聚焦小皿内以5×104cells/ml密度接种HSC-T6细胞,按照上述分组及腺病毒转染方法进行腺病毒转染并置于37℃、5% CO2细胞培养箱中培养,培养48 h后弃除培养基并用PBS轻洗5 min,在室温下用4%多聚甲醛固定细胞30 min,然后吸去4%多聚甲醛室温条件下用PBS轻洗3次,每次5 min;用0.1% Triton-X 室温下透膜处理5 min,洗净透膜液并用PBS轻洗3次,每次5 min;吸干PBS后用滤纸轻拭小皿上多余液体,并用2%山羊血清约150 μl封闭30 min;吸净封闭液,分别将1∶300稀释的兔抗α-tubulin单克隆抗体及1∶200稀释的小鼠抗γ-tubulin多克隆抗体加入上述共聚焦小皿内,于4℃孵育过夜,并于次日吸净上述一抗稀释液后用PBS轻洗3次,每次5 min;于一抗为兔抗α-tubulin单克隆抗体的共聚焦小皿内滴加TRITC标记的山羊抗兔IgG荧光二抗,于一抗为小鼠抗γ- tubulin多克隆抗体的共聚焦小皿内滴加TRITC标记的山羊抗小鼠IgG荧光二抗,于室温下孵育1 h(避光);弃去二抗稀释液后用PBS轻洗3次,每次5 min,然后用0.1%DAPI复染细胞核5 min,再用PBS轻洗后滴加防荧光淬灭甘油,并立即在激光扫描共聚焦显微镜进行观察,随机选取6个视野,应用Image-pro plus 6.0软件分析荧光图像,分别计算α-tubulin、γ-tubulin荧光表达IOD,以IOD作为其蛋白的表达水平。
1.7 统计学处理

2 结果
2.1 体外活化肝星状细胞的PTEN低表达模型构建
实时荧光定量PCR检测3组HSC的PTEN mRNA表达,Ad-shRNA/PTEN组及Ad-GFP组HSC的PTEN mRNA表达量相对于对照组分别为0.64倍、0.92倍(对照组HSC的PTEN mRNA表达量被定为1)。结果显示与对照组及Ad-GFP组比较,Ad-shRNA/PTEN组HSC的PTEN mRNA表达量明显降低 (P<0.05),而Ad-GFP组HSC的PTEN mRNA表达量与对照组比较无显著差异 (P>0.05,表1)。Western blot检测3组HSC的PTEN蛋白表达显示,与对照组(1.438±0.038)及Ad-GFP组(1.413±0.058)比较,Ad-shRNA/PTEN组HSC的PTEN蛋白表达量(1.088±0.036)明显降低(P<0.05);而Ad-GFP组与对照组HSC的PTEN蛋白表达量无显著差异 (P>0.05,图1)。上述结果表明靶向PTEN的shRNA成功转染体外活化肝星状细胞并下调HSC的PTEN表达,体外活化HSC的PTEN低表达模型成功构建。

Tab. 1 PTEN mRNA expression of HSC in three groups n=6)
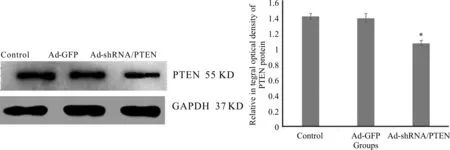
Fig. 1 PTEN protein expression of HSC in three groups was detected by Western blot n=6)
2.2 下调PTEN表达对体外活化肝星状细胞α-tubulin及γ-tubulin表达的影响
在激光扫描共聚焦显微镜下分别观察应用兔抗α-tubulin单克隆抗体及小鼠抗γ-tubulin多克隆抗体进行荧光染色的HSC, 其α-tubulin及γ-tubulin均显示红色荧光,主要表达于细胞浆。对照组和Ad-GFP组HSC的α-tubulin呈丝网状、辐射状均匀分布于细胞核周围,而Ad-shRNA/PTEN 组HSC的α-tubulin分布发生变化,表现为向细胞两端末梢逐渐聚集并在细胞两端稍增多;与对照组及Ad-GFP组比较,Ad-shRNA/PTEN组HSC的α-tubulin荧光IOD明显升高(P< 0.05),而Ad-GFP组与对照组HSC的 α-tubulin荧光IOD相比较,无显著差异(P>0.05,图2,表2)。3组HSC的γ-tubulin均在胞浆中有散在点状聚集,但Ad-shRNA/PTEN组HSC的γ-tubulin点状聚集更明显;与对照组及Ad-GFP组比较,Ad-shRNA/PTEN组HSC的γ-tubulin荧光IOD明显升高(P< 0.05),而Ad-GFP组与对照组HSC的γ-tubulin荧光IOD比较无显著差异(P>0.05,图3,表2)

Fig. 2 The α-tubulin expressions of HSC in three groups were observed under laser scanning confocal microscope (×600)

Tab. 2 The comparison of α-tubulin and γ-tubulin fluorescence IOD of HSC in three groups n=6)

Fig. 3 The γ-tubulin expressions of HSC in three groups were observed under laser scanning confocal microscope (×600)
3 讨论
肝纤维化是肝脏对各种损伤的自我修复反应,是各种慢性肝病演变为肝硬化的病理过程,而HSC则是参与此过程的最重要细胞[1, 2, 13 ]。研究显示[1, 2],在肝纤维化病理过程中,不仅HSC活化是启动该病理过程的开端,且活化HSC向肝损伤部位迁移也发挥重要作用。而细胞迁移则是细胞接收到迁移的信号后,通过细胞前沿的反复伸展,细胞基部的反复收缩,以及细胞与细胞间质的粘附及解粘附,向迁移信号源方向移动的一系列动态循环过程。在上述过程中,细胞骨架聚合与解聚的动态循环发挥着“执行者”的作用,若其动态性重构受阻,尤其是微丝和微管的形成及重构受阻,则细胞迁移过程将受到抑制[14, 15]。因此,细胞迁移不仅受细胞内多种信号转导的调空还与细胞骨架的聚合与解聚密切相关。
PTEN是具有磷酸酶活性的肿瘤抑制基因,其表达可通过负性调控黏着斑激酶(focal adhesion kinase, FAK)信号转导通路抑制肿瘤细胞的迁移[16]。本课题组的前期研究发现,PTEN 表达下调不仅可通过增强FAK信号活性,促进体外活化HSC迁移,并且可显著增强体外活化HSC的微丝肌动蛋白F-actin的重构[10, 11]。这表明PTEN表达异常不仅与肿瘤细胞的迁移有关,也可通过影响微丝肌动蛋白F-actin的重构参与对活化HSC迁移的调控。但关于PTEN表达下调对体外活化肝星状细胞α-tubulin表达的影响,目前仍不清楚。为探讨PTEN低表达对体外活化肝星状细胞α-tubulin表达的影响,本研究在应用RNA干扰技术下调体外活化HSC的PTEN表达后,采用免疫荧光法检测了活化HSC的α-tubulin表达变化。实验结果显示,下调体外活化HSC的PTEN表达引起HSC的α-tubulin表达显著升高,并使HSC内α-tubulin的分布发生变化,表现为向细胞两端末梢逐渐聚集、在细胞两端稍增多。如前所述α-tubulin和β-tubulin组成的异二聚体是微管的基本组成单位,HSC的α-tubulin胞内分布发生变化即提示其微管排列发生紊乱。结合本课题组前期研究显示大鼠纤维化肝组织及在体HSC的PTEN表达下调[17],PTEN表达下调可促进体外活化HSC的迁移[10]。本研究结果提示,PTEN表达下调可能通过引起活化HSC的α-tubulin表达上调及微管排列紊乱,进而促进活化肝星状细胞迁移而参与肝纤维化。
γ-tubulin是微管蛋白家族中的另一重要成员,位于细胞的中心体,功能上除了有助于α-tubulin与β-tubulin聚合,参与微管的起始组装外,还是有丝分裂中心体复制的关键蛋白,能控制有丝分裂纺锤体的复制[6-8]。本课题组在检测PTEN表达下调对体外活化肝星状细胞α-tubulin表达影响的同时,也检测了PTEN表达下调对体外活化肝星状细胞γ-tubulin表达的影响,结果显示,PTEN表达下调使体外活化HSC的γ-tubulin表达明显上调。γ-tubulin的功能与微管组装有关,可帮助α-tubulin和β-tubulin聚合,结合本课题组的前期研究显示体外活化HSC的PTEN表达下调可促进其迁移[10]。本研究结果提示,下调活化HSC 的PTEN表达可能通过增强肝星状细胞的γ-tubulin表达,进而促进其微管组装,加快其迁移而参与肝纤维化。另外,γ-tubulin为有丝分裂中心体复制的关键蛋白,通过参与有丝分裂纺锤体的复制而参与细胞增殖,其表达上调亦可能通过促进活化HSC的增殖参与肝纤维化。
综上所述,本研究表明下调PTEN表达可显著升高体外活化HSC的α-tubulin及γ-tubulin表达并使其胞内分布发生改变,提示PTEN表达下调引起的体外活化HSC上述微管蛋白变化可能通过促进活化HSC的迁移参与肝纤维化病理过程,这一实验结果为深化对肝纤维化的病理生理机制的理解提供了实验依据。
