农杆菌介导的栓皮栎体胚遗传转化初步研究
2021-10-21罗珍珍张存旭朱景乐张艳婷
罗珍珍 张存旭 朱景乐 王 敏 张艳婷
(1. 西北农林科技大学林学院,陕西 杨凌 712100;2. 国家林业和草原局泡桐研究开发中心,河南 郑州 450003)
栓皮栎(Quercus variabilis)属于壳斗科(Fagaceae)栎属,是我国特有的落叶乔木,广泛分布于华北、华南、西南地区。除了能进行木材、薪材、食用菌、天麻、橡子、栲胶生产外,树皮木栓层剥取后还可制软木,是我国最主要的软木资源树种,具有重要的生态价值和经济价值[1]。近年来,由于栓皮栎林受到环境影响、人为破坏以及病虫危害导致生产力下降。林木遗传改良是提高生产力和抗病虫害能力的重要途径,然而栓皮栎种子繁殖周期长,常规无性繁殖生根困难,这已成为该树种遗传改良的限制因子。
随着现代生物技术的发展,人们已将植物基因工程和常规育种相结合,以便加快遗传改良的进程。其中,农杆菌介导的遗传转化是植物转基因强有力的生物技术工具。以植物器官发生作为转化受体系统,国内外已先后在蓝桉(Eucalyptus globulus)[2]、杨树(Populus alba×P. berolinensis和Populus davidiana×P. bolleana)[3]、马尾松(Pinus massoniana)[4]等树种上得到转化植株。用体胚发生作为转化受体系统在辐射松(Pinus radiate)[5]、扁柏(Chamaecyparis obtusa)[6]、核桃(Juglans hindsii‘Rawlins’×Juglans regia)[7]等树种实现了遗传转化。
GUS基因(β-glucuronidase)和hptII基因(hygromycin phosphotransferase II gene)是遗传转化中常用到的报告基因和标记基因。GUS基因编码β-葡糖醛酸酶,β-葡糖醛酸酶作用于X-Gluc的产物经过氧化形成不溶解的蓝色物质,使具有GUS活性的部位呈现蓝色,常依据此原理检测目的基因的转入[8]。hptII基因编码潮霉素磷酸转移酶,转移到植物细胞后可赋予对潮霉素的抗性,用于抗性组织的筛选[9]。
在栎类树种中,Vidal等以Quercus robur的叶片诱导的体胚作为农杆菌介导的转化受体,成功实现植株再生[10]。Álvarez等建立了成龄欧洲栓皮栎(Quercus suber)的遗传转化系统,获得了43%的转化率[11]。而栓皮栎的遗传转化研究较少。本研究以栓皮栎体细胞胚胎发生为受体系统,研究影响农杆菌介导遗传转化的关键因素,为利用基因工程对栓皮栎进行遗传改良建立一个可靠、可重复的遗传转化体系。
1 材料与方法
1.1 植物材料
选取西北农林科技大学北校区的单株栓皮栎,采集授粉后7~8周的坚果,剥取未成熟合子胚,在添加了0.4 mg/L 6-BA和0.4 mg/L 2,4-D的MS培养基上诱导体胚发生,以其中一个胚性细胞系用于遗传转化研究。胚性组织通过次生体胚发生的方式在增殖培养基上保持与增殖,每4周继代1次。
1.2 培养基与培养条件
所有培养基以MS为基本培养基[12],均添加3%蔗糖和0.6%琼脂。其中,增殖培养基添加0.2 mg/L 6-BA+0.2 mg/L 2,4-D;预培养基添加1.0mg/L 6-BA+0.25 mg/L NAA+200 mg/L水 解 酪蛋白+400 mg/L谷氨酰胺;共培养基添加1.0 mg/L 6-BA+0.25 mg/L NAA+200 mg/L水 解 酪 蛋 白+400 mg/L谷氨酰胺+乙酰丁香酮(AS);选择培养基添加1.0 mg/L 6-BA+0.25 mg/L NAA+200 mg/L水解酪蛋白+400 mg/L谷氨酰胺+30 mg/L潮霉素(Hyg)+300 mg/L头孢霉素(Cef)。pH值调到5.8后在121 ℃高压灭菌30 min。培养条件为(25±2) ℃,暗培养。
1.3 遗传转化
1.3.1 菌株与载体
农杆菌菌株为EHA105,转化载体为pCAMBIA1301,该质粒载体携带有潮霉素抗性基因hptⅡ和GUS报告基因[8]。菌株与载体由西北农林科技大学彭少兵教授提供。
1.3.2 农杆菌的活化
挑取农杆菌EHA105单菌落,接种于含有50 mg/L卡那霉素、20 mg/L利福平的LB液体培养基中,在28 ℃条件下200 r/min摇菌24 h。之后于3 000 r/min离心沉淀,再将沉淀重悬于MS基本培养基中至所需的OD600备用。
1.3.3 抗生素敏感性试验
将胚性组织分别接种到含有不同浓度潮霉素、头孢霉素的预培养基上。潮霉素浓度设定为4、15、30、50 mg/L,头孢霉素浓度设定为100、150、200、250、300 mg/L。
1.3.4 转化试验
分离2~3个球形或心形/鱼雷期的体胚小团块,在预培养基上培养5、10、15 d,置于OD600=0.25、0.5、0.8的菌液中侵染10、20、30 min,取出并用无菌滤纸吸去表面多余的菌液,后接入共培养基(添加50、100、200 μmol/L乙酰丁香酮)中培养1、3、5 d,再转接到选择培养基培养。进行其中的某个因素试验时,其他因素设定为:不经过预培养,OD600=0.5,侵染时间为20 min,共培养天数为3 d,AS浓度为100 μmol/L。此后,新生的次生胚在选择培养基上每2周继代1次进行胚性组织的增殖培养。
1.3.5 GUS组织化学染色
将经过4周选择培养后产生的次生胚团块浸入改良的Jefferson GUS反应缓冲液[13],缓冲液组成为50 mmol/L Na2HPO4+NaH2PO4,pH值 7.0;2 mmol/L K3[Fe(CN)6];2 mmol/L K4[Fe(CN)6·3H2O];10 mmol/L Na2EDTA,pH值 8.0;0.1%Triton X-100;2 mmol/L X-Gluc。在37 ℃保温24 h后,用体视显微镜(OLYMPUS SZX16)观察。
1.3.6DNA的提取和GUS基因的PCR检测
采用植物基因组DNA提取试剂盒(康为世纪CW0553S),从胚性组织中提取DNA作为模板。GUS基因的上游引物为5′-TACCGACGA AAACGGCAAGA-3′,下游引物为5′-GCTAAC GTATCCACGCCGTA-3′。扩增体系组成:2 μL模板,1 μL上游引物,1 μL下游引物,10 μL 2×TaqPCR Pre Mix,6 μL dd H2O。扩增条件为:94 ℃预变性3 min;94 ℃变性30 s;62 ℃退火30 s;72 ℃延伸30 s;72 ℃延伸5 min;4 ℃终止;4 ℃保存,30个循环。每个PCR产物(1 μL)与1 μL上样液染料混合上样,采用1×TAE缓冲液制成的2%琼脂糖凝胶电泳分离,核酸染料染色,用凝胶成像仪(君意电泳JY04S-3E)检测PCR产物扩增。
1.4 数据采集和统计分析
试验均为单因素试验,设计每一处理20个外植体为1次重复,共重复3次。培养4周后统计体胚成活率和GUS转化率。成活率为成活的体胚团块数量占每个处理接种团块总数的百分比,GUS转化率为GUS染色呈蓝色的体胚团块数量占每个处理成活团块数的百分比。数据表示为平均值±标准误。采用SPSS 20.0软件对数据进行统计处理,其中包括方差分析和最小显著差数(LSD)测验。
2 结果与分析
2.1 抗生素对胚性愈伤组织成活的影响
潮霉素对胚性组织成活的影响如图1所示,当培养基中潮霉素的浓度为4 mg/L时,对胚性组织几乎没有影响,成活率为98.3%,与0 mg/L浓度下的成活率相比并没有显著差异;当培养基中潮霉素浓度为15 mg/L时,成活率下降为53.3%,与0 mg/L浓度下的成活率有显著差异;浓度达到30 mg/L时,组织体积变小,与培养基相接触一侧的组织很快褐化,长势逐渐变差,并且没有再长出次生胚,1个月后这些组织完全变黑,最终死亡,30 mg/L潮霉素导致组织成活率非常低,仅为1.7%;当潮霉素浓度为50 mg/L时,胚性组织全部变黑死亡,无次生胚产生。30 mg/L和50 mg/L浓度下的成活率与其他浓度下的成活率有显著差异,但这二者之间没有显著差异,综合考虑,把30 mg/L 潮霉素作为栓皮栎胚性组织的筛选压。
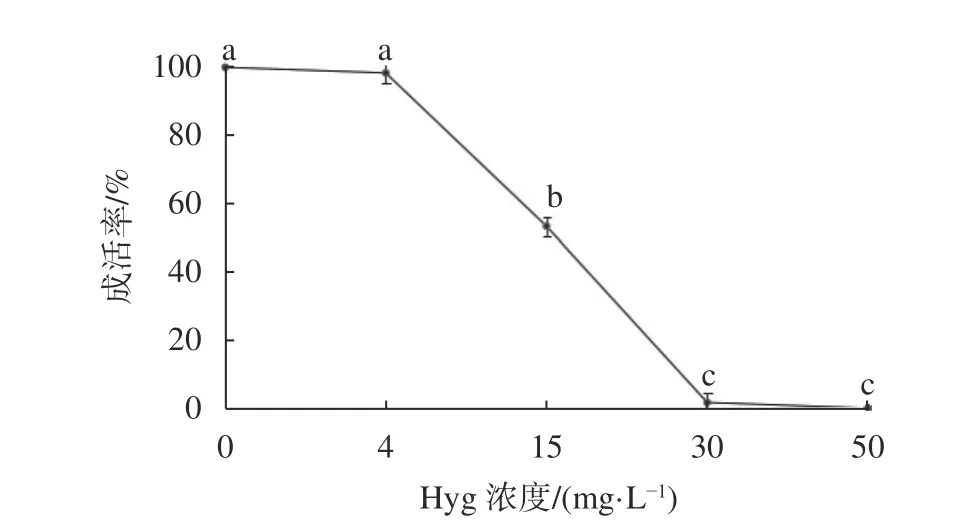
图1 潮霉素对胚性组织的影响Fig. 1 Effect of hygromycin on embryogenesis cluster
胚性组织在含不同浓度头孢霉素的培养基中培养4周后,成活率各有不同。图2可以看出,添加100 mg/L的头孢霉素对胚性组织成活率的影响并不明显;当头孢霉素浓度达到150 mg/L时,胚性组织长势变差,成活率为63.3%,与100 mg/L浓度下的成活率相比有显著差异,而与200 mg/L浓度下的成活率相比并没有显著差异;另外在250 mg/L的情况下,大部分组织逐渐发黑、褐化,33.3%的组织仍存活并有次生胚产生;当培养基中添加的头孢霉素浓度为300 mg/L时,胚性组织绝大多数变黑死亡,仅有5%成活,与其他浓度下的成活率相比均有显著差异。因此,可将300 mg/L头孢霉素也作为栓皮栎胚性组织的筛选压。
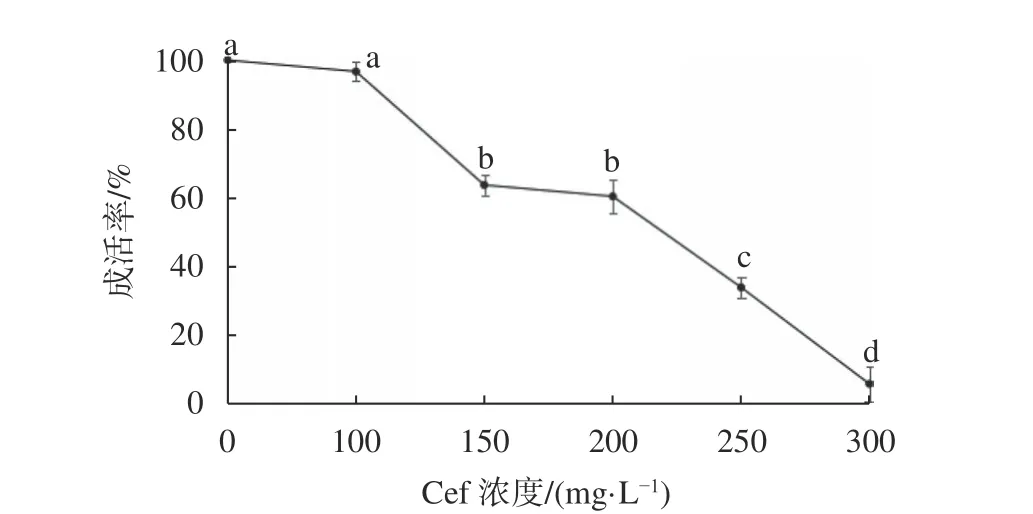
图2 头孢霉素对胚性组织的影响Fig. 2 Effect of cefotaxime on embryogenesis cluster
2.2 预培养时间对遗传转化的影响
由表1可以看出,适当时间的预培养可提高体胚成活率与GUS转化率。随着预培养时间的延长,成活率逐渐升高,预培养15 d的成活率最高。对于GUS转化率,预培养15 d的转化率最高,达到91.7%,与预培养5 d和10 d的效果相比差异显著,因此15 d为适宜的预培养时间。

表1 预培养天数对遗传转化的影响Table 1 Effect of pre-cultivation days on genetic transformation
2.3 菌液浓度和侵染时间对遗传转化的影响
随着菌液浓度的升高,体胚成活率与GUS转化率均呈现先升高后降低的趋势。由表2可知,菌液浓度OD600为0.25时,GUS转化率较低;OD600=0.5时,体胚成活率升高,GUS转化率达到100%;OD600为0.8时由于农杆菌污染严重难以脱菌,造成体胚成活率极低,仅为1.7%,而后导致转化率为0。综合考虑,侵染栓皮栎体胚的适宜农杆菌菌液浓度OD600为0.5。

表2 菌液浓度对遗传转化的影响Table 2 Effect of Agrobacterium concentration on genetic transformation
侵染时间延长,体胚成活率与GUS转化率先升高后降低。由表3可知,农杆菌侵染体胚时,侵染10 min农杆菌不能有效地在伤口处吸附,共培养后农杆菌生长较少,在后续培养中体胚的转化率低;侵染20 min时,体胚成活率与GUS转化率最高,分别达到11.7%和82.9%;当侵染30 min时,农杆菌对体胚的毒害作用较大,造成体胚成活率与转化率低。各侵染时间的GUS转化率无显著差异,考虑到侵染20 min时的体胚成活率最高,因此将20 min作为适宜的侵染时间。

表3 侵染时间对遗传转化的影响Table 3 Effect of infection time on genetic transformation
2.4 共培养时间和乙酰丁香酮对遗传转化的影响
侵染之后进入共培养阶段。由表4可知,体胚与农杆菌共培养1 d的成活率和转化率最低。共培养时间为3 d时,成活率最高,转化率达到100%;共培养5 d时,由于受体材料与农杆菌共培养时间过长,农杆菌过度生长而对体胚产生毒害,造成后续培养脱菌困难,成活率和转化率都有所降低。虽然各个共培养时间的GUS转化率无显著差异,考虑到共培养3 d的成活率与转化率最高,因此适宜的共培养时间为3 d。

表4 共培养时间对遗传转化的影响Table 4 Effect of co-cultivation time on genetic transformation
乙酰丁香酮对Vir区基因的活化具有重要作用,在共培养基中加入适量乙酰丁香酮有利于转化。表5可知,当乙酰丁香酮浓度为50 μmol/L时的成活率和GUS转化率最低,随着乙酰丁香酮浓度的升高,体胚成活率与GUS转化率也逐渐升高,200 μmol/L时的成活率和GUS转化率最高,分别为15.0%和100.0%。因此,在共培养基中添加200 μmol/L的乙酰丁香酮最为适宜。
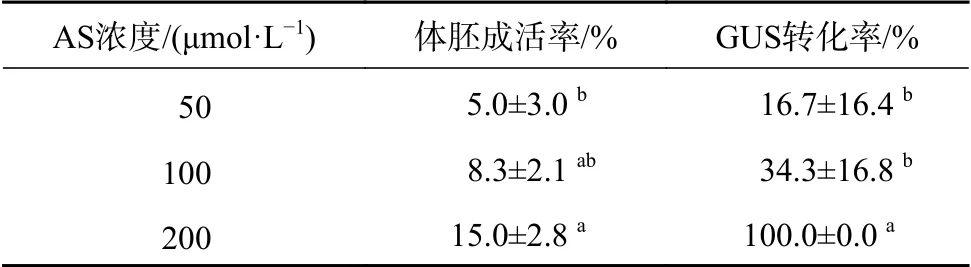
表5 共培养基中添加乙酰丁香酮浓度对遗传转化的影响Table 5 Effect of concentration of AS added to co-culture medium on genetic transformation
2.5 GUS染色和PCR检测
GUS组织活性检测结果表明,经过GUS组织化学染色,转化的胚性组织呈蓝色(图3d)。本研究中,使用GUS基因表达的结果确定转化条件,最终得到了转GUS基因组织,目前,导入GUS基因的胚性组织正在进行体胚成熟培养,然后再进行植株再生培养。在经过GUS染色验证的转化胚性组织中选取12块组织作GUS基因检测,同时,以未转化组织为阴性对照,质粒DNA为阳性对照。阳性质粒对照和1、2、3、5、6、7、8、10、11、12号转化胚性组织均能扩增出1 086 bp的目标条带,进一步证明GUS基因已转入到体胚中。而未转化对照组织和4、9号组织不能扩增出目标条带(图4),初步确定4和9为假阳性组织,其他为阳性组织。
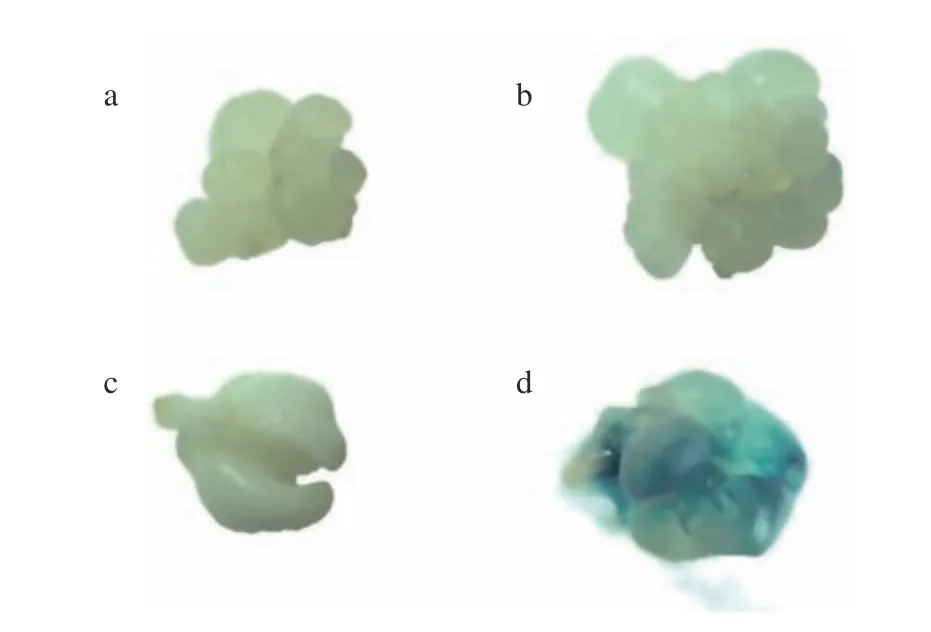
图3 遗传转化外植体及瞬时GUS表达Fig. 3 Explants used for genetic transformation and transient GUS expression in somatic embryos
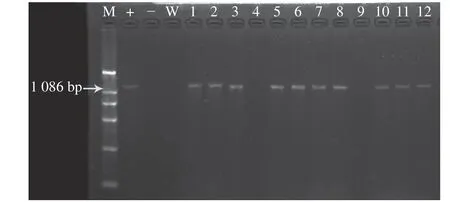
图4 转化体胚的PCR分析Fig. 4 PCR analysis of transformed embryos
3 结论与讨论
农杆菌介导遗传转化过程中一般经预培养、共培养、抗性筛选培养、转基因再生等多个环节[14]。共培养结束后,需要用抗生素抑制农杆菌的生长,并利用抗性筛选转化细胞,根据所用质粒的不同,选用的抗生素也不同。在前人的研究中多采用卡那霉素和潮霉素作为选择抗生素,头孢霉素作为抑菌抗生素[15-16],而不同植物对各种抗生素的耐受力也各不相同。在Sánchez等[17]测试的所有卡那霉素浓度下,组织块均可以存活,表明卡那霉素不足以作为筛选转化组织的抗生素,而潮霉素和头孢霉素的浓度分别为50 mg/L和300 mg/L是选择抗生素的适宜剂量。本研究中,在选择培养阶段潮霉素和头孢霉素的适宜浓度分别为30 mg/L和300 mg/L,由于树种的不同导致所用潮霉素剂量不同。
一般而言,植物材料先经过一段时间的预培养后再进行浸染,既可以减少农杆菌的损伤又能促进细胞处于最佳分裂状态,提高转入基因的表达和稳定整合率,但不同植物对农杆菌的敏感度不同[18],本研究发现经过15 d预培养的栓皮栎体胚转化率最高,而张晓英等[19]将国槐(Styphnolobium japonicum)叶片预培养5 d达到最佳效果。菌液浓度过高、侵染时间过长,农杆菌会对组织产生较大伤害,菌液浓度过低、侵染时间过短,则减少了T-DNA的整合概率而使转化率降低[20];本研究发现菌液浓度为OD600=0.5侵染20 min时,转化率最高,此结果与Álvarez等[11]的结果基本一致。
农杆菌附着在组织上不能立即转化,只有经过适当的共培养才能完成基因向植物细胞转移,从而整合到植物基因组。本研究将携带农杆菌的胚性组织共培养3 d转化率可达到100%,但是组织的染色呈现出局部蓝色或蓝色较浅,在所用的共培养基中加入200 μmol/L乙酰丁香酮后得到的组织染出了整体均匀的深蓝色,达到GUS表达的最佳效果,王蓓蓓等[21]也发现共培养3 d、添加200 μmol/L乙酰丁香酮对杂种白杨353(Populus tremula×Populus tremu-loides)的叶盘分化率有提高;而贾小明等[16]却发现共培养基中添加AS对河北杨(Populus hopeiensis)叶片转化率没有明显影响,分析其原因,AS的效果可能与菌株类型、植物种类和共培养基的pH值有关,AS与其他因素的交互作用还有待进一步研究。乙酰丁香酮作为一种诱导性较好的酚类化合物,主要是用来诱导农杆菌Vir区基因的活化与表达,促进T-DNA的加工和转移[22]。目前,在大多数的研究中,无论是侵染液还是共培养基,乙酰丁香酮的有效使用浓度一般在50~200 μmol/L。
GUS是被广泛使用的报告基因系统之一。杜丽等[14]通过对胚性愈伤组织GUS染色呈现出的蓝色确定了GUS基因的导入。林义章等[23]根据GUS基因设计引物对再生植株进行PCR检测,证实GUS基因已成功转入到植株基因组中。本研究通过GUS染色和PCR检测,证实了GUS基因的转入。
总之,本研究分析了影响农杆菌介导的栓皮栎遗传转化的不同因素。其中,预培养时间、菌液浓度和乙酰丁香酮浓度这3个因素是影响转化率的关键。通过本试验得到了栓皮栎的阳性体胚,将进一步进行植株再生。初步建立了以栓皮栎体胚发生为受体的遗传转化系统,为进一步建立高效、稳定的遗传转化体系奠定了基础。
