牛多瘤病毒PCR 检测方法的建立及验证
2021-10-20牛步青胡术然高有张海浩陈蕾西常亚军易力姚宇峰任芳芳
牛步青,胡术然,高有,张海浩,陈蕾西,常亚军,易力,姚宇峰,任芳芳
中国医学科学院北京协和医学院医学生物学研究所,云南昆明650503
牛多瘤病毒(bovine polyomavirus,BPyV)是一种无包膜的闭环双链DNA 病毒,属于多瘤病毒科(Polyomaviridae)[1-2]。BPyV 基因组大小约为 4 700 bp,GC 占比为41.41%,包含6 种蛋白质编译基因,其病毒颗粒大小为 40 ~ 45 nm[2-3]。BPyV 最早在 1974 年从被污染的猕猴肾细胞(macaque kidney cell)培养物中分离得到,并可在 MRC-5、MDBK、FRhK-4、Vero和 MA104 细胞中复制增殖[1,4]。
BPyV 为顽固污染物,存在于牛血清、牛肉产品,甚至污水和垃圾中[3]。全球70%批次的牛血清均暴露在被BPyV 污染的风险下[4]。商业用途的牛血清中常发现BPyV 的DNA,而且其基因也可导致感染[2]。感染BPyV 后可能会导致恶性肿瘤,现已证明,在细胞实验中BPyV 基因组DNA 前段和呼吸道合胞病毒(respiratory syncytial virus,RSV)启动子组成的重组病毒能在啮齿类动物细胞中致瘤[4]。多瘤病毒目前仅在免疫抑制人群中产生病理学症状,但BPyV 的潜在致病性不容忽视[2]。
虽然新的疫苗生产工艺正转向无血清培养基,但仍有很多疫苗使用血清生产[2]。使用被BPyV 污染的牛血清生产人用生物制品会产生极大的风险,而且多瘤病毒较强的灭活抗性加剧了此担忧[2,4]。《美国药典》已建议使用合适的方法检测用于生产人用生物制品的牛血清中的BPyV[5]。因此,建立一种快速便捷的方法检测牛血清中可能存在的BPyV污染对人用疫苗的安全性保障具有重要意义。
本研究设计了2 对BPyV 的特异性引物及1 个BPyV 阳性重组质粒,建立了BPyV PCR 检测方法,并对方法进行优化、验证及初步应用。
1 材料与方法
1.1 细胞及病毒 Vero 细胞(ATCC CCL-81)、MDBK细胞(牛肾细胞,ATCC CL-22)和BT 细胞(牛鼻甲骨细胞,ATCC CRL-1390)各 1 批及牛腺病毒 3 型(bovine adenovirus 3,BAV,ATCC VR-639)、牛细小病毒(bovine parvovirus,BPV,ATCC VR-767)毒种均由 ATCC 提供;1 批KMB17 细胞(人胚肺二倍体细胞)由中国医学科学院北京协和医学院医学生物学研究所提供。
1.2 主要试剂及仪器 PCR 试剂Premix TaqTMVersion 2.0 plus dye、病毒DNA 提取试剂盒MiniBEST Viral RNA /DNA Extraction Kit Ver.5.0、DL500 DNA marker 和50 bp DNA Ladder 均购自宝日医生物技术(北京)有限公司;MEM 培养基干粉购自北京三药科技开发公司,由中国医学科学院北京协和医学院医学生物学研究所中心供应科配置液体培养基;Gelred 核酸染料购自美国Biotium 生物技术公司;NanoDrop2000 分光光度计和SimpliAmpTMThermal Cycler 核酸扩增仪购自美国Thermo Fisher Scientific公司;VersaDoc 4000MP 凝胶成像系统购自美国Bio-Rad 公司。
1.3 质粒构建及引物合成 根据NCBI 中登录的BPyV 主要衣壳蛋白基因序列(BPyV_gp4 VP1,NC_001442.1)合成大小为 610 bp 的基因序列(1 996 ~2 605 bp),连接入pUC57 质粒,构建重组质粒BPyV-frag。
使用NCBI 中提供的Primer-BLAST 设计并选取针对 BPyV VP1 的 2 对引物:3PF5′-AGGTGGCGAACCACTTGAAA-3′与 3PR5′-GCACCTGGGATTTGTTGCTG-3′;9PF5′-TAGAGGCCTTCCCAGGTACA-3′与9PR5′-TGGCTAGTAACAGGTGGCAG-3′。引物对 3PF、3PR 扩增产物大小为 113 bp,引物对 9PF、9PR 扩增产物大小为120 bp。
重组质粒和引物均由生工生物工程(上海)股份有限公司合成,之后干粉使用TE 缓冲液(pH = 8.0)稀释。重组质粒溶解后使用Nanodrop2000 分光光度计定量。
1.4 方法的建立及PCR 退火温度的优化 以构建的重组质粒为模板进行PCR 扩增。反应体系共50 μL,包含 Premix TaqTMVersion 2.0 plus dye 反应溶液 25 μL,终浓度 0.1 μmol / L 的正向与反向引物,10 μL 浓度为 400 fg / μL 的 BPyV-frag 重组质粒模板和灭菌去离子水。PCR 反应条件为:94 ℃预变性 3 min;94 ℃变性 30 s,退火(56、58、60 ℃)30 s,72 ℃延伸 30 s,共 35 个循环;72 ℃再延伸 5 min。
1.5 方法的验证
1.5.1 灵敏度 用TE 缓冲液(pH = 8.0)将BPyV-frag 重组质粒分别稀释至 100 fg / μL (2.79 × 104copies / μL)、40 fg / μL(1.12 × 104copies / μL)、20 fg /μL(5.58 × 103copies/μL)、10 fg /μL(2.79 ×103copies / μL)、4 fg / μL(1.12 × 103copies / μL)、2 fg / μL(5.58 × 102copies / μL)。以稀释后的质粒为模板进行PCR 扩增,产物经使用含Gelred 核酸染料的2%琼脂糖凝胶电泳鉴定。按下式计算质粒拷贝数。
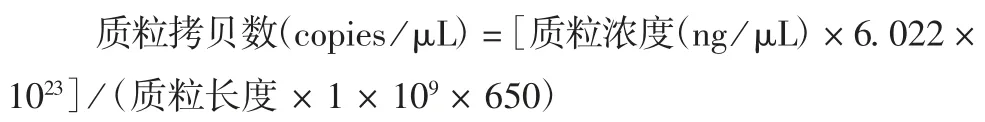
1.5.2 特异性 用MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0 提取 2 种 102CCID50/ mL 的牛源DNA 病毒 BAV 和 BPV DNA,使用 Nanodrop2000 分光光度计定量,以 2 fg / μL 的 BPyV-frag 重组质粒作为阳性对照,灭菌去离子水作为阴性对照,采用建立的PCR 法进行检测。
1.6 细胞培养上清液的检测 用MEM 培养基常规培养 Vero、MDBK、KMB17、和 BT 细胞,各取 1 批细胞培养上清液,加入终浓度为 2 fg / μL 的 BPyV-frag 重组质粒,制成恢复对照,以灭菌去离子水稀释的BPyV-frag 重组质粒为阳性对照,终浓度为 2 fg / μL,灭菌去离子水为阴性对照。用MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0 提取各组样品DNA,以其为模板,进行PCR 扩增。
2 结 果
2.1 PCR 退火温度的优化
2.1.1 引物对9PF、9PR 引物对9PF、9PR 在退火温度56、58、60 ℃下均能扩增出片段长度100 ~ 150 bp的目的条带,退火温度58 ℃时条带最明亮。因此,在需要获得最高扩增效率时应选择58 ℃退火温度;由于更高退火温度特异性更强,要获得最佳特异性应选择60 ℃退火温度。本研究后续试验选择60 ℃退火温度。见图1。
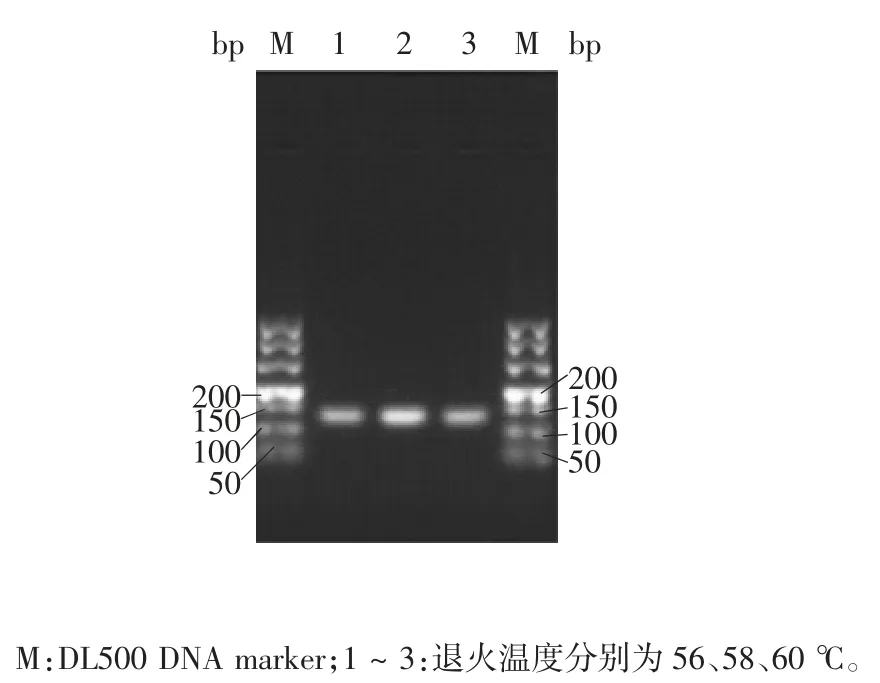
图1 引物9PF 与9PR 的退火温度优化Fig.1 Optimization of temperature for annealing in PCR(primers 9PF / 9PR)
2.1.2 引物对3PF、3PR 引物对3PF 与3PR 在退火温度56、58、60 ℃下均能扩增出片段长度100 ~150 bp 的目的条带,退火温度60 ℃时条带最明亮;且由于更高退火温度特异性更强,因此选择60 ℃退火温度以保证最佳的扩增效率和特异性。见图2。
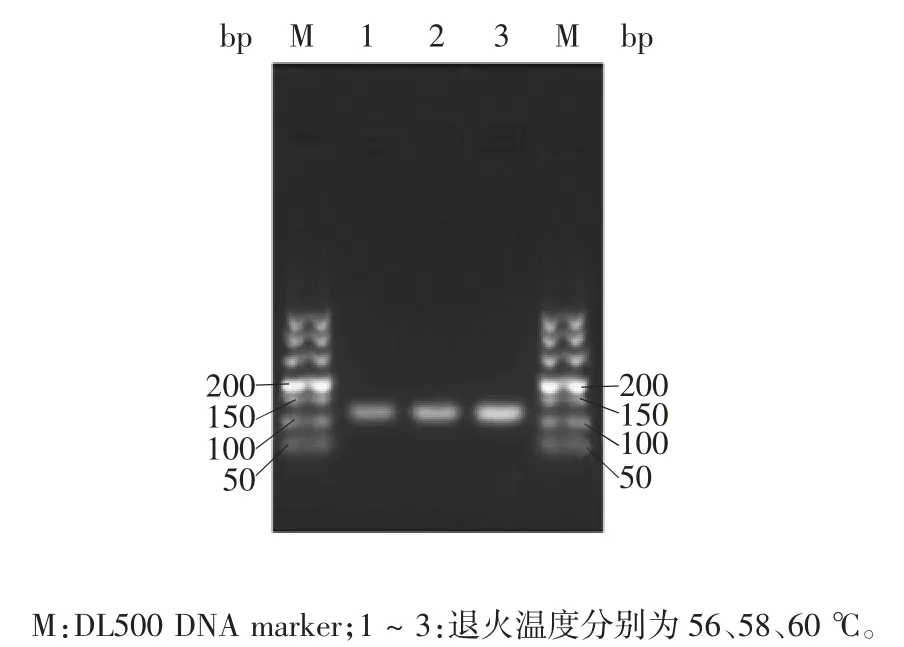
图2 引物3PF 与3PR 的退火温度优化Fig.2 Optimization of temperature for annealing in PCR(primers 3PF / 3PR)
2.2 方法的验证
2.2.1 灵敏度 引物 3PF、3PR 与 9PF、9PR 在各 BPyV-frag 重组质粒浓度下均可扩增出100 ~150 bp 的目的条带,2 个引物对的灵敏度均达 2 fg / μL,即558 copies / μL。与引物 3PF、3PR 相比,9PF、9PR 的条带更明亮。表明该方法具有较高的高灵敏度,引物对9PF、9PR 的灵敏度略高于3PF、3PR。见图3。

图3 方法的灵敏度验证Fig.3 Verification for sensitivity of PCR assay
2.2.2 特异性 引物 3PF、3PR 和 9PF、9PR 以高浓度的BPV DNA(101.6ng/μL)和BAV DNA(97.5 ng/μL)为模板时,均无扩增条带;微量BPyV-frag 重组质粒产生扩增条带。表明引物3PF、3PR 和9PF、9PR 均具有良好的特异性。见图4。

图4 方法的特异性验证Fig.4 Verification for specificity of PCR assay
2.3 细胞培养上清液的检测 BT、MDBK、KMB17、Vero 细胞培养上清液无扩增条带;加入终浓度为2 fg / μL BPyV-frag 重组质粒的各细胞培养上清液均扩增出100 ~150 bp 的目的条带;阳性对照均扩增出100 ~150 bp 的目的条带,且与各自对应图片中的重组质粒加细胞培养上清液组条带亮度一致。引物9PF、9PR 扩增的各条带均亮于引物3PF、3PR扩增的条带,引物 9PF、9PR 和 3PF、3PR 的条带均亮于对应灵敏度试验中浓度为2 fg / μL 的BPyV-frag重组质粒的条带。见图5 和图6。表明引物9PF、9PR 和3PF、3PR 能检测到 BT、MDBK、KMB17、Vero细胞培养上清液中终浓度为2 fg / μL 的BPyV-frag重组质粒。DNA 提取步骤和各细胞培养上清液成分对本实验方法无明显抑制作用。DNA 提取步骤中样品为200 μL,洗脱时无菌去离子水用量为50 μL,因此可能造成了浓缩的效果,进而使图片中条带较灵敏度试验亮度更高。样品BT、MDBK、KMB17、Vero细胞培养上清液中不含BPyV。
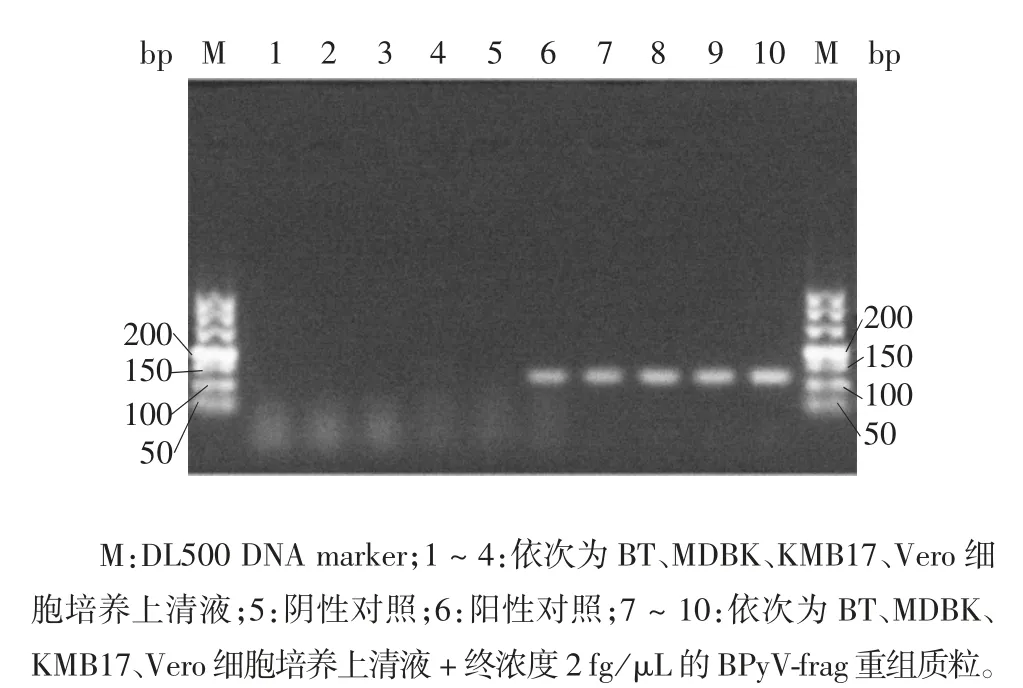
图5 引物3PF、3PR 的细胞培养上清液PCR 产物电泳图Fig.5 Electrophoretic profile of PCR products of cell culture supernatant(primers 3PF / 3PR)

图6 引物9PF、9PR 的细胞培养上清液PCR 产物电泳图Fig.6 Electrophoretic profile of PCR products of cell culture supernatant(primers 9PF / 9PR)
3 讨 论
兽用活疫苗中已检测到BPyV[6],而牛血清是最可能的污染来源。细胞培养可排除在牛血清中残存的 BPyV DNA 和无活性的 BPyV 颗粒[4],在一定程度上降低BPyV 污染造成的风险。但微量、有活性的BPyV 仍很难被检测发现。
在本所疫苗生产过程中,牛血清是常用的原材料,而疫苗在生产过程中易被原材料所携带的外源性病毒污染。目前已发现有多种可感染人类的牛源人畜共患疾病病毒,因此,对牛血清的外源病毒因子进行严格检查,在疫苗的质量控制中十分必要。根据《中国药典》四部(2020 版)要求[7],细胞培养用的牛血清至少要检测牛腹泻病毒、牛细小病毒、牛副流感病毒3 型、呼肠孤病毒3 型、牛腺病毒和狂犬病病毒6 种病毒。
目前,在《中国药典》四部(2020 版)以及《美国药典》USP41 中规定对牛血清进行病毒检查,其中终端血吸附检查分别在细胞培养14 与21 d 后进行[5,7]。但在多种灵长类和牛源细胞上接种量为3.1 × 108g.e(.the number of genome equivalents)的BPyV 进行培养,明显的BPyV 增殖在培养28 d 后才能检测到[4]。BPyV 增殖缓慢,且使用牛肾细胞培养10 周后仍未出现细胞病变[4]。增殖缓慢和不造成细胞病变的病毒会造成阴性的血吸附检查结果[8]。因此,用传统的直接观察法和血吸附检测法检测BPyV 污染会有一定困难。BPyV 污染的检测应选择对BPyV 敏感,易产生细胞病变的指示细胞。传统外源病毒因子检查法的终端检测可能需要配合更加灵敏的BPyV 检测方法,如qPCR 或PCR。
无血清培养基为潜在的BPyV 污染提供了一种可能的解决方案。传统的MEM 培养基被广泛用于培养细胞和扩增病毒,其中的牛血清是提供细胞生长的重要成分。但牛血清可能含有病毒等多种污染物[9]。为了解决此问题,目前已设计出数种无血清培养基。无血清培养基可支持Vero、CHO、MDCK 等细胞的生长。据报道[10],无血清培养基PER.C6 可用于生产基于Vero 细胞的灭活脊髓灰质炎疫苗(inactivated poliovirus vaccine,IPV),其费用更低,且病毒生产率比传统培养基高近10 倍。在柯萨奇病毒B1 型(Coxsackievirus B1)疫苗的动物试验中,为避免动物源的污染使用了无血清培养基,疫苗在之后的鼠类动物模型上表现出较强的免疫效果[11]。无血清培养基成功用于生产鸡新城疫(Newcastle disease virus,NDV)疫苗,同时也由于无血清培养基成本低,满足了兽用疫苗价格低廉的要求[12]。
本研究使用重组质粒代替BPyV 作为阳性样品。重组质粒与真正的BPyV 基因组模板扩增效率可能有出入,从而导致本实验得出的灵敏度与真实情况有差异。但由于重组质粒无病毒污染风险以及无市售BPyV 及其基因组参考品,用重组质粒作为阳性样品利于本方法在其他厂家进行推广和运用。在后续研究中如遇到BPyV 污染样品,将使用BPyV 进一步验证本方法。
本实验成功建立了BPyV 的PCR 检测方法,并进行了验证。引物3PF、3PR 和9PF、9PR 可用于检测BT、MDBK、KMB17 和 Vero 细胞培养上清液中的BPyV,灵敏度均达 2 fg / μL(558 copies / μL)。引物3PF、3PR 的灵敏度略低于9PF、9PR。成功构建了BPyV-frag 重组质粒,并可作为阳性对照代替BPyV。在牛血清外源病毒因子检查中应增加特异性检查法,对BPyV 进行PCR 检测。无阳性结果检出则基本确定无活BPyV 存在,为疫苗的安全性提供了进一步的保障。由于BPyV 增殖缓慢,需进一步提高BPyV 检测方法的灵敏度,加强检测的可靠性。后续将探究BPyV 的 qPCR 检测方法。
