轮状病毒微滴数字PCR 检测方法的建立、优化、验证及应用
2021-10-20尚丛珊孟婷婷侯亚妮李元刘利兵
尚丛珊,孟婷婷,侯亚妮,李元,刘利兵
西安培华学院医学院,陕西西安710125
病原体感染是引起儿童急性腹泻和重症腹泻的主要原因,如轮状病毒(rotavirus,RV)[1]、诺如病毒(Norovirus,NoV)[2]、人星状病毒(human astrovirus,HAstV)[3]、札如病毒(Sap virus,SaV)[4]、腺病毒(adenoviruses,AdV)[5]等,其中 RV 是引起成人及儿童腹泻的常见病毒。RV 是一种RNA 病毒,基因组为双链RNA,由11 段基因组成,分别编码6 种结构蛋白(VP1 ~ 4、VP6 和 VP7)和 6 种非结构蛋白(NSP1 ~ 6)[6-7]。根据 VP6 抗原蛋白结构不同,可分为 A~J 共 9 个群,只有 A、B 和 C 群 RV 可感染人类,且在人和动物中均有发现,A 群RV 一般不感染成人,但其是感染婴幼儿的主要病原体[8-9],目前尚无特效药。
RV 诊断常用的检测方法主要有电镜观察、ELISA 法、胶体金法、核酸杂交法及实时荧光定量 PCR(RT-qPCR)法等[10]。微滴数字 PCR(RT-ddPCR)法不依赖标准曲线,属于终点检测,不受扩增循环阈值的影响,定量结果更精确,对PCR 抑制剂更耐受,在改善定量分析准确性和变异性上有较大优势[11-12]。目前PCR 检测RV 体系主要以VP6、VP7 及NSP3 基因作为毒株的靶标,但在RT-ddPCR 检测体系的应用鲜见报道。非结构蛋白NSP5 为重要的胞质磷蛋白,RV 感染细胞后,NSP5 在胞质内表达并参与形成病毒池结构,调控RV 的复制和包装,NSP5 基因相对其他基因段具有高度保守的氨基酸序列[13-14]。因此,本研究建立一种基于NSP5 基因A组RV 的RT-ddPCR 检测方法,以期用于RV 的临床快速检测。
1 材料与方法
1.1 样本 临床样本来源于西安市儿童医院2018—2019 年门诊病例中5 岁以下腹泻患儿的粪便标本,共150 份(胶体金检测RV 阳性98 份,阴性52 份,阳性率为65.3%)。
1.2 细胞、质粒及病毒 MA104 细胞及质粒pEGFP-N2购自宝生物工程(大连)有限公司;A 组RV 由西安交通大学医学院微生物学实验室从阳性粪便样本中分离、鉴定和保存,NoV(基因型 GⅠ)、Adv(基因型 F4l 型)、HAstV(HAstV-1 型)及 SaV(GⅠ基因型)由该实验室保存。
1.3 主要试剂及仪器 Trizol 提取试剂及Super-Script®Ⅲ Platinum®One-Step Quantitative RT-PCR System 购自美国 Invitrogen 公司;QIAamp Viral RNA Mini Kit 购自德国 QIAGEN 公司;Dynabeads ®mRNA Purification Kit 购自美国 Life Technology 公司;7900-HT Fast 实时荧光 PCR 仪购自美国ABI 公司;一步法 RT-ddPCR 试剂盒、QX200 Droplet Digital PCR System 购自美国BIO-RAD 公司。
1.4 引物与探针的设计及合成 根据GenBank 中登录的A 组人RV 毒株NSP5 基因序列(KJ748475.1),应用MEGA3.1 软件进行同源性比对,选择NSP5 高度保守基因区域,通过软件Primer 5.0 设计引物和探针,上游引物 NSP5-F:5′-AAGACAAATGCAGACGCTGG-3′,下游引物 NSP5-R:5′-TGATGGTCGTGATTGCGTTG-3′,荧光探针 NSP5-P:5′-FAM-TCTGATTCTGCTTCAAACGATCCA-BHQ-3′。引物及探针均由上海捷瑞生物工程有限公司合成。
1.5 标准物质的制备 用PBS 将1 份阳性粪便样本稀释为 10%悬液,2 634 ×g离心 10 min,保留上清液,按mRNA Purification Kit 说明书提取RV 的RNA,根据 ISO 指南 35:2006[15]要求,制备 RV 的RNA 标准物质,确定该标准物质的特性值为(4.9 ±1.3)× 107copies / μL,-80 ℃保存。
1.6 方法的建立 将提取RV 的RNA 模板或RNA标准物质按RT-ddPCR 试剂盒说明书配制反应体系,共 20 μL(包含引物、探针、RV 的 RNA 模板),并生成微滴,加入96 孔板中,进行RT-ddPCR 扩增。反应条件为:60 ℃ 30 min,95 ℃ 5 min,95 ℃ 30 s,共40 个循环;退火 1 min,共 40 个循环;98 ℃ 10 min;4 ℃保持,反应温度升降速率<2.5 ℃/s。反应结束后将96 孔板放入QX200 Droplet Digital PCR system,仪器自动采集荧光信号,采用软件Quanta Soft 读取RNA 的 copies。
1.7 方法的优化
1.7.1 RT-ddPCR 的退火温度 按1.6 项方法检测RNA 核酸标准物质,退火温度分别设为55.1、56.0、57.2、58.1、58.9、59.9、61.0、62.1、63.2、64.1、64.9 ℃,引物浓度为 100 nmol / L,探针浓度为60 nmol / L。试验重复3 次,取平均值。导出各温度下微滴数数据,应用Excel 软件绘制直方图,进一步验证退火温度可靠性。
1.7.2 RT-ddPCR 的引物及探针浓度 按1.6 项方法检测RNA 核酸标准物质,退火温度为61.0 ℃,引物浓度分别设为 40、60、100、120 nmol / L,探针浓度分别设为 60、70、80、90、100 nmol / L,采用矩阵法筛选引物和探针的最佳浓度。
1.8 方法的验证
1.8.1 引物及探针特异性 按1.5 项方法提取RV、NoV、HAstV、Adv 及 SaV 的 RNA,采用优化的 RT-ddPCR法进行检测,验证引物及探针的特异性。
1.8.2 线性范围 将RNA 核酸标准物质进行102、103、104、105、5 × 105、106、5 × 106、107梯度稀释,每个稀释倍数的理论浓度分别为490 000、49 000、4 900、490、245、49、24.5 及 4.9 copies / μL,采用优化的RT-ddPCR 法进行检测。以理论值为横坐标,检测值为纵坐标,绘制标准曲线。同时进行RT-qPCR 检测,引物和探针序列同1.4 项,反应条件为:50 ℃ 60 min; 95 ℃ 15 min;95 ℃ 15 s,共 40 个循环;55 ~ 65 ℃ 1 min,共 40 个循环;98 ℃,10 min;4 ℃ 保持。以检测值为横坐标,理论值对数为纵坐标,绘制标准曲线。
1.8.3 灵敏性及重复性 将RNA 核酸标准物质进行 102、103、104、105、5 × 105、106、5 × 106、107、5 ×107梯度稀释,每个稀释倍数的理论浓度分别为490 000、49 000、4 900、490、245、49、24.5、4.9 及2.45 copies / μL,采用优化的 RT-ddPCR 及 RT-qPCR(同1.8.2 项)法进行检测,每个稀释浓度重复检测4 次,计算各梯度检测结果的相对标准偏差(RSD)。
1.9 方法的初步应用 按1.4 项方法提取2018 —2019 年收集的150 份腹泻患儿的粪便样本的RNA,分别采用优化的RT-ddPCR 法及RT-qPCR 法(同1.8.2 项)进行检测,比较两种方法的符合率。
2 结 果
2.1 方法的优化
2.1.1 最适RT-ddPCR 退火温度 退火温度在55 ~65 ℃区间内检测标准物质拷贝数的平均值分别为260、250、245、245、260、263、289、280、261、268 及260 copies / μL,阳性及阴性微滴可显著分成两簇。温度为61.0 及62.1℃时,阳性与阴性微滴两簇中间弥散微滴数目较少,表明扩增结果良好;退火温度为61.0 ℃时拷贝数最高,即61.0 ℃时扩增结果优于62.1 ℃。退火温度 < 59.9 及 > 63.0 ℃时,阳性和阴性微滴两簇中间弥散微滴数目较多,扩增结果较差。见图1。因此确定最佳的退火温度为61.0 ℃。61.0 ℃时 RT-ddPCR 检测 RV 直方图中,两个峰(阳性峰和阴性峰)显著分开中间无干扰,微滴数量及质量较好,表明RT-ddPCR 在该退火温度下检测RV 病毒数量可靠性较高。见图2。

图1 退火温度对RT-ddPCR 检测结果的影响Fig.1 Effect of annealing temperature on detection result by RT-ddPCR

图2 不同退火温度RT-ddPCR 法检测RV 的直方图Fig.2 Histograms of RV detection by RT-ddPCR at various annealing temperatures
2.1.2 最适RT-ddPCR 的引物及探针浓度 引物及探针浓度分别为 100 和 60 nmol / L 时,阳性荧光信号最强、阴性液滴荧光与阳性液滴荧光可显著分开,且阳性液滴生成的数量最高,见图3。因此,确定最佳引物及探针浓度分别为100 和60 nmol / L。
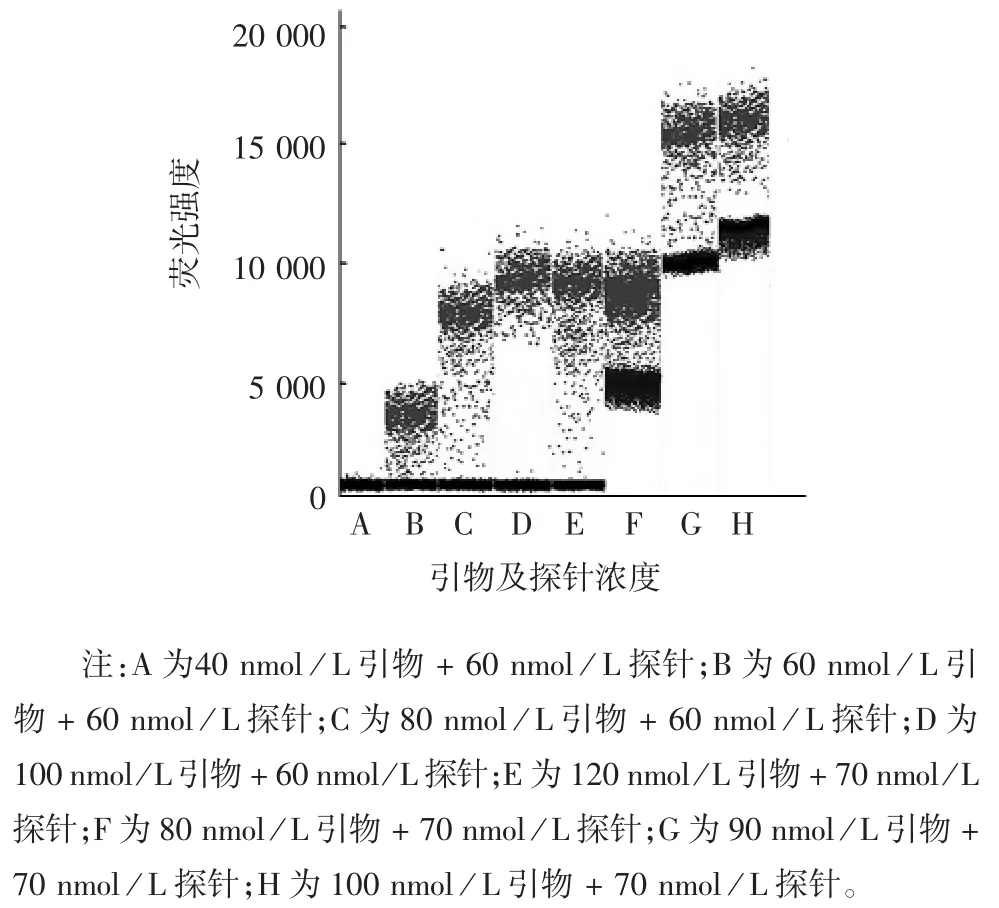
图3 不同引物及探针浓度对RT-ddPCR 检测结果的影响Fig.3 Effect of primer and probe concentrations on detection result by RT-ddPCR
2.2 方法的验证
2.2.1 引物及探针特异性 RV 检测有阳性微滴生成,其他4 种病毒均无阳性液滴生成,且RV 阳性微滴簇与阴性微滴簇可显著分开,微滴簇之间弥散微滴较少,见图4。表明设计的引物及探针特异性良好。
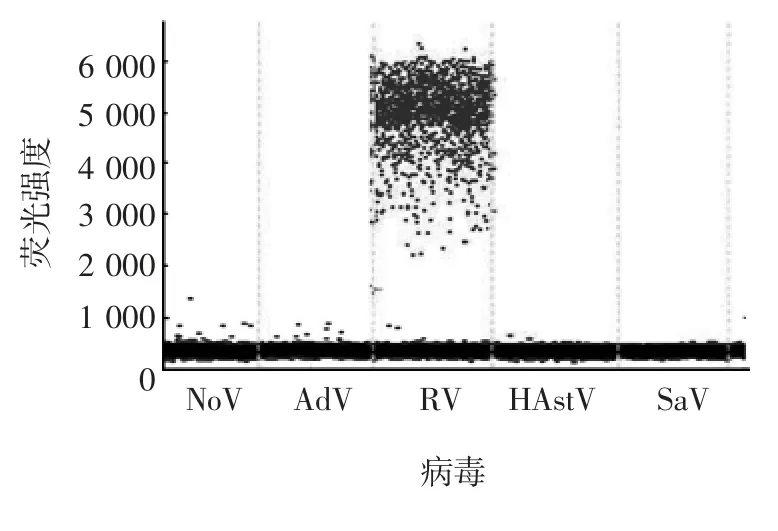
图4 引物和探针特异性的验证结果Fig.4 Verification for specificity of primer and probe
2.2.2 线性范围 RNA 核酸标准物质理论拷贝数过大(490 000 copies/μL)时,RT-ddPCR 法无法检出,但RT-qPCR 可检出;当理论拷贝数为4.9 copies/μL时,两种方法均可检出,理论值与检测值基本保持一致。RT-ddPCR 及RT-qPCR 法分别在4.95 ~49 000 即 4.95~490 000 copies /μL 范围内,与检测值呈良好的线性关系;线性方程分别为y=1.100 0x-44.257 0 和y= 0.185 4x- 0.112 2,R2分别为1.000 0 和 0.997 2,见图 5。表明 RT-qPCR 法比 RT-ddPCR 法的检测范围广。
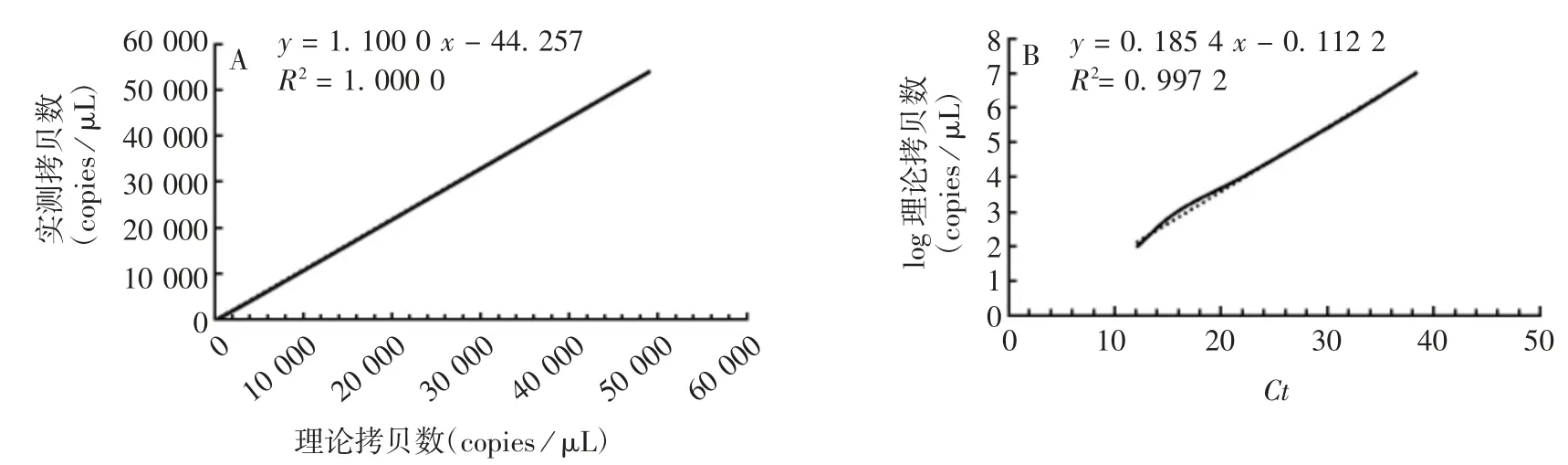
图5 A 群 RV RT-ddPCR(A)和RT-qPCR(B)检测方法的线性关系Fig.5 Linear relationship of RT-ddPCR(A)and RT-qPCR(B)for detection of groups A RV
2.2.3 灵敏性及重复性 RNA 核酸标准物质理论拷贝数过大(490 000 copies / μL)时,RT-ddPCR 法无法检出;RT-qPCR 可检出,RSD为 4.68,但Ct过低,为12.15;当拷理论贝数达 4.9 copies/μL 时,RT-ddPCR法的RSD略高于 RT-qPCR 法,但 RT-qPCR 的Ct过大,表明此时RT-qPCR 法扩增效率可能较低;其他浓度两种方法检测的RSD分别为1.75% ~ 5.24%和0.34% ~ 4.68%。两种方法最低检测稀释倍数均为 5 × 107,即检测最低拷贝数为 2.45 copies / μL。见图 6、表 1 和表 2。

图6 不同稀释浓度对RT-ddPCR 检测结果的影响Fig.6 Effect of dilution factor on detection result by RT-ddPCR
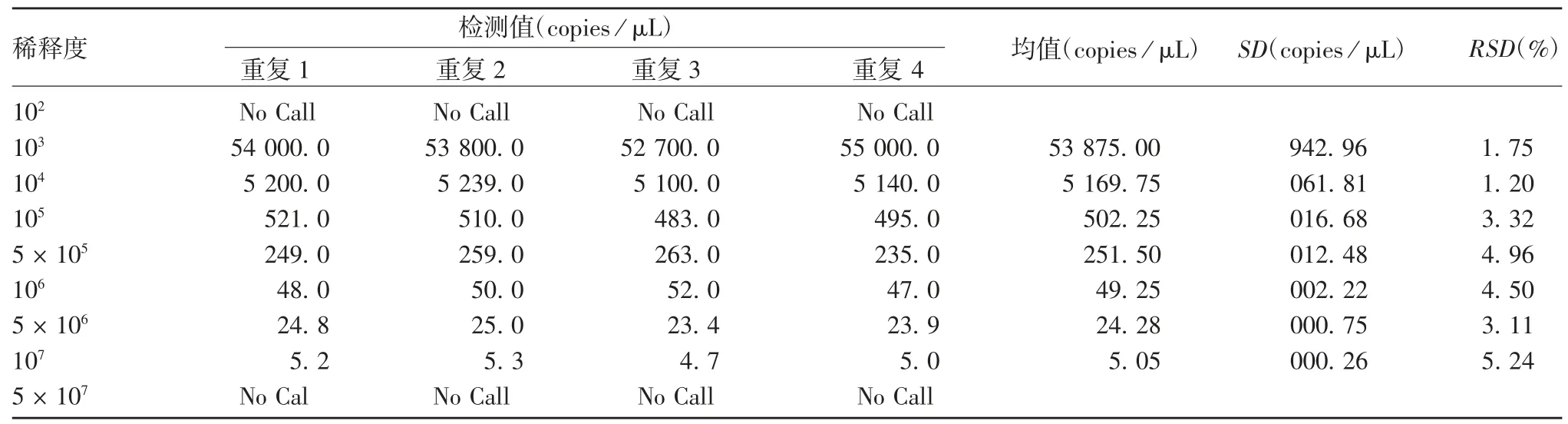
表1 A 群RV RT-ddPCR 检测法的灵敏性和重复性验证结果Tab.1 Verification for reproducibility and sensitivity of RT-ddPCR for detection of group A RV

表2 A 群RV RT-qPCR 检测法的灵敏性和重复性验证结果Tab.2 Verification for reproducibility and sensitivity of RT-qPCR for detection of group A RV
2.3 方法的初步应用 RT-ddPCR 和RT-qPCR 法检测150 份腹泻患儿的粪便样本,98 份为RV 阳性,52 份阴性,与胶体金检测结果一致,两种方法的符合率100%。表明RT-ddPCR 法可用于RV 的临床快速检测。
3 讨 论
VP6、VP7 及NSP3 基因序列是目前用来建立PCR 检测方法常用的靶标[16-17],VP6 基因序列保守,但也有突变的发生。NSP3 体系建立的引物与探针对于某些物种RV(如鼠)NSP3 基因序列一致性较低[17]。MAES 等[18]研究表明,A 组 RV 中,H 基因型的 NSP5基因序列在不同物种的RV 中同源性(>91%)高于其他基因分型。曾渊君等[17]研究比较了常见RV 不同基因型的NSP5 基因序列,其一致性高于NSP3,达83.70%,表明NSP5 相对于NSP3 更为保守,可成为建立A 组RV 检测体系中理想靶标。因此本研究基于A 组RV NSP5 基因序列设计了1 组引物和探针,建立了RT-ddPCR 检测方法,检测引起儿童腹泻相关病毒,包括 NoV、AdV、RV、HAstV 及 SaV,结果表明,该组引物及探针具有较强的特异性(100%)。RT-ddPCR是PCR 技术中的一种,将20 μL 的模板采用油包水的方式分割成20 000 个小液滴,每个小液滴在PCR中反应后,逐一通过检测器,根据阳性与阴性微滴的比例可直接计算目标分子的拷贝数,从而实现对目标分子的绝对定量[19-20]。相对 RT-qPCR 法,RT-ddPCR法无需核酸标准品,也不需建立标准曲线,可直接绝对定量,同时又具有RT-qPCR 的优点。CAVE等[21]在检测 RT-ddPCR 和 RT-qPCR 的灵敏度时发现,RT-ddPCR 灵敏度是 RT-qPCR 的 100 倍,检测限可达 2.45 copies / μL。但 RT-ddPCR 检测上限不如RT-qPCR 可靠,需要对高浓度的目标分子稀释到一定拷贝数以下[22]。这是由于两种检测方式对荧光信号的阅读过程不同造成的,RT-ddPCR 是对反应终点的微滴中荧光信号进行阅读,而RT-qPCR 是实时检测荧光信号的变化,两种检测方法原理相同。
本研究对RT-ddPCR 的退火温度及探针、引物浓度进行了优化,结果表明,最适退火温度为61.0 ℃,最佳引物及探针浓度分别为100 和60 nmol / L。本研究方法验证结果表明,RNA 核算标准物质理论拷贝数过大(490 000 copies /μL)时,RT-ddPCR 法无法检出,但 RT-qPCR 可检出;当拷贝数为 4.9 copies / μL时,两种方法均可检出,理论值与检测值基本保持一致。RT-ddPCR 及RT-qPCR 法分别在4.95~49 000即 4.95 ~ 490 000 copies / μL 范围内,与检测值呈良好的线性关系,线性方程分别为y= 1.100 0x-44.257 0 和y=0.185 4x-0.112 2,R2分别为 1.000 0和0.997 2。RT-ddPCR 的线性相关系数比RT-qPCR略优,但RSD比RT-qPCR 略高,表明其重复性比RT-qPCR 略差。ZHAO 等[23]通过 RT-ddPCR 和 RT-qPCR法检测副痘病毒的结果与本研究基本一致。YANG等[24]对 RT-ddPCR 和 RT-qPCR 检测性能进行研究,结果表明,RT-ddPCR 在检测灵敏度和准确率方面略高于RT-qPCR 法,而稳定性和重复性比RT-qPCR法略差,两种方法采用不同的引物和探针,可影响研究结果。另有研究表明,在检测艾滋病病毒时,RT-qPCR 的线性关系、灵敏度和准确性均优于RT-ddPCR 法[25]。采用 RT-ddPCR 和 RT-qPCR 法检测150 份腹泻患儿的粪便样本中,98 份为RV 阳性,52份阴性,与胶体金检测结果一致,两种方法的符合率100%。
综上所述,本研究建立并优化了RV 的RT-ddPCR检测方法,该方法具有良好的特异性及精密性,与RT-qPCR 法符合率为100%,可用于RV 的临床快速检测。
