色氨酸代谢与肾脏疾病互作研究进展
2021-10-20谭蓓张尊建许风国张培
谭蓓,张尊建,许风国,张培
(中国药科大学药物质量与安全预警教育部重点实验室,江苏 南京 210009)
肾脏疾病为最常见的疾病之一,据统计世界范围内患有肾脏疾病的总人数超过8.5亿[1]。急性肾损伤(AKI)、慢性肾病(CKD)与肾癌(RCC)是临床上典型的肾脏疾病,其中CKD以其低知晓率、高发病率和高死亡率被称为“沉默的杀手”。一份基于多国的研究分析显示,AKI合并发病率高达21.6%,死亡率为23.9%[2]。CKD全球发病率为8%~16%,并成为第十二大死亡原因[3]。除发病率高外,AKI和CKD均易诱发心血管疾病等并发症,治疗延误将导致损伤加剧而向终末期肾病(ESRD)转化[4]。RCC是常见的肾脏实质恶性肿瘤,其发病率在肿瘤中排第9位,约占常见癌症新发病例的2.2%[5]。由于对放疗和化疗响应均较差,RCC的治疗难题目前尚未攻克[6]。AKI、CKD及RCC发病机制复杂且易诱发多种并发症而造成全身性损伤,目前临床缺乏安全有效的干预手段。近年来,代谢组学与蛋白质组学研究发现,色氨酸代谢与肾脏疾病关系密切[7]。以色氨酸代谢物(如硫酸吲哚酚、烟酰胺腺嘌呤二核苷酸等)或关键代谢酶(吲哚胺-2,3-双加氧酶等)为靶点的治疗AKI、CKD及RCC的药物正处于临床前或临床研究阶段。本文对色氨酸代谢与肾脏疾病的互作关系进行综述,系统总结了AKI、CKD与RCC中色氨酸代谢物及代谢酶的变化规律,阐释了色氨酸代谢通路失调介导肾脏疾病恶化的机制,分析了靶向色氨酸代谢的肾脏疾病干预手段和潜在治疗策略。
1 色氨酸代谢概述
色氨酸(Trp)是一种饮食来源的必需氨基酸,在维持细胞生长及协调机体对环境的应答等生理过程中发挥关键作用[8]。体内游离的Trp主要有3条代谢途径(见图1):①吲哚途径[9],Trp在肠道菌群的作用下直接代谢为吲哚及吲哚衍生物,包括吲哚-3-乙酸(IAA)、吲哚-3-乳酸(ILA)、吲哚丙烯酸(IA)、吲哚-3-甲醛(IAld)、色胺(Trpm)、硫酸吲哚酚(IS)等,吲哚途径代谢物在维持肠道稳态、调节肠道免疫等方面发挥重要作用[10];②血清素途径(5-羟色胺途径)[10],Trp在人体肠嗜铬细胞处被色氨酸羟化酶1(TPH1)催化生成外周5-羟色胺(5-HT)参与胃肠道功能的调节。此外,脑内TPH2催化Trp生成神经递质5-HT,进一步转化为褪黑素等代谢物参与昼夜节律调控[11];③犬尿氨酸途径[12],95%以上游离Trp经该途径进行代谢,Trp在吲哚胺-2,3-双加氧酶(IDO1、IDO2)和色氨酸-2,3-双加氧酶(TDO)3种限速酶的作用下代谢为N-甲酰基尿氨酸(NFK),随后经甲酰氨酶催化生成犬尿氨酸(KYN)及下游代谢产物犬尿喹啉酸(KA)、3-羟基犬尿氨酸(3-HK)、3-羟基邻氨基苯甲酸(HAA)、喹啉酸(QA)和烟酰胺腺嘌呤二核苷酸(NAD+)等。

图1 色氨酸体内代谢途径 注:3-HK,3-羟基犬尿氨酸;5-HT,5-羟色胺;5-HTP,5-羟基色氨酸;6-HMT,6-羟基褪黑素;AA,邻氨基苯甲酸;HAA,3-羟基邻氨基苯甲酸;IA,吲哚丙烯酸;IAA,吲哚-3-乙酸;IAAId,吲哚-3-乙醛;IAId,吲哚-3-甲醛;IAM,吲哚-3-乙酰胺;IE,色醇;ILA,吲哚-3-乳酸;Indole,吲哚;Indoxyl,羟基吲哚;IPA,吲哚-3-丙酸;IPYA,吲哚-3-丙酮酸;IS,硫酸吲哚酚;KA,犬尿喹啉酸;KYN,犬尿氨酸;MIAA,5-甲氧基吲哚乙酸酯;MLT,褪黑素;NAD+,烟酰胺腺嘌呤二核苷酸;NAS,N-乙酰5-羟色胺;OAA,2-氧代己二酸;PA,吡啶甲酸;QA,喹啉酸;Skatole,粪臭素;Trpm,色胺;XA,黄尿酸
核受体和IDO介导了Trp及其代谢物生物学功能的发挥。芳香烃受体(AHR)和孕烷X受体(PXR)是两个主要的核受体,两者均为配体激活的转录因子[13]。经吲哚途径及犬尿氨酸途径产生的吲哚、KYN、IAA、IA、ILA、IAId等代谢物[14]可通过激活AHR发挥增强肠道屏障、刺激胃肠道运动、激活免疫系统、抗炎及抗氧化等生理作用[15-17]。吲哚-3-丙酸(IPA)与吲哚可通过作用于PXR调节肠屏障功能,在内源性、外源性毒素的清除及肠道稳态维持中具有关键作用[18]。IDO是犬尿氨酸途径关键代谢酶[19],可通过耗竭Trp并促进KYN的生成而在免疫调节中发挥重要作用。
近年来的研究揭示,色氨酸代谢物与炎症性肠病、抑郁症、自身免疫性疾病、神经退行性疾病以及癌症等[15]多种疾病的发生发展密切相关。此外,色氨酸代谢与肾脏疾病的关系亦逐渐被关注,以色氨酸代谢为靶点的干预手段成为肾脏疾病研究的热点。
2 肾脏疾病引起色氨酸代谢紊乱
2.1 急性肾损伤(AKI) AKI指由缺血再灌注[20]、肾毒性药物[21]、内源性毒素[22]、败血症[23]等因素导致短时间内肾小球滤过率(eGFR)迅速下降,引发肾功能障碍和肾脏病理学改变的临床综合征[24]。据统计,住院患者中AKI的发生率达10%~15%,其中重症监护室患者AKI发生率超过50%[25]。除发生率高外,AKI还导致患者住院时间延长、死亡率增加。此外,AKI还会增加心血管疾病(CVD)、高血压、CKD和ESRD的发生风险[26]。
代谢组学研究结果表明,不同诱发因素导致的AKI均伴随色氨酸代谢紊乱[27-28]。色氨酸及其代谢物可作为AKI预测或分级的潜在标志物[29]。一项前瞻性观察分析对92例重症AKI患者尿液色氨酸代谢物水平进行评估,发现KA含量的升高与患者肾损程度和临床疗效相关。结果提示,KA可作为AKI早期风险分级的指标[30]。另一项基于肾移植后AKI患者血清氨基酸靶向分析研究揭示,Trp和对二甲基精氨酸水平降低是AKI潜在风险预测因子。基于这两个代谢物建立的预测模型,其敏感性和特异性均优于肌酐[31]。此外,研究还发现烟酸受体激动剂SCH 900424诱导小鼠AKI后,Trp及代谢物KYN、IAA和IS均出现显著改变,IS作为肾毒性标志物较肌酐或尿素氮更为敏感[32]。
AKI诱导色氨酸代谢紊乱后,失调的代谢物或代谢酶还可进一步加剧AKI的进程。有研究表明,顺铂暴露后肾脏中异常蓄积的IS通过IS-AHR-ROS轴增加组织氧化应激水平而诱导肾损伤的恶化。IS作为配体与AHR形成复合物,易位至细胞核与特定的DNA序列结合后激活相关基因的表达、增加活性氧(ROS)的产生,从而加剧细胞凋亡和组织损伤[33]。除代谢物外,犬尿氨酸途径代谢酶KMO同样介导AKI损伤。近期一项遗传分析发现,糖尿病环境中小鼠肾小球KMO表达降低,提示KMO与肾脏功能存在关联[34]。此外,与野生型小鼠相比,Kmo(编码代谢酶KMO的基因)基因敲除小鼠缺血再灌注后肾脏损伤较轻,提示KMO是肾组织损伤的关键调节因子[35]。
近期Song等[36]基于代谢组学探究黄芪甲苷Ⅳ缓解顺铂AKI的潜在机制,结果发现黄芪甲苷IV可显著回调色氨酸、谷胱甘肽与苯丙氨酸等代谢途径,肾损伤的缓解与炎症反应、氧化应激和能量代谢的改善相关。此外,另一项研究证实山柰酚[37]可通过回调色氨酸代谢、降低氧化应激水平而发挥缓解顺铂AKI的作用。
2.2 慢性肾病(CKD) CKD是继发于肾脏功能和结构改变的临床综合征,临床上患者eGFR每1.73 m2低于60 mL·min-1或肾脏结构及功能异常持续时间超过3个月则被确诊患CKD[38-39]。CKD的主要诱因包括糖尿病、高血压、自身免疫性疾病与长期急性肾损伤等[39]。据统计,2017年全球CKD患者达6.975亿,中国患病人数超1.3亿(发病率9.5%)[40]。随着CKD的进展和肾功能的减弱,无法排泄的代谢物以尿毒症毒素的形式蓄积并进一步诱导全身性损伤[41]。研究揭示,CKD会增加CVD与ESRD的死亡风险[42]。
CKD患者常表现出色氨酸代谢失调,其对色氨酸代谢的影响主要包括:①肾脏有复杂的酶系统参与犬尿氨酸途径,CKD可诱导代谢酶活性的改变从而扰动代谢。文献报道CKD患者血清Trp含量急剧下降[43],而KYN与Trp的比值显著升高,提示犬尿氨酸途径中关键酶IDO活性出现上调[44]。一项7年的随访研究发现,KYN/Trp与受试者每年eGFR的变化及CKD的发病率显著相关,并可用于肾功能下降的预测[45]。此外,有研究证实代谢酶IDO活性在CKD中显著增强且与疾病严重程度成正相关[46]。IDO酶活性的上调归因于干扰素IFN-γ水平的显著上升,除诱导IDO表达外,IFN-γ的升高还会影响下丘脑-垂体-肾上腺轴进而增强肾脏中TDO活性[46]。肾脏IDO、TDO的高表达加速Trp的分解代谢并导致色氨酸代谢物含量的升高。②色氨酸代谢物KYN、KA、3-HK、QA和IS等主要通过肾脏进行排泄[47],肾功能障碍将导致此类代谢物的进一步蓄积。研究发现CKD患者血清KYN、KA、QA和IS的含量显著上升,蓄积的IS与体内其它代谢物所构建的多元回归方程能准确预测CKD的分期[48]。此外,多项临床随访研究将IS定为CKD疾病进程及合并心血管事件的预后标志物[49]。
CKD引起的色氨酸代谢通路中代谢物或代谢酶的改变可激活AHR导致进行性肾小球和肾小管细胞损伤,从而引起肾小球硬化和肾间质纤维化并加重疾病进程[50]。具体机制包括:①色氨酸尿毒症毒素激活AHR可诱导氧化应激和炎症。IS与IAA均可通过激活AHR上调CYP1A1和CYP1B1的mRNA水平,CYP1A1代谢内源性和外源性物质时产生ROS,进一步激活NF-κB诱导促炎因子的表达从而加重CKD的慢性炎症环境[51-52]。此外,IAA还可通过激活AHR-p38MAPK-NF-κB通路并上调环氧合酶2(COX-2)的活性与表达,诱导氧化应激和炎症从而增加CKD患者的CVD发病风险。②色氨酸尿毒症毒素激活AHR可直接导致细胞毒性。据报道,持续八周暴露于IS的小鼠表现出了进行性肾小球损伤和血管损伤,此外,IS诱导AHR核易位后将直接降低小鼠肾脏足细胞的细胞大小和活力[53]。另一项研究发现,尿毒症小鼠中蓄积的IS可通过抑制HIF-白介素10-血管内皮生长因子信号通路以破坏内皮细胞的功能,抑制CKD中新生血管的形成而介导外周动脉疾病[54]。③色氨酸尿毒症毒素激活AHR介导免疫反应进而影响肾纤维化。ILA可通过AHR抑制炎症性T细胞并诱导调节性T细胞(Treg)的分化而参与免疫应答[55]。此外,CKD患者中IS可激活AHR诱导细胞因子信号转导抑制因子2(SOCS2)的表达,进一步通过NF-κB对巨噬细胞进行调节,增加巨噬细胞中TNF-α的产生而触发炎症[56]。综上,蓄积的色氨酸代谢物作为AHR配体,通过介导肾纤维化而加剧CKD的进程[57]。
2.3 肾癌(RCC) RCC是泌尿系统第二高发恶性肿瘤,占成人恶性肿瘤的5%[58]。RCC是一种代谢性疾病,主要特征为参与代谢途径的靶基因发生突变。蛋白质组学和代谢组学研究揭示,RCC代谢重编程涵盖了有氧糖酵解、色氨酸、谷氨酰胺、精氨酸和脂肪酸代谢[59],其中色氨酸分解代谢与免疫抑制相关并在RCC中发挥重要作用[60]。
在RCC的发展过程中色氨酸代谢犬尿氨酸途径被高度激活,而血清素途径及吲哚途径代谢酶的表达量却有所降低[61]。RCC发生后,肿瘤部位的炎症和组织损伤导致多种促炎细胞因子(如TNF-α)的释放,进而诱导犬尿氨酸途径限速酶IDO1蛋白水平的改变。IDO1不仅在肾实质细胞中升高,还在肿瘤微环境、CD68+单核巨噬细胞中过表达[62]。RCC通过上调IDO,加速犬尿氨酸途径的代谢而导致下游色氨酸代谢物的积累。据报道RCC血清及组织中Trp水平显著降低,下游代谢物KYN和QA等显著增加[61]。代谢组学研究证实,犬尿氨酸代谢途径的紊乱与RCC的发展进程存在相关性,肾组织Trp和KYN、尿液KYN和QA等均是潜在的RCC早期诊断或风险评估生物标志物[63-64]。
RCC引发的色氨酸代谢重编程同样参与RCC的发展进程。高表达的IDO1增加RCC的化疗耐受性[63]并催化Trp向免疫抑制代谢物KYN进行转化,进而参与免疫耐受和肿瘤免疫逃逸过程[65]。据报道,肿瘤内皮细胞内IDO1的mRNA及蛋白水平均高于正常组织[66],激活的IDO1导致KYN积累,进而抑制T细胞的增殖、诱导细胞毒性T细胞无应答、下调NK细胞的免疫反应并激活Treg[63]。肿瘤微环境中Trp的降低同样介导RCC的免疫逃逸。T细胞活化需Trp参与,RCC患者中Trp的过度消耗将促进炎性浸润并抑制T细胞增殖[67],肿瘤杀伤性CD8+T细胞数量的减少使RCC逃避机体的免疫监视[68]。
3 靶向干预色氨酸代谢在肾脏疾病治疗中的应用
肾脏疾病与色氨酸代谢存在互作关系,疾病扰动色氨酸代谢,失调的代谢物或代谢酶进一步加剧疾病的进程,故靶向干预色氨酸代谢可一定程度缓解肾脏疾病(见表1)。色氨酸在肠道菌群的作用下生成吲哚,吲哚经门静脉进入肝脏后,在CYP2E1或CYP2A6的催化下生成3-羟基吲哚,之后经SULT1A1的磺酸化产生IS[69]。IS为有机阴离子尿毒症毒素,90%以上的IS与白蛋白非共价结合,难以通过透析进行清除[70]。健康状态下IS经肾脏排泄,当肾功能不全时则出现蓄积。蓄积的IS通过促进氧化应激与炎症反应诱导肾间质纤维化和肾小球硬化进而产生肾脏损伤[71],因此可通过减少IS的积累来缓解AKI或CKD。研究显示,靶向肠道菌群减少前体吲哚的生成[71]或采用吸附剂AST-120减少肠道内吲哚的含量[72]可减少IS体内蓄积。此外,有研究者通过槲皮素干预IS生成关键酶SULT1A1来缓解肾脏损伤[73]。
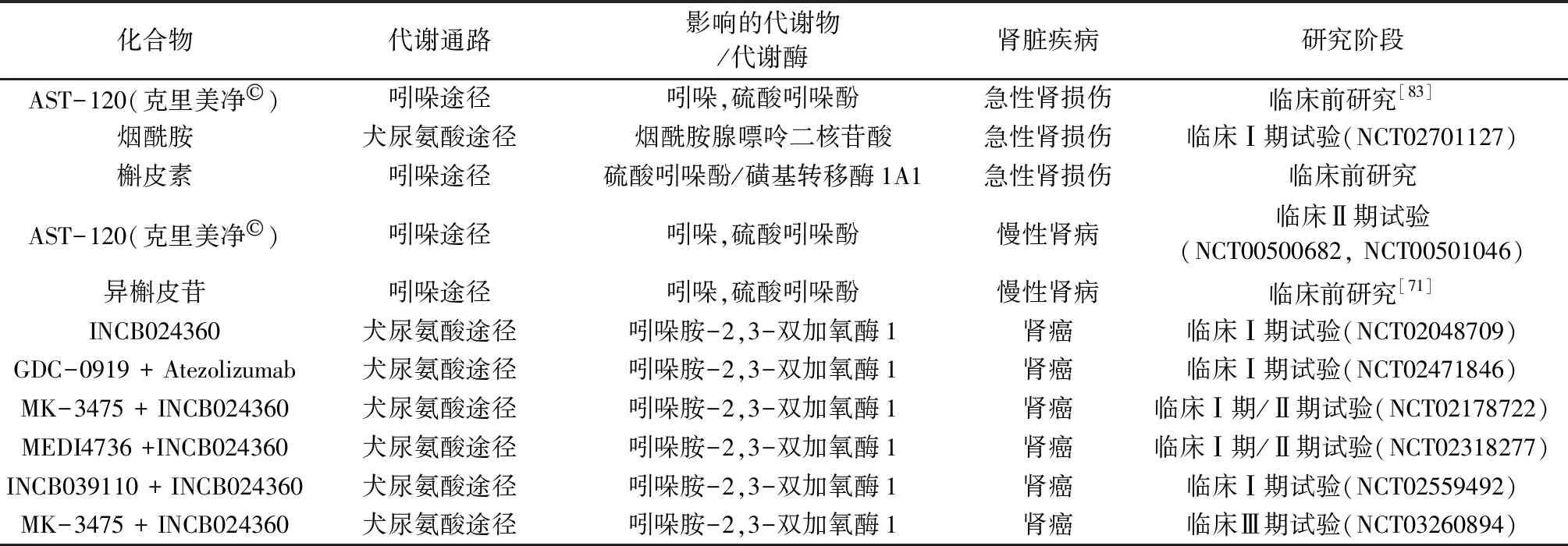
表1 靶向干预色氨酸代谢缓解肾脏疾病
AHR是一种涉及多个细胞过程的胞质配体激活的转录因子,AHR与配体结合后异位至细胞核内,与芳香烃受体核转运体组合成异二聚体,之后与特定的DNA序列结合并激活靶基因的表达[74]。多氯联苯和二噁英为AHR的高亲和力外源性配体[75],以KYN、IS、IAA等为代表的色氨酸代谢物为AHR典型内源性配体。研究证实色氨酸代谢物激活AHR诱导氧化应激和炎症,通过加剧肾细胞凋亡和组织损伤介导肾脏疾病的发病机制,这种作用在CKD中更为突出[57]。由于不同的AHR配体可双向调节下游靶基因的表达而影响多种疾病的进展[76],故通过寻找潜在的AHR拮抗剂有助于抑制AHR信号传导,从而缓解肾脏损伤。天然产物是新药发现的重要来源并证实可作为抑制肾纤维化和改善CKD的替代疗法[77-78]。有研究表明在5/6肾切除CKD大鼠模型中,黄酮类化合物barleriside A可通过抑制AHR信号缓解肾纤维化并改善CKD[79]。此外,饮食来源的黄芩素、芹菜素、大豆黄酮、染料木素、槲皮素和高良姜素等黄酮类化合物被认为是天然的AHR配体[80],天然产物作为AHR拮抗剂在肾病治疗中的潜在作用值得进一步关注,AHR有望成为肾脏疾病的治疗靶点。
IDO是Trp代谢为KYN的关键限速酶[19],在机体组织及各种细胞中广泛表达并在免疫调节中发挥重要作用。IDO参与了抑郁症、自身免疫性疾病、神经退行性疾病与癌症的发生发展[15]。IDO活性的上调同样介导CKD与RCC的疾病进程。CKD中上调的IDO加速色氨酸尿毒症毒素的蓄积并加剧肾脏纤维化。RCC中高表达的IDO可通过耗竭Trp并催化其向免疫抑制代谢物KYN进行转化而介导肿瘤免疫逃逸[63,65]。有研究表明,小鼠RCC模型中抑制IDO可激活T细胞参与免疫反应[66]。此外,选择性IDO抑制剂epacadostat (INCB024360)可增强肿瘤抗原特异性T细胞的裂解能力[81]。基于以上分析,抑制IDO具有潜在的逆转免疫抑制的效果,进而利于RCC的临床治疗。目前临床研究已评估IDO抑制剂epacadostat在RCC患者中的疗效(NCT02048709)。此外,对epacadostat与免疫检查点抑制剂的组合疗效也进行了评价(NCT02178722、NCT02318277),二者表现出恢复肿瘤免疫应答的协同作用。然而,近期一项Ⅲ期临床试验将IDO抑制剂epacadostat与单抗pembrolizumab (MK-3475)联合使用后却观察到一些阴性结果[82],提示靶向IDO以缓解RCC仍存在不小的挑战。
4 结语与展望
近年来肾脏疾病与色氨酸代谢的互作关系备受关注,本文以典型性肾脏疾病AKI、CKD与RCC为代表,系统阐述了肾脏疾病与色氨酸代谢的内在关系。肾脏疾病导致色氨酸代谢紊乱,失调的代谢物及代谢酶进一步通过AHR信号或经IDO介导免疫应答加剧肾脏疾病的恶化。虽然已有10余个干预IS、IDO、SULT1A1缓解肾损伤的药物进入临床Ⅰ~Ⅲ期试验,但靶向色氨酸代谢治疗肾脏疾病仍面临一定挑战,值得深入研究。
