miR-542-3p对脂多糖诱导的人支气管上皮细胞增殖和迁移的影响及机制研究
2021-10-19石晓岚刘翠翠马彩铃
石晓岚,赵 龙,王 宁,刘翠翠,王 静,马彩铃
(西安市儿童医院呼吸哮喘中心,陕西 西安710002)
我国哮喘患者大约在3000万,且一半以上的哮喘患者在儿童期发病[1]。儿童哮喘如未得到及时治疗,可能会出现喘息、咳嗽等症状,严重影响其生活质量,甚至威胁其生命。因此,阐明哮喘的发病机制,开发新的治疗靶点具有重要意义。近年来,非编码RNA的作用已成为一个重要的研究领域,其中,微小核醣核酸(microRNAs,miRNAs)通过结合保守的种子序列来靶向信使RNA(mRNA)转录,进而调节多种不同的疾病,如哮喘、肺病和癌症[2-6]。据报道,miR-542-3p的过表达能抑制反式-7,8-二羟-9,10-环氧苯并芘[anti-benzo(a)pyrene-7,8-diol-9,10-epoxide,anti-BPDE]诱导人支气管上皮细胞16HBE-T的增殖和迁移[7]。但miR-542-3p在儿童哮喘中的作用及分子机制尚不明确。本研究发现miR-542-3p通过IL-33/sST2信号通路来抑制脂多糖(Lipopolysaccharide,LPS)处理的BEAS-2B细胞的增殖和迁移,为研究治疗儿童哮喘的新方法提供理论基础。
1 材料与方法
1.1 实验材料 MEM培养基(Gibco公司,美国);脂质体RNAiMAX(Invitrogen,美国);Trizol试剂(Invitrogen,美国);TaqMan逆转录试剂盒(Takara Bio,日本);microRNA反转录试剂盒(Applied Biosystems,美国);SYBR Fast qPCR Mix(Takara Bio,日本);内参U6(广州锐博生物科技公司);酶活性测定试剂盒(Promega公司,美国);CCK8(同仁公司,日本);SDS-PAGE凝胶配制试剂盒P0012A(上海碧云天公司);5920R低温高速离心机(Eppendorf公司,德国);酶标仪(TZCAN公司,奥地利)。
1.2 研究方法
1.2.1 细胞培养及转染:将人支气管上皮细胞系BEAS-2B培养在含10%(V/V)胎牛血清的MEM培养基,置于含5%CO2(V/V)的37 ℃培养箱中。LPS(0.1、1、10、100 μg/ml)处理BEAS-2B细胞24 h构建哮喘模型。等体积DMSD处理BEAS-2B细胞作为未处理组(Untreated)。将密度为2×105的BEAS-2B细胞接种至6孔板上,待细胞融合度为80%时,用脂质体RNAiMAX转染mimic NC、inhibitor NC、miR-542-3p+pcDNA3.1至BEAS-2B作为空载组。转染miR-542-3p mimic(miR-542-3p)、miR-542-3p-inhibitor,miR-542-3p+pcDNA3.1-IL-33至BEAS-2B作为实验组。
1.2.2 实时荧光定量PCR(Quantitative real time polymerase chain reaction,qRT-PCR)检测miR-542-3p、白细胞介素33(IL-33)、可溶性生长刺激表达基因2蛋白(sST2)mRNA的表达:Trizol试剂提取总RNA,TaqMan逆转录试剂盒或microRNA反转录试剂盒将RNA反转录为cDNA。按照SYBR Fast qPCR Mix试剂盒的说明对LPS诱导的BEAS-2B中的miR-542-3p、IL-33、sST2进行PCR定量检测,所需引物由Premier 6.0设计,并由北京擎科新业生物合成。以U6为miR-542-3p内参,甘油醛-3-磷酸脱氢酶(GAPDH)为IL-33和sST2内参,用2-ΔΔCt法计算其mRNA表达量。
1.2.3 双荧光素酶报告基因检测miR-542-3p和IL-33的靶向关系:利用生物信息学分析网站microRNA.org(http://www.microrna.org/microrna/getMirnaForm.do)预测IL-33上游的miRNA,并利用双荧光素酶报告系统对基因进行验证。根据酶活性测定试剂盒的说明,用PBS洗涤96孔板,然后向每个孔中加入100 μl的磷脂溶液,低速振荡15 min后收集细胞裂解缓冲液。取20 μl细胞裂解100 μl荧光素酶检测试剂II混合,用光度计测定荧光素酶活性值。然后加入100 μl的1×Stop & Glo溶液,均匀混合,测定海肾荧光素酶的活性值,报告基因的表达量是萤火虫荧光素酶和海肾荧光素酶的比值。
1.2.4 CCK-8法检测细胞增殖能力:将mimic NC、miR-542-3p、miR-542-3p+pcDNA3.1、miR-542-3p+pcDNA3.1-IL-33组细胞分别接种在96孔板,采用CCK8法分析细胞增殖情况。孵育24、48、72、96 h后,每孔加入10 μl CCK8溶液。再孵育2 h后,用酶标仪测定450 nm处的OD值,每组重复3次。
1.2.5 划痕法检测细胞迁移能力:将mimicNC、miR-542-3p、miR-542-3p+pcDNA3.1,miR-542-3p+pcDNA3.1-IL-33组细胞分别接种在96孔板,采用划痕法分析细胞迁移能力。转染48 h后,将细胞接种至6孔板中孵育(5×104个细胞/孔)。待细胞融合至90%~95%后,用无菌塑料微管尖端刮除单层细胞,孵育24 h。几次清洗后,用X71倒置显微镜观察伤口愈合情况并拍照(奥林巴斯公司)。
1.2.6 免疫印迹分析检测蛋白表达:将转染成功mimic NC、miR-542-3p、inhibitor NC、miR-542-3p inhibitor的细胞在冰裂解液中裂解30 min,4 ℃ 12000 r/min离心10 min,提取蛋白质。用10%(W/V)十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)将蛋白质溶解,并转移到PVDF膜上。于Tris缓冲盐水中,用5% (W/V)脱脂牛奶封闭PVDF膜,并与一抗(1∶1000)于4 ℃过夜孵育。用TBST清洗3次,每次5 min,然后用辣根过氧化氢酶标记的二级抗兔抗体检测细胞膜,增强型化学发光试剂盒对条带进行可视化。
1.3 统计学方法 采用SPSS 20.0统计学软件进行分析,单因素方差分析(AVONA)进行多组间比较,LSD法进行两两比较,以P<0.05为差异具有统计学意义。
2 结 果
2.1 miR-542-3p在LPS诱导的BEAS-2B中的表达 用浓度为0.1、1、10和100 μg/ml的LPS分别处理BEAS-2B细胞24 h后检验细胞活性,发现BEAS-2B细胞活性随着LPS浓度的增加呈递减趋势。因为BEAS-2B细胞活性在1 μg/ml LPS处理下活性显著下降,因此选用1 μg/ml LPS处理BEAS-2B细胞24 h构建哮喘细胞模型(图1A)。RT-PCR分析结果显示,LPS处理抑制miR-542-3p在BEAS-2B中的表达(图1B)。

注:与未处理组比较,*P<0.05
2.2 miR-542-3p对LPS诱导的BEAS-2B增殖和迁移的影响 分别将mimic NC,miR-542-3p转染至BEAS-2B,并进行1 μg/ml LPS处理24 h。miR-542-3p显著增加miR-542-3p表达,miR-542-3p inhibitor显著抑制miR-542-3p表达,证明转染成功(图2A)。CCK-8和划痕实验分析显示,过表达miR-542-3p可显著抑制LPS诱导的BEAS-2B细胞增殖和迁移,而miR-542-3p inhibitor显著促进LPS诱导的BEAS-2B细胞的增殖和迁移(图2B、C)。
2.3 miR-542-3p与IL-33的相互关系 qRT-PCR结果显示,经过1 μg/ml LPS处理24 h,BEAS-2B细胞中的IL-33和sST2的mRNA相对表达量均显著上调(图3A)。利用在线网站microRNA.org预测发现miR-542-3p具有与IL-33结合的位点(图3B)。我们将含有miR-542-3p预测结合位点或突变位点的IL-33-3’-UTR区域构建至荧光素酶载体中,结果显示miR-542-3p显著抑制野生型荧光素的酶活性,但不影响突变型荧光素的酶活性(图3C)。对miR-542-3p与IL-33进行Spearman相关性分析,结果显示在LPS诱导的BEAS-2B细胞中,miR-542-3p与IL-33表达呈负相关(图3D)。免疫印迹分析和RT-PCR结果显示,miR-542-3p可显著降低IL-33的mRNA及蛋白质相对表达量(图3E、F)。
2.4 miR-542-3p/IL-33/sST2对LPS诱导的BEAS-2B增殖和迁移的影响 分别将mimic NC、miR-542-3p、miR-542-3p+pcDNA3.1、miR-542-3p+pcDNA3.1-IL-33转染至BEAS-2B,1 μg/ml LPS处理24 h后,检测BEAS-2B细胞的增殖和迁移水平。结果显示,过表达IL-33可显著提高miR-542-3p抑制的BEAS-2B细胞的增殖和迁移能力(图4)。
3 讨 论
哮喘是由多种炎性介质或细胞因子导致的气道高反应慢性炎症,不仅会引起慢性炎症相关反应,还会出现咳嗽、鼻塞、胸闷等气道高敏性反应,若病情加重,甚至会造成不可逆的气道狭窄和气道重建[8]。根据第三次中国城市儿童哮喘流行病学调查,我国儿童的哮喘患病率正以每十年50%的幅度增加。但患儿的较差配合度和国内目前有限的诊断治疗技术使很多哮喘患儿没有及时接受正确有效的诊疗。因此对哮喘病理的研究和寻找治疗儿童哮喘的靶标分子非常重要。
miRNAs在各种体液(血液、尿液、痰、呼气冷凝液、血清和血浆)中非常稳定,因此对哮喘中miRNA功能的研究可能会使我们找到更多治疗儿童哮喘的方法[9-10]。miR-542-3p在非小细胞肺癌细胞[11]、肝细胞癌细胞[12]、卵巢癌细胞[13]中表达均下调。本研究通过对BEAS-2B进行LPS处理,发现miR-542-3p在哮喘细胞模型中的表达显著低于正常细胞。miR-542-3p抑制anti-BPDE诱导的16HBE-T细胞的增殖和迁移水平[14]。Liu等[11]研究发现,通过调控FTSJ2,miR-542-3p可以抑制肺癌细胞的增殖和迁移。王跃等[15]在多种人胃癌细胞和胃腺癌组织中均发现miR-542-3p呈低表达状态,且miR-542-3p可抑制胃腺癌细胞的侵袭转移能力。本研究发现miR-542-3p抑制LPS诱导的BEAS-2B的增殖和迁移,与已有文献中的研究结果相符。
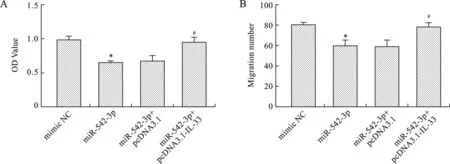
注:与mimic NC组比较,*P<0.05;与miR542-3p+pcDNA3.1-IL-33组比较,#P<0.05
IL-33(也称为IL-1F11或NF-HEV)是2005年新发现的哮喘启动因子,具有潜在的诊断及治疗价值[16]。IL-33通常与其特异性受体ST2结合形成复合物来发挥作用。在哮喘发展过程中,IL-33/ST2通过激活Th2型免疫反应,进而诱发哮喘等过敏性疾病的发生[17]。研究显示,重度支气管哮喘病人的支气管肺泡灌洗液中的IL-33、sST2的水平显著高于轻度支气管哮喘患者[18-19],阻断IL-33/sST2信号通路可缓解过敏性哮喘。本研究发现在LPS诱导的BEAS-2B细胞中,IL-33和sST2均显著高于未处理组,且miR-542-3p与IL-33表达呈负相关关系。IL-33的过表达会减弱miR-542-3p对LPS诱导的BEAS-2B细胞的增殖和迁移能力抑制作用,表明miR-542-3p可能通过靶向IL-33/sST2抑制LPS诱导的BEAS-2B细胞的增殖和迁移。
综上所述,本研究发现miR-542-3p在LPS诱导的BEAS-2B细胞中上调表达,并且通过靶向IL-33/sST2来抑制LPS诱导的BEAS-2B的增殖和迁移,表明miR-542-3p可能将成为新的儿童哮喘治疗靶点。
