芝麻素对低氧条件下鼠嗜铬细胞瘤细胞β淀粉样蛋白和β位淀粉样前体蛋白裂解酶-1表达影响的实验研究
2021-01-09朱俊艳陈筱山郭彦祥
朱俊艳,陈筱山,郭彦祥,王 磊
(1.西安市精神卫生中心精神科,陕西 西安 710061;2.西安市中心医院神经内科,陕西 西安 710003)
阿尔茨海默病(Alzheimer’s disease,AD)又被称为老年性痴呆,是近年来较为普遍的一种神经变性疾病,主要临床症状表现为:记忆力逐渐衰退,生活能力低下,同时还伴有其他认知功能与精神障碍等情况。通常病情进行性加重,在2~3年内丧失独立生活能力,10~20年左右因并发症而死亡,对患者的身体健康和生活质量造成严重的影响[1]。AD的主要病理改变包括:突触功能障碍、神经细胞外老年斑(Senile plaques,SPs)、细胞内Tau蛋白变性、神经原纤维缠结(Neuron fiber tangles,NFTs)、神经递质异常以及线粒体自噬功能障碍等[2]。β位淀粉样前体蛋白裂解酶-1(β-site APP cleaving enzyme 1,BACE-1)可通过裂解生成β淀粉样蛋白(Amyloid beta peptide,Aβ),而Aβ是老年斑的主要成分,其在异常沉积是AD发病的始动环节[3-4]。AD的发病可通过脑缺血或卒中而引起,一般情况下在细胞和动物模型中,由于其缺血或低氧可导致Aβ与BACE-1水平异常升高[5]。芝麻素(Sesamin)是从芝麻中提取的一种木脂素类化合物,是芝麻的主要活性物质。作为一种抗氧化剂,芝麻素具有保护肝脏、抗化学物质所致肿瘤、抗氧化应激和抗炎等作用[6]。芝麻素能减轻脑缺血和帕金森病模型所致的氧化应激和神经炎症损伤[7-8],但少见芝麻素对低氧条件下神经元Aβ和BACE-1表达的报道。PC12细胞即大鼠肾上腺嗜铬细胞瘤细胞株,该细胞株来自能移植的雄性大鼠肾上腺嗜铬细胞瘤,这些细胞能够表达神经生长因子[9]。本文探讨了芝麻素对低氧条件下PC12细胞Aβ和BACE-1的表达的影响,以明确芝麻素缓解脑损伤的作用效果与机制,现总结报告如下。
1 材料与方法
1.1 主要试剂与仪器 芝麻素由陕西省中医药研究院药理实验室提供。二甲基亚砜(DMSO)(博士德公司,武汉)。10%马血清,5%胎牛血清的RPMI-1640培养基,青、链霉素双抗(GIBCO公司,美国),Aβ1-42酶联免疫吸附(ELISA)试剂盒(USCN公司,武汉),BACE-1抗体(Abcam公司,美国),双气、三气细胞培养箱(Thermo Scitific公司,美国)。
1.2 细胞培养与分组 PC12细胞(重庆医科大学神经实验中心,购自中科院上海生物所)培养于RPMI-1640完全培养基中,于37 ℃、5%CO2条件下培养。取对数生长期的PC12细胞,随机分为正常氧组与低氧组、低氧加芝麻素0.5、5和50 μmol/L浓度干预组。正常氧组在37 ℃、5%CO2培养箱进行培养。低氧组、低氧加芝麻素0.5、5和50 μmol/L浓度干预组转移至37 ℃、1%O2、4%CO2、95%N2的三气低氧培养箱中进行培养,然后分别加入DMSO配制的芝麻素,使培养液芝麻素终浓度为0.5、5、50 μmol/L。
1.3 ELISA检测Aβ1-42 收集所有组别的培养液,经过离心后取其上清液,其余操作步骤严格按照ELISA说明书进行,首先配制出不同稀释浓度Aβ1-42标准品,设置标准孔、空白对照孔,样品孔,分别加入不同浓度的标准液和样品,各100 μl,覆膜加入100 μl的检测溶液A,进行孵育洗涤后再添加100 μl的检测溶液B,再次经过孵育、洗涤,然后将酶标板甩干,加入90 μl的底物溶液,将其覆膜后进行避光显色处理,测定OD450值,绘制标准曲线,计算Aβ1-42分泌值。
1.4 Western blot检测BACE-1蛋白 收集获得的PC12细胞,采用全蛋白提取试剂盒提取各组蛋白,BCA法测定蛋白浓度。每孔上样量为20 μg,进行SPS-PAGE电泳,然后将蛋白转印至PVDF膜上,利用5%的脱脂牛奶封闭1 h,加入BACE-1一抗(稀释比1∶5000),4 ℃条件下过夜:二抗37 ℃培养2 h;TBST洗涤,ECL发光,应用Bio-Rad凝胶图像成像系统采集图像,Quality One软件进行扫描分析。GAPDH作为内对照。每组实验重复3次。
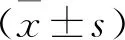
2 结 果
2.1 各组PC12细胞Aβ1-42表达水平比较 低氧组的Aβ1-42表达水平显著高于正常氧组(P<0.05);在不同浓度芝麻素(0.5、5和50 μmol/L)干预后,Aβ1-42表达水平显著下降(均P<0.05),且呈现浓度依赖性(均P<0.05)。见图1。
2.2 各组PC12细胞BACE-1蛋白表示水平对比 低氧组的BACE-1蛋白相对表达水平显著高于正常氧组(P<0.05);在不同浓度芝麻素(0.5、5和50 μmol/L)干预后,BACE-1蛋白相对表达水平显著下降(均P<0.05),且呈现浓度依赖性(均P<0.05)。见图2。
3 讨 论
AD是一个与增龄有关的、具有多病理生理特征的复杂疾病,包括以进行性脑神经元丢失和萎缩为特征的神经变性、脑细胞外β淀粉样蛋白聚集形成淀粉样斑块、脑神经元内Tau蛋白异常磷酸化和聚集形成“神经纤维纠缠结”、脑葡萄糖代谢下降、胶质细胞激活和神经炎症等。当前,AD已经成为严重威胁老年健康及生活质量的神经变性疾病,其也对患者自身、家庭以及社会产生了不可估量的伤害[10-11]。在65岁以上人群中,西方约有5%的人患有此病,85岁以上老年人患病率高达47%~50%,为欧美国家老年期痴呆的主要原因;日本的患病率低于西方,为4%;我国60岁以上人群AD的患病率为3%~5%。但目前对于AD发病的具体原因还不完全明确,除了只有1%的家族性AD可能会与遗传相关外,目前仍旧是世界性难题。约99%的AD患者为晚发、散发型痴呆,其影响因素包括糖尿病、高血脂、外伤、缺血等[12-14]。
AD与血管性痴呆在缺血性脑血管病、脑低氧环境下以及脑卒中老年患者等影响下的发病率会明显升高[15]。在脑卒中过程中,低氧损害主要是通过脑低灌注、呼吸暂停导致的,而低氧与Aβ聚集、Tau蛋白磷酸化、血脑屏障损伤、神经元变性等有关[16]。Aβ是细胞膜上的淀粉样前体蛋白的生成(Amyloid peptide precussor,APP),在AD发病中起到核心作用,该结果已被人们广泛认可,神经纤维缠结的形成、氧化和脂质过氧化、谷氨酸能兴奋性毒性反应、炎症和凋亡细胞死亡级联反应的激活,都被视为继发于Aβ生成和聚积的后果。Aβ肽聚集可形成神经毒性的原纤维,进而组成AD的病理特征之一,如老年斑等[17]。该物质主要由蛋白水解酶进行分泌,共分为两条代谢途径(α和β)。其中β代谢途径又称为淀粉样代谢途径,β分泌酶(β-secretase)可导致APP产生毒性作用,小分子的Aβ[18]。BACE-1主要是通过β分泌酶产生,也是Aβ生成过程中的一种限速酶。在AD时,BACE1活性增高,产生过多的Aβ,促进老年斑、Tau蛋白磷酸化等病理改变[19]。
有研究发现低氧通过β-分泌酶和γ-分泌酶的活性增加Aβ的生成,特别是SH-SY5Y细胞BACE-1的mRNA和蛋白水平增高[20]。还有研究显示在短暂性脑缺血、低氧条件下,实验大鼠的BACE1较对照鼠增加了67%[21]。本研究发现PC12细胞在低氧干预培养24 h,Aβ水平显著增高,裂解Aβ的BACE-1蛋白表达也相应增高,表明在低氧损伤时,Aβ水平、BACE-1表达水平上升可导致Aβ沉积明显提高,这与AD的进展及发病具有一定的相关性。
芝麻素作为芝麻的主要活性成分,是一种天然的木脂素类化合物,广泛存在与芝麻籽和芝麻油中,随着人们对芝麻素药理活性研究的不断深入,其药物作用之间被人们重视。研究发现,芝麻素不但具有相当高的营养价值,并且具有抗氧化、抗菌、保肝、调节血脂、稳定血压以及抑制肿瘤等多种生物学活性[22]。近些年,已有一些科研工作者对芝麻素在保护神经细胞缺血性损伤进行了实验研究。有学者研究显示芝麻素可发挥抗ROS的作用,保护低氧损伤的神经元和PC12细胞[23]。本实验设置0.5、5和50 μmol/L浓度芝麻素干预低氧条件培养的PC12细胞,发现芝麻素降低低氧条件下升高的Aβ1-42、BACE-1蛋白表达,且存在剂量依赖性。还有学者研究表明芝麻素改善可逆大脑中动脉栓塞动物模型鼠的行为损伤,进行体内和体外实验,进一步验证了芝麻素具有抗氧化应激和抗炎症的作用,保护缺血脑组织,降低低氧时PC12和BV-2细胞产生的ROS、细胞激酶和PGE2;同时也可减轻Aβ1-42诱导的细胞毒性物质对PC12细胞的损伤,增加PC12细胞活性和乙酰胆碱释放[24]。芝麻素通过抑制患者体内的信号通路,降低炎症因子的表达,增加谷胱甘肽和过氧化氢酶的活性,通过显著的抗氧化、抗炎症等作用减轻AD所造成的大脑损伤[25-26]。本研究也存在一定的不足,没有进行体内研究分析,且没有对多种细胞进行分析,因此对于本研究结论仍需要大量的实验进行验证,将在后续研究中继续进行探究。
总之,在低氧条件下,PC12细胞Aβ1-42、BACE-1蛋白表达升高,芝麻素降低低氧条件下升高的Aβ1-42,BACE-1表达,本文研究结果具有一定的科学性,为阿尔兹海默病的临床治疗提供一定的参考。
