甲状腺激素受体β基因对β淀粉样蛋白42诱导的小胶质细胞炎症和细胞凋亡作用机制
2021-10-19朱利娟曹冰清薛延莉
康 涛,朱利娟,曹冰清,薛延莉,杨 谦
(1.陕西省人民医院神经内科,陕西 西安710068;2陕西省人民医院麻醉科,陕西 西安710068)
阿尔兹海默症(Alzheimer’s disease,AD)是一种起病隐匿的进行性发展的神经系统退行性疾病[1]。临床上AD的特点是大量的淀粉样蛋白刺激神经元和突触,诱发神经炎症,最终导致记忆丧失。β淀粉样蛋白(Amyloid-β,Aβ)在大脑中的大量积累被认为是AD发展的重要标志,Aβ沉积在AD的发病机制中起着决定性的作用[2],靶向Aβ斑块的示踪剂已被用于影像学临床应用及研究[3]。
甲状腺激素受体β基因(Thrb)对神经发育起着重要的调控作用。同时,Thrb在听觉和视觉功能中起着重要作用,是影响脊椎动物神经系统发育的关键介质[4]。目前,关于Thrb对AD作用的研究报道较少,因此有必要对其在AD中的作用及作用机制进行进一步探究。
Sirt3(Sirtuin 3)是哺乳动物Sirtuin家族的成员,是一种依赖于NAD的组蛋白去乙酰化酶,主要存在于线粒体中[5-6]。有报道称,Sirt3通过调节靶蛋白(包括能量代谢介质和线粒体氧化还原应激蛋白)调节线粒体内稳态[7]。近年来,人们发现Sirt3在Aβ诱导的AD中起着重要作用[8]。Salvatori等[9]报道称,Sirt3的降低与AD患者的线粒体功能障碍有关,Sirt3的表达随着AD的进展而降低。本试验旨在探究Thrb对Aβ42诱导的小胶质细胞氧化应激和凋亡的作用以及作用机制,从而为临床上老年痴呆症的治疗提供新的理论基础。
1 材料与方法
1.1 实验材料 小胶质细胞BV2购自中国科学院昆明动物研究所;RPMI1640培养基、胎牛血清购自美国HyClone公司;Trizol、反转录试剂盒和实时荧光定量聚合酶链反应(quantitative Real time polymerase chain reaction,qRT-PCR)试剂盒购自美国Promega公司;BCA蛋白质定量检测试剂盒购自美国Thermo Fisher Scientific公司;兔抗鼠Thrb、兔抗鼠caspase-3、兔抗鼠caspase-9、兔抗鼠Sirt3、兔抗鼠FOX3a和鼠抗GAPDH购自美国Abcam公司;转染试剂LipofectamineTM3000购自美国Invitrogen公司;PCR引物、pcDNA3.1-Thrb、si-Sirt3和si-FOX3a由北京擎科生物科技有限公司设计、合成;二氧化碳培养箱购自上海力申科学仪器有限公司;PCR仪和iMark酶标仪购自美国BIO-RAD公司。
1.2 实验方法
1.2.1 细胞培养:小胶质细胞BV2用含有10%胎牛血清的DMEM细胞培养液,于37 ℃、5% CO2培养箱中培养。
1.2.2 细胞转染:pcDNA3.1-Thrb以及si-Sirt3和si-FOX3均由北京擎科生物科技有限公司设计、合成。根据Thrb的序列,设计合成PCR引物,扩增Thrb基因全长,连接于线性化的过表达载体pcDNA3.1(+)上,形成可表达Thrb的同源重组质粒(pcDNA3.1-Thrb)。将细胞分为未处理组(Untreated)、空白对照组(Control)、阴性对照组(pcDNA3.1)、Thrb过表达组(pcDNA3.1-Thrb)及si-Sirt3和si-FOX3a。按照Lipofectamine 3000®说明书将pcDNA3.1-Thrb及si-Sirt3和si-FOX3a按照以上分组转染至BV2细胞中,置于37 ℃、5% CO2条件下继续培养。孵育48 h后检测转染效率,实验设置3个重复。
1.2.3 细胞增殖:将BV2细胞以1×105个/孔的密度接种于96孔板中,于37 ℃、5% CO2培养箱中培养24 h;向培养板中加入不同浓度(5、10、20、40、80、160 μg/ml)的WST-8,于37 ℃、5%CO2培养箱中继续培养24 h;每孔加入20 μl CCK溶液,孵育24 h;酶标仪测定450 nm处的OD值。
1.2.4 细胞凋亡率的测定:对于细胞凋亡检测,收获转染pcDNA3.1-Thrb和对照质粒pcDNA3.1 48 h后的细胞,离心,并重悬于结合缓冲液中。然后,异硫氰酸荧光素(FITC)和PE-Texas Red溶液连续染色细胞,使用FACSCalibur TM流式细胞仪进行分析。
1.2.5 炎症因子的测定:按照相应的ELISA试剂盒说明检测BV2细胞中的一氧化氮(NO)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)的浓度。具体操作如下:准备试剂、样品;加入准备好的样品,37 ℃孵育30 min;洗板5次,加入酶标试剂,37 ℃孵育30 min;洗板5次,加入显色液A、B,37 ℃显色10 min;加入终止液,读OD值。
1.2.6 活性氧(ROS)的测定:将BV2细胞以1×105个/孔的密度接种于6孔板中,于37 ℃、5%CO2培养箱中培养24 h;收集细胞,在37 ℃下用活性氧指示剂DCFH-DA(10 μmd/L)在PBS中培养30 min。使用流式细胞仪(BD Biosciences,CA)分析荧光。
1.2.7 RT-PCR:将BV2细胞以1×105个/孔的密度接种于12孔板,培养24 h后吸去上清液,收集细胞, Trizol法提取胃癌细胞株总RNA,进行反转录合成cDNA。qRT-PCR检测Thrb基因的mRNA表达。引物序列如下,Thrb正向序列:5’-ACGTAACGCTACTGGGACGTT-3’,反向序列:5’-AGTTAGGACGTATACGACAGG-3’;β-actin正向序列:5’-CTCACCATGGATGATGATATCGC-3’,反向序列:5’-AGGAATCCTTCTGACCACTGC-3’。以2-ΔΔCt法计算基因相对表达量。β-actin为内参。
1.2.8 Western blot:消化对数生长期的BV2细胞,接种于25 cm2培养瓶中,细胞融合至80%~90%时进行细胞转染。48 h后收集各组细胞,收集细胞上清液,并消化下贴壁细胞,加RIPA裂解液于冰上裂解10 min,4 ℃、12000 r/min离心30 min(离心半径9.5 cm)。上清液用BCA蛋白质定量检测试剂盒测定蛋白含量后,取30 μg蛋白进行SDS-PAGE凝胶电泳,130 V恒压电泳2 h;湿转法将蛋白转移至PVDF膜上;室温下以含5%脱脂奶粉的Tris缓冲液粉笔PVDF膜1 h,裁剪后分别与一抗孵育,4 ℃过夜;TBST清洗膜8 min,重复4次,加相应的HRP标记的二抗,室温孵育2 h;TBST重复清洗膜4次,ECL试剂盒检测蛋白表达,以GAPDH作为内参。
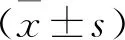
2 结 果
2.1 Aβ42显著抑制Thrb表达且具有剂量依赖性 RT-PCR和Western blot检测BV2细胞经不同浓度(50、100 ng/ml)的Aβ42诱导后Thrb的表达量。结果显示,BV2经Aβ42诱导后Thrb的mRNA和蛋白的表达量均显著降低,且呈剂量依赖性(均P<0.05,图1A﹑B)。

A:Thrb在Aβ42诱导后的BV2细胞中的mRNA表达量;B:Thrb在Aβ42诱导后的BV2细胞中的蛋白表达量。
2.2 过表达Thrb缓解Aβ42诱导小胶质细胞BV2的细胞凋亡 为了验证Thrb在小胶质细胞BV2中的功能,我们在BV2细胞中分别转染pcDNA3.1-Thrb和对照质粒pcDNA3.1,后经浓度为100 ng/ml的Aβ42处理。经Aβ42处理后,细胞活力显著降低,而转染pcDNA3.1-Thrb则显著提高细胞活力(均P<0.05,图2A);与Control组相比,pcDNA3.1-Thrb显著降低细胞凋亡率(P<0.05,图2B);同样的,pcDNA3.1-Thrb抑制了caspase-3和caspase-9的表达量(均P<0.05,图2C)。由此说明过表达Thrb缓解了Aβ42诱导的小胶质细胞BV2的细胞凋亡。

A:过表达Thrb对细胞活力的影响;B:过表达Thrb对细胞凋亡的影响;C:过表达Thrb对caspase-3和caspase-9表达量的影响。与 Untreated组比较,*P<0.05;与Control组比较,#P<0.05
2.3 过表达Thrb缓解Aβ42诱导小胶质细胞BV2的炎症和氧化应激 如图3所示,细胞经Aβ42处理后,促炎因子IL-6、TNF-α和NO的水平均显著升高,而pcDNA3.1-Thrb则显著降低上述促炎因子的水平(均P<0.05,图3A-C);此外,与Control组相比,pcDNA3.1-Thrb显著降低细胞中ROS的含量(P<0.05,图3D);pcDNA3.1-Thrb提高了细胞中NAD+和ATP的水平(均P<0.05,图3E、F)。由此说明过表达Thrb缓解了Aβ42诱导的小胶质细胞BV2的炎症反应和氧化应激。
2.4 过表达Thrb促进Sirt3和FOX3a表达及sh-Thrb抑制Sirt3和FOX3a的表达 如图4所示,过表达Thrb显著促进Sirt3和FOX3a的表达(均P<0.05,图4A);与此相反,当干扰Thrb的表达时,Sirt3和FOX3a的表达量均显著降低(P<0.05,图4B);此外,细胞经Aβ42诱导后Sirt3和FOX3a的蛋白表达水平显著降低(均P<0.05,图4C)。
2.5 Sirt3/FOX3a参与Thrb对Aβ42诱导细胞损伤的保护机制 为了进一步探究Thrb对小胶质细胞BV2作用的分子机制,我们在BV2细胞中分别转染sh-Sirt3或sh-FOX3a或pcDNA3.1-Thrb,检测不同处理组细胞中细胞凋亡和炎症因子以及ROS的含量。结果显示,sh-Sirt3或sh-FOX3a均显著抑制细胞活力(P<0.05,图5A);此外,sh-Sirt3或sh-FOX3a均促进细胞凋亡(P<0.05,图5B);进一步研究发现,sh-Sirt3或sh-FOX3a显著提高了细胞中IL-6的水平(均P<0.05,图5C);pcDNA3.1-Thrb降低了细胞中自由ROS的含量。然而sh-Sirt3或sh-FOX3a提高了细胞中ROS的水平,逆转了pcDNA3.1-Thrb的抑制作用(均P<0.05,图5D)。以上结果说明Sirt3/FOX3a参与了Thrb对Aβ42诱导的细胞损伤的保护机制。

A:过表达Thrb对细胞中IL-6水平的影响;B:过表达Thrb对细胞中TNF-α水平的影响;C:过表达Thrb对细胞中NO水平的影响;D:过表达Thrb对细胞中ROS含量的影响;E:过表达Thrb对细胞中ATP水平的影响;F:过表达Thrb对细胞中NAD+水平的影响。与Untreated组比较,*P<0.05;与Control组比较,#P<0.05

A:过表达Thrb对Sirt3和FOX3a的表达量的影响;B:sh-Thrb对Sirt3和FOX3a表达量的影响;C:Aβ42诱导对Sirt3和FOX3a表达量的影响。与Control或Untreated组比较,*P<0.05;与pcDNA3.1或sh-RNA或50 ng/ml组比较,#P<0.05
3 讨 论
AD是最常见的老年病之一,占70岁以上老年痴呆发病率的60%~70%[10]。Aβ在脑内的积聚被认为是AD发生发展的一个重要事件[11]。Aβ是一种含有39~43个氨基酸的多肽,由分泌酶水解β淀粉样前体蛋白产生,最常见的亚型是Aβ40和Aβ42[12]。Aβ42毒性更强,易于聚集并引起神经毒性[13]。Aβ42的神经毒性作用在AD的进展中起重要作用[14]。据报道,大鼠或猴大脑皮质注射Aβ42后,注射部位出现组织坏死、外周神经细胞丢失、角蛋白增生,且与剂量呈显著相关性[15]。
Thrb在组织分化、生长发育、保持代谢平衡及调节甲状腺激素作用等方面具有重要作用[16]。此外,Thrb对神经发育起着重要的调控作用,是影响脊椎动物神经系统发育的关键介质[17]。Ng等[18]研究发现Thrb的缺失引起小鼠和人的耳聋和甲亢,并导致甲状腺激素抵抗综合征,提示Thrb与神经系统和感觉系统密切相关。本研究发现,Thrb可减轻Aβ42诱导的BV2功能障碍。有趣的是,Thrb能够直接与Sirt3结合,通过调节Sirt3的表达来减轻AD的症状。

A:sh-Sirt3或sh-FOX3a对细胞活力的影响;B:sh-Sirt3或sh-FOX3a对细胞凋亡的影响;C:sh-Sirt3或sh-FOX3a对细胞中IL-6水平的影响;D:sh-Sirt3或sh-FOX3a对细胞中ROS含量的影响。与未处理组比较,*P<0.05;与pcDNA3.1-Thrb组比较,#P<0.05;与pcDNA3.1-Thrb+sh-RNA组比较,$P<0.05
Sirt3主要定位于线粒体,参与多种生物学过程[19]。此外,Sirt3增强线粒体抗氧化谷胱甘肽的表达,减缓动物衰老[20]。众所周知,氧化应激诱导的线粒体功能障碍是AD早期最重要的特征,包括线粒体呼吸酶活性降低、代谢功能障碍等[21-22]。Li等[23]发现在原代海马神经元和AβO处理的动物模型中,HKL可以通过增强Sirt3的活性来调节线粒体功能,包括增加三磷酸腺苷水平和减少活性氧的产生。先前的研究报道,Sirt3广泛参与调节阿尔茨海默病,并在其发展过程中发挥重要作用[24]。Salvatori等[9]报道称,Sirt3的降低与AD患者的线粒体功能障碍有关,Sirt3的表达随着AD的进展而降低。
在本研究发现,Aβ42显著抑制Thrb表达且具有剂量依赖性;过表达Thrb显著降低Aβ42诱导的小胶质细胞BV2的细胞凋亡率和炎症因子的水平,并显著缓解Aβ42诱导的小胶质细胞BV2的氧化应激;进一步的研究结果表明,Thrb显著促进Sirt3和FOX3a的表达且Sirt3/FOX3a参与了Thrb对Aβ42诱导的细胞损伤的保护机制。由以上结果说明Thrb能够缓解小胶质细胞BV2氧化应激和凋亡,降低细胞损伤,其作用机制是通过调控Sirt3/FOX3a信号通路来实现的。
综上所述,本研究证明Thrb显著降低Aβ42诱导的小胶质细胞BV2的细胞凋亡率,并显著缓解细胞氧化应激,其作用机制是通过调控Sirt3/FOX3a信号通路来实现的,这一结果能够为阿尔兹海默症的临床治疗和诊断提供分子基础。
