应用多色探针熔解曲线分析法检测湘潭地区G6PD缺乏症基因突变*
2021-10-19李晨辉王淑媛袁海斌刘春梅
李晨辉,王淑媛,袁海斌,殷 伟,刘春梅
湖南省湘潭市妇幼保健院优生遗传科,湖南湘潭 411101
葡萄糖-6-磷酸脱氢酶(G6PD)缺乏症是人类最常见的遗传代谢病之一,为X连锁不完全显性遗传病,患有G6PD缺乏症的新生儿易出现黄疸,严重者可导致脑损伤,甚至死亡[1]。G6PD缺乏症尚无特效治疗方法,仅能通过对症治疗缓解患儿症状,我国是该病的高发区之一,呈现“南方高北方低”的分布特点[2-3]。对新生儿进行G6PD缺乏症早期筛查也是防治新生儿高胆红素血症的重要手段[4]。筛查G6PD缺乏症的方法很多,主要分为酶学诊断和基因诊断两大类。酶学诊断简便、快捷、价格低廉,但不同类型的基因突变因累积酶的功能部位不同而表型迥异,且该方法不能有效检出女性杂合子;而基因诊断中,传统的检测方法需要PCR后处理,易造成PCR产物污染,操作烦琐、成本高[5],本院应用多色探针熔解曲线分析(MMCA)技术建立了G6PD基因诊断体系,具有操作简单、快捷、高通量、高自动化、低成本等优势。本研究以外显子基因测序(Sanger测序)法为“金标准”,比较酶活性法与MMCA法在G6PD缺乏症诊断中的价值,以期为G6PD缺乏症的早期诊断提供更有效的方法。
1 资料与方法
1.1一般资料 2017年1月至2020年9月在本院新生儿疾病筛查中心进行G6PD缺乏症筛查的90 221例新生儿中,初筛阳性1 024例,召回952例,以其中454例同时进行G6PD酶活性法检测和基因检测(MMCA法、Sanger测序法)的新生儿作为研究对象,男309例,女145例,年龄3~60 d。纳入研究的患儿家属均对本研究知情同意。
1.2仪器与试剂 干血斑G6PD荧光定量分析法试剂盒和1420型荧光分析仪购于美国PerkinElmer公司;G6PD定量酶活性测定试剂盒购于北京华宇亿康生物工程技术有限公司,T600型全自动生化分析仪购自日本日立公司;G6PD基因突变检测试剂盒(货号:YZB/国1217-2015)、Lab-Aid 824全自动核酸提取仪及配套核酸提取试剂(货号:604001)购自厦门致善生物科技有限公司;SLAN-96S实时荧光定量PCR仪购自上海宏石医疗科技有限公司。
1.3方法
1.3.1新生儿G6PD缺乏症初筛 取出生后3~7 d新生儿足跟血,制成干血斑,由专人送至新生儿疾病筛查中心集中检测。采用G6PD荧光定量分析法进行G6PD水平检测。实验操作按试剂盒说明书要求进行。以1 g血红蛋白中G6PD<2.6 U为初筛阳性。
1.3.2酶活性法定量检测G6PD水平 采集G6PD缺乏症初筛阳性新生儿静脉血2 mL(乙二胺四乙酸抗凝),检测红细胞G6PD活性,严格按照试剂盒说明书要求进行检测。G6PD参考值为1 700~2 600 U/L,当红细胞中G6PD<1 700 U/L为G6PD缺乏症。
1.3.3MMCA法检测G6PD基因突变 干血斑标本的核酸提取根据Lab-Aid 824全自动核酸提取仪及配套核酸提取试剂说明书进行操作。基因分型采用G6PD基因突变检测试剂盒,在SLAN-96S实时荧光定量PCR仪上进行检测,根据标本检测结果与野生型对照熔解峰差异来判读G6PD基因突变情况。MMCA法采用荧光PCR熔解曲线,根据靶探针杂交产物熔点的差异检测G6PD基因突变,可同时检测12种常见突变类型,包括c.95A>G、c.383T>C、c.392G>T、c.487G>A、c.517T>C、c.592C>T、c.871G>A、c.1004C>A、c.1024C>T、c.1360C>T、c.1376G>T、c.1388G>A,以及4种少见突变类型(科研位点)c.1387C>T、c.493A>G、c.519C>T、c.1381G>T。结果判读:比较待测标本与野生型对照熔解峰之间熔点(Tm值)的差异,ΔTm值在±1 ℃为野生型峰(阴性),超过±2 ℃为突变型峰(阳性)。通过查阅人类基因突变数据库(HGMD)及文献鉴定每个突变位点的性质和蛋白功能改变。
1.3.4G6PD基因突变全基因组测序 应用Sanger测序法对G6PD基因的2~12外显子及外显子-内含子的剪切区域进行测序分析,若检测出突变基因则为阳性,反之为阴性。标本测序由浙江博圣生物技术股份有限公司完成。
1.4统计学处理 采用SPSS19.0软件进行数据分析。计数资料以例数或百分率表示,组间比较采用χ2检验;诊断结果的一致性判断采用Kappa检验。以P<0.05为差异有统计学意义。
2 结 果
2.13种方法对G6PD缺乏症筛查阳性新生儿的检测结果比较 在454例同时进行G6PD酶活性法、MMCA法及Sanger测序法检测的新生儿中,酶活性法检测出男性阳性165例,女性阳性25例;MMCA法检测出男性阳性164例,女性阳性42例;Sanger测序法检测出男性阳性169例,女性阳性42例。见表1。
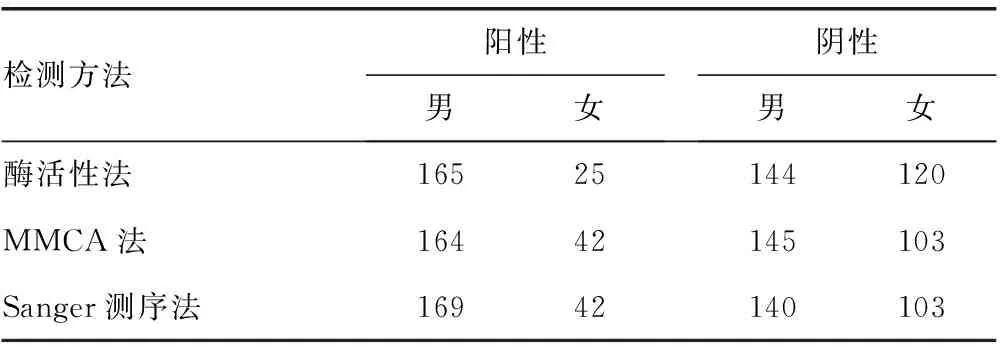
表1 3种方法对G6PD缺乏症筛查阳性新生儿的检测结果比较(n)
2.2G6PD活性正常、基因突变阳性新生儿情况分析 酶活性法检测出的G6PD活性正常新生儿中,21例为G6PD基因突变阳性。该21例新生儿出生体质量、胎龄均正常,包括4例男性(均有输血史和黄疸治疗史)和17例女性(其中3例有黄疸治疗史)。4例男性新生儿酶活性法的检测值为1 700~2 000 U/L,G6PD基因突变类型全部为c.1376G>T;17例女性新生儿酶活性法的检测值>1 900 U/L,G6PD基因突变类型为c.1376G>T 8例,c.1388G>A 6例,c.519C>T 1例,c.1024C>T 1例及c.871G>A 1例。
2.3G6PD基因多态性分布情况 454例新生儿中共检出G6PD基因突变211例。检出常见突变类型为c.1388G>A、c.1376G>T、c.95A>G、c.1024C>T、c.871G>A、c.392G>T、c.487G>A、c.1004C>A、c.1360C>T、c.517T>C;检出少见突变类型为c.519C>T;Sanger测序法检出c.1003G>A、c.152C>T、c.585G>T、c.94C>G。G6PD基因突变比例最高的前3位为c.1388G>A、c.1376G>T、c.95A>G。MMCA法共检出11种突变类型,其中男性半合子突变10种,女性杂合子突变9种,女性未见纯合子和复合杂合突变。Sanger测序法检出15种突变类型,其中男性半合子突变14种,女性杂合子突变9种,女性未见纯合子和复合杂合突变。见表2。
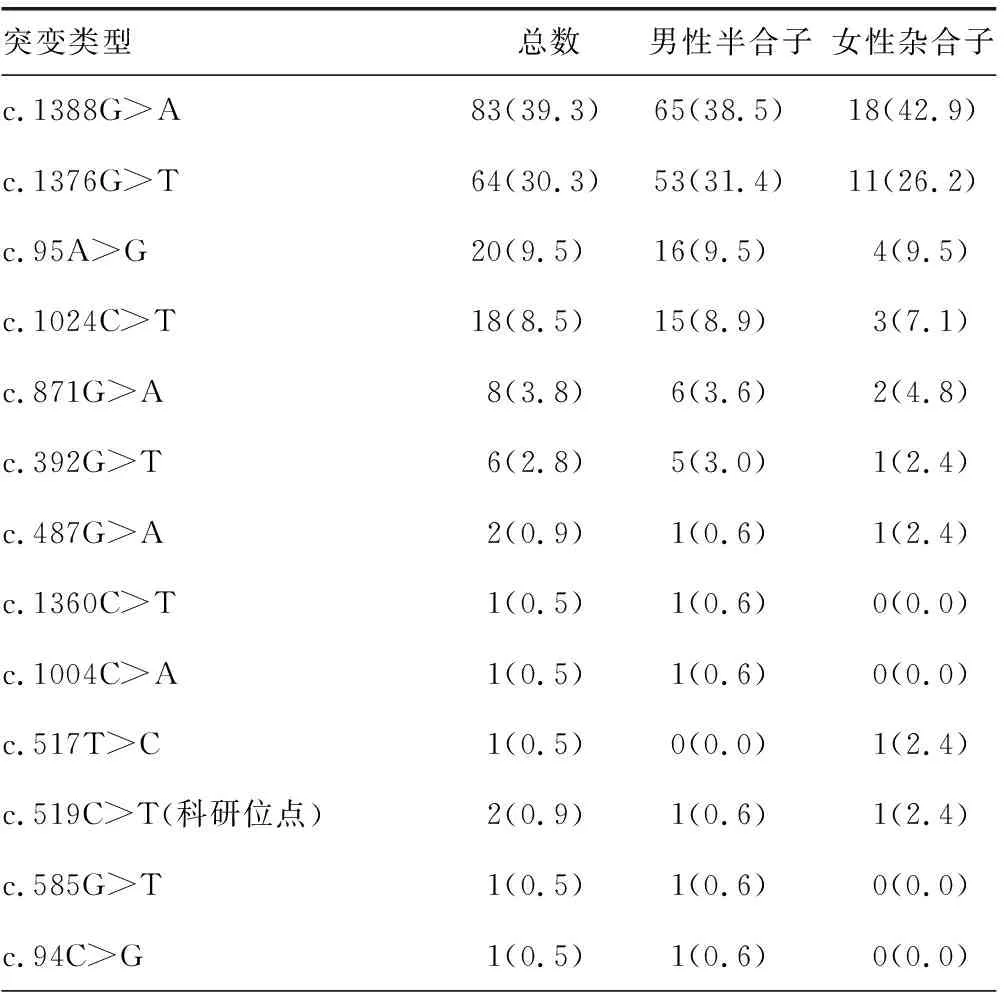
表2 G6PD基因多态性分布情况[n(%)]
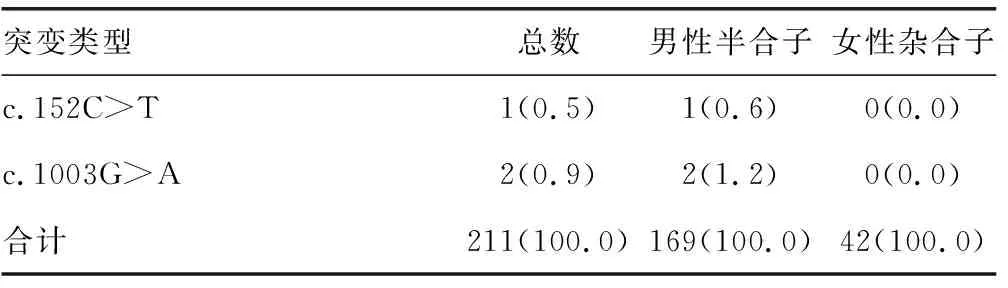
续表2 G6PD基因多态性分布情况[n(%)]
2.4酶活性法与Sanger测序法检测结果比较 以Sanger测序法为G6PD缺乏症基因诊断的“金标准”,对酶活性法进行方法学评价,结果显示,酶活性法诊断男性新生儿G6PD缺乏症的灵敏度为97.6%(165/169),特异度为100.0%(140/140),阳性预测值为100.0%(165/165),阴性预测值为97.2%(140/144)。酶活性法诊断女性新生儿G6PD缺乏症的灵敏度为59.5%(25/42),特异度为100.0%(103/103),阳性预测值为100.0%(25/25),阴性预测值为85.8%(103/120)。酶活性法与Sanger测序法诊断男性新生儿G6PD缺乏症的结果一致性较好(Kappa=0.974,P<0.05),诊断女性新生儿G6PD缺乏症的结果一致性一般(Kappa=0.676,P<0.05)。见表3、4。
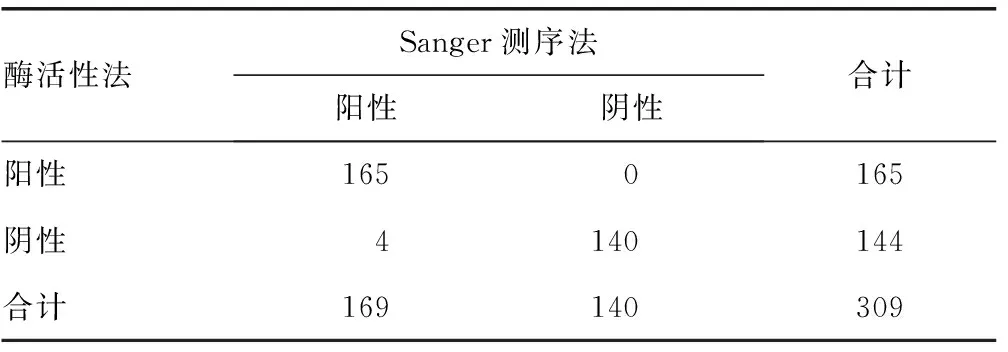
表3 酶活性法与Sanger测序法诊断男性新生儿G6PD缺乏症的结果(n)

表4 酶活性法与Sanger测序法诊断女性新生儿G6PD缺乏症的结果(n)
2.5MMCA法与Sanger测序法检测结果比较 以Sanger测序法为G6PD缺乏症基因诊断的“金标准”,对MMCA法进行方法学评价,结果显示,MMCA法诊断男性新生儿G6PD缺乏症的灵敏度为97.0%(164/169),特异度为100.0%(140/140),阳性预测值为100.0%(164/164),阴性预测值96.6%(140/145)。MMCA法诊断女性新生儿G6PD缺乏症的灵敏度为100.0%(42/42),特异度为100.0%(103/103),阳性预测值为100.0%(42/42),阴性预测值为100.0%(103/103)。MMCA法与Sanger测序法诊断男性新生儿G6PD缺乏症的结果一致性较好(Kappa=0.967,P<0.05),诊断女性新生儿G6PD缺乏症的结果完全吻合(Kappa=1.000,P<0.05)。有5例男性新生儿用MMCA法检测出现假阴性结果,Sanger测序法显示1例为c.585G>T,1例为c.94C>G,1例为c.152C>T,2例为c.1003G>A。见表5、6。

表5 MMCA法与Sanger测序法诊断男性新生儿G6PD缺乏症的结果(n)

表6 MMCA法与Sanger测序法诊断女性新生儿G6PD缺乏症的结果(n)
3 讨 论
G6PD缺乏症是一种X染色体连锁不完全显性遗传的红细胞酶缺陷病,男性只有1条X染色体,所以G6PD缺乏症表型为酶活性明显降低的半合子;而女性有2条X染色体,所以女性G6PD缺乏症表型为杂合子或纯合子,且大部分女性为杂合子,本研究基因诊断为G6PD缺乏症的42例女性患儿均为杂合子。女性杂合子患儿的酶活性可表现为正常、轻度缺乏、中度缺乏和显著缺乏[6],因此,只筛查酶活性会漏诊表型正常的女性杂合子患儿,G6PD缺乏症杂合子是新生儿高胆红素血症发生的独立危险因素之一[7],所以进行基因检测对女性杂合子患儿的筛查很重要。本研究对454例初筛为G6PD缺乏症的患儿采用酶活性法与MMCA法分别检测G6PD活性与基因突变类型,其中基因突变类型共检出15种,c.1388G>A、c.1376G>T和c.95A>G是湘潭地区最常见的G6PD基因突变类型,与湖南省其他地区的相关报道结果相符[8-9]。本研究检出了21例酶活性正常,而MMCA法和Sanger测序法的检测结果为阳性的新生儿,包括4例男性新生儿和17例女性新生儿,考虑出现该结果可能有以下几个原因:(1)同义突变未引起氨基酸的改变,突变为多态性位点;(2)新生儿急性溶血期由于新生红细胞G6PD活性偏高可能导致酶活性法检测结果偏高;(3)在急性溶血期,由于新生儿血液中幼稚红细胞较多,G6PD活性较高;(4)其他未知原因造成的假阴性结果[10]。询问21例新生儿的相关病史,4例男性新生儿有输血史和黄疸治疗史;17例女性新生儿中3例有黄疸治疗史,因此女性新生儿只有进行G6PD基因检测才能提高杂合子的检出率。
目前,临床上针对G6PD缺乏症的基因检测方法有很多种,如等位基因寡核苷酸探针杂交、变性梯度凝胶电泳、错配碱基PCR/限制性内切酶图谱分析、PCR-单链构象多态性分析、DNA测序等方法均可用于G6PD基因突变检测,但是上述方法成本高,操作过程复杂,耗时长,通量低,不适合大规模样本检测。MMCA法的主要原理是根据DNA序列长度、GC含量及碱基互补差异,应用高分辨率的熔解曲线对标本进行分析,其极高的分辨精度可达到对单一碱基差异的分析。本研究中首先采用酶活性法和MMCA法对454例初筛阳性的G6PD缺乏症患儿分别进行酶活性和基因检测,再以Sanger测序法的检测结果作为“金标准”,评价酶活性法和MMCA法的检测效能。对男性新生儿而言,酶活性法检测的灵敏度为97.6%,特异度为100.0%,与Sanger测序法的检测结果一致性较好;MMCA法检测的灵敏度为97.0%,特异度为100.0%,与Sanger测序法的检测结果一致性较好。表明用酶活性法和MMCA法诊断男性新生儿G6PD缺乏症的效能高。对女性新生儿而言,酶活性法检测的灵敏度为59.5%,特异度为100.0%,与Sanger测序法的检测结果一致性一般;MMCA法检测的灵敏度、特异度均为100.0%,与Sanger测序法的检测结果完全一致,与胡韦维等[11]的相关研究结果相同。这也提示女性杂合子难以单纯根据酶活性进行准确诊断,因为存在漏诊风险[12],因此,建议女性新生儿直接采用MMCA法进行检测。此外,本研究发现,与Sanger测序法的结果比较,MMCA法有5例假阴性结果,分析其原因:G6PD基因突变检测试剂盒(MMCA法)是根据目前已报道的中国人群G6PD基因突变的等位基因频率,选择了16种常见的突变位点设计相应的引物和探针,因此其检测范围与突变位点的位置有关;而Sanger测序法是针对除了第1外显子以外的所有G6PD基因外显子进行检测,其覆盖范围比MMCA法更广。而MMCA法检测出的这5例假阴性男性患儿Sanger测序法检测结果为c.585G>T(1例)、c.94C>G(1例)、c.152C>T(1例)、c.1003G>A(2例),由于这些突变类型不在MMCA法引物和探针设计的检测范围内而无法被检出。因此,对临床高度疑似或者MMCA法试剂盒未覆盖的未知突变标本要用Sanger测序法确诊。
与Sanger测序法相比,MMCA法具有以下优点,(1)检测快速、高通量:可同时检测46份标本,并在2.5 h内完成;(2)操作简便:PCR与荧光探针杂交在同一反应体系内实时进行,不需要PCR扩增后的杂交过程;(3)不易污染:闭管操作,无需PCR后处理;(4)方法可靠、结果易判断:其结果自动判断,减少人为因素判读失误;(5)成本更低[13-14]。
综上所述,与传统的酶活性法比较,MMCA法具有灵敏度、特异度高的优点,是一种快速、准确、适用于临床诊断G6PD缺乏症的方法。
