lncRNA SNHG16通过靶向miR-22-3p调控肾母细胞瘤WIT49细胞增殖、迁移、侵袭及凋亡的分子机制
2021-10-18倪志福汪晓玲屈振繁孙恒王波
倪志福 汪晓玲 屈振繁 孙恒 王波
肾母细胞瘤是临床常见的一种恶性肿瘤,其常发生于儿童时期,近年来,我国肾母细胞瘤发病率逐年上升,已严重威胁患儿生命安全,目前临床主要根据病理类型评估肾母细胞瘤患儿的预后,但其具有极大的局限性,肾母细胞瘤发病机制尚未阐明,因而探究肾母细胞瘤发生及发展的分子机制对提高其诊断效率及评估患儿预后均具有重要意义[1]。长链非编码RNA(lncRNA)在肾母细胞瘤中表达上调或下调,并可调控细胞增殖、凋亡等生物学过程,还可能作为肾母细胞瘤靶向治疗的潜在靶标[2-4]。长链非编码RNA SNHG16(lncRNA SNHG16)在肾母细胞瘤中表达水平升高,并可调控miR-200a-3p的表达从而促进肾母细胞瘤发生及发展[5]。靶基因预测显示微小RNA-22-3p(miR-22-3p)与SNHG16存在结合位点,研究表明miR-22-3p在肾母细胞瘤中表达水平降低,并可通过靶向AKT3的表达从而调控细胞增殖及侵袭[6]。但SNHG16是否可通过调控miR-22-3p参与肾母细胞瘤发生及发展过程尚未可知。因此,本研究主要探讨SNHG16与miR-22-3p对肾母细胞瘤WIT49细胞增殖、迁移、侵袭及凋亡的影响及其可能作用机制,为肾母细胞瘤分子治疗提供潜在靶点。
对象与方法
一、对象
选取2017年10月~2019年3月本院收治的肾母细胞瘤患儿30例,所有患儿均被确诊为肾母细胞瘤,其中男20例,女10例,年龄1~10岁,平均年龄(4.26±1.23)岁,术中切除肾母细胞瘤组织及癌旁组织,置于-80 ℃超低温冰箱内保存。本研究经本院伦理委员会批准,患儿家属知情且签署同意书。
人肾母细胞瘤WIT49细胞购自美国ATCC细胞库;DMEM培养液、胎牛血清、胰蛋白酶购自美国Hyclone公司;Lipofectamine2000购自北京索莱宝科技有限公司;Trizol试剂、SuperScriptTMIV One-Step RT-PCR System with ezDNaseTM、SuperScriptTMIII PlatinumTMSYBRTMGreen One-Step qRT-PCR Kit购自美国Thermo Fisher公司;CCK-8试剂购自上海李记生物科技有限公司;si-NC、si-SNHG16、miR-NC、miR-22-3p mimics、anti-miR-NC、anti-miR-22-3p购自上海吉玛制药技术有限公司;pcDNA3.1、pcDNA-SNHG16购自美国Invitrogen公司;Transwell小室购自北京优尼康生物科技有限公司;Matrigel基质胶购自北京绿源伯德生物科技有限公司;Annexin V-FITC / PI凋亡试剂盒购自北京博尔迈生物技术有限公司;兔抗人CyclinD1、MMP-2、MMP-9、Bcl-2、p21、Bax抗体购自美国Santa Cruz公司;HRP标记的山羊抗兔IgG二抗购自武汉博士德生物工程有限公司。
二、方法
1.实验分组:WIT49细胞接种于96孔板(1×103个/孔),分别将si-NC、si-SNHG16、miR-NC、miR-22-3p mmics、si-SNHG16与anti-miR-NC、si-SNHG16与anti-miR-22-3p转染至WIT49细胞,分别记作si-NC组、si-SNHG16组、miR-NC组、miR-22-3p组、si-SNHG16+anti-miR-NC组、si-SNHG16+anti-miR-22-3p组。
2.qRT-PCR检测SNHG16、miR-22-3p的表达水平:采用Trizol法提取癌旁组织、肾母细胞瘤组织及各组WIT49细胞总RNA,将总RNA反转录合成cDNA(按照试剂盒说明书操作),以cDNA为模板进行qRT-PCR反应(按照试剂盒说明书进行操作),应用ABI 7500型荧光定量PCR仪检测SNHG16、miR-22-3p相对表达量。
3.CCK-8法检测细胞增殖:取各组WIT49细胞接种于96孔板(1×103个/孔),分别于培养24小时、48小时、72小时时加入CCK-8溶液(10 μl/孔),继续孵育2小时,应用酶标仪检测各孔吸光度值(OD值)。
4.Transwell实验检测细胞迁移与侵袭:取各组细胞悬液(2.5×104个/ml)加入小室的上室(200 μl/孔),将含有10%胎牛血清的培养液加入小室的下室(600 μl/孔),继续培养24小时,分别使用多聚甲醛固定及结晶紫染色后置于显微镜下观察迁移细胞数。实验前在小室的上室加入Matrigel基质胶稀释液(40 μl/孔),继续孵育4小时,按照细胞迁移实验步骤进行后续实验,置于显微镜下观察侵袭细胞数。
5.流式细胞术检测细胞凋亡率:取各组WIT49细胞加入PBS洗涤,弃上清,向细胞沉淀中加入Binding Buffer悬浮细胞(500 μl),参照凋亡试剂盒说明书分别加入Annexin V-FITC(5 μl)与PI(5 μl),充分混匀,室温避光孵育10 min,应用流式细胞仪检测各组细胞凋亡率。
6.双荧光素酶报告基因检测SNHG16、miR-22-3p的靶向关系:LncBase Predicted v.2预测显示SNHG16、miR-22-3p存在结合位点,分别构建野生型载体WT-SNHG16与突变型载体MUT-SNHG16,分别将miR-NC、miR-22-3p mimics与WT-SNHG16、MUT-SNHG16共转染至WIT49细胞,继续培养24小时,检测各组细胞荧光素酶活性。
7.Western blot检测CyclinD1、MMP-2、MMP-9、Bcl-2、p21、Bax蛋白表达:WIT49细胞加入RIPA裂解液(400 μl)提取细胞总蛋白,采用BCA法检测蛋白浓度,取蛋白样品(50 μg)进行SDS-PAGE电泳反应,转膜、封闭(2小时),分别孵育一抗稀释液(1∶1 000)与二抗稀释液(1∶2 000),室温孵育1小时,滴加ECL,暗室内曝光显影,应用自动凝胶成像系统分析各蛋白条带。
三、统计学处理
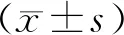
结果
1.lncRNA SNHG16和miR-22-3p在肾母细胞瘤组织中的表达:与癌旁组织比较,肾母细胞瘤组织中SNHG16的表达水平显著升高(P<0.05),miR-22-3p的表达水平显著降低(P<0.05),见表1。

表1 lncRNA SNHG16和miR-22-3p在肾母细胞瘤组织中的表达
2.抑制lncRNA SNHG16表达对肾母细胞瘤WIT49细胞增殖、迁移侵袭和凋亡的影响:与si-NC组比较,si-SNHG16组OD值显著降低(P<0.05),迁移及侵袭细胞数显著减少(P<0.05),凋亡率显著升高(P<0.05),CyclinD1、MMP-2、MMP-9、Bcl-2蛋白水平显著降低(P<0.05),p21、Bax蛋白水平显著升高(P<0.05),见表2、表3、图1。

表2 抑制lncRNA SNHG16表达对肾母细胞瘤WIT49细胞增殖、迁移侵袭和凋亡的影响
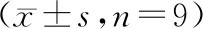
表3 抑制lncRNA SNHG16表达对肾母细胞瘤WIT49细胞增殖、迁移侵袭和凋亡相关蛋白的影响
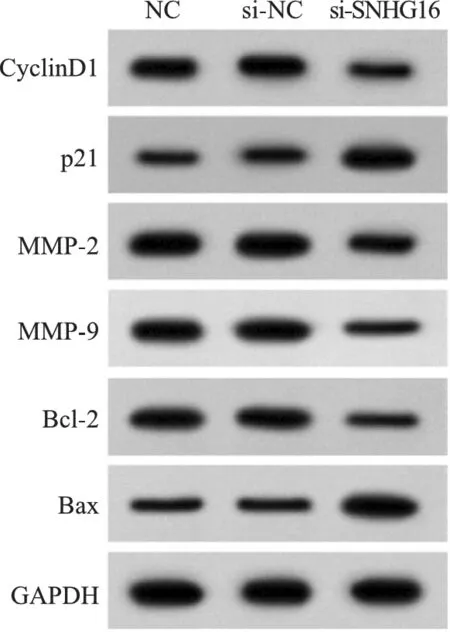
图1 增殖、迁移侵袭和凋亡相关蛋白的表达
3.lncRNA SNHG16靶向调控miR-22-3p的表达:LncBase Predicted v.2预测显示SNHG16与miR-22-3p存在结合位点,见图2。miR-22-3p过表达可明显降低野生型载体WT-SNHG16的荧光素酶活性(P<0.05),而对突变型载体MUT-SNHG16荧光素酶活性无明显影响(P>0.05),见表4。与pcDNA组比较,pcDNA-SNHG16组miR-22-3p的表达水平显著降低(P<0.05);与si-NC组比较,si-SNHG16组miR-22-3p的表达水平显著升高(P<0.05),见表5。

图2 SNHG16的序列中含有与miR-22-3p互补的核苷酸序列

表4 双荧光素酶实验
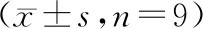
表5 lncRNA SNHG16调控miR-22-3p表达
4.miR-22-3p过表达对肾母细胞瘤WIT49细胞增殖、迁移侵袭和凋亡的影响:与miR-NC组比较,miR-22-3p组OD值显著降低(P<0.05),迁移及侵袭细胞数显著减少(P<0.05),凋亡率显著升高(P<0.05),CyclinD1、MMP-2、MMP-9、Bcl-2蛋白水平显著降低(P<0.05),p21、Bax蛋白水平显著升高(P<0.05),见表6、表7、图3。

表6 miR-22-3p过表达对肾母细胞瘤WIT49细胞增殖、迁移侵袭和凋亡的影响

表7 miR-22-3p过表达对肾母细胞瘤WIT49细胞增殖、迁移侵袭和凋亡相关蛋白表达的影响

图3 增殖、迁移侵袭和凋亡相关蛋白表达
5.下调miR-22-3p表达逆转了抑制lncRNA SNHG16表达对肾母细胞瘤WIT49细胞增殖、迁移侵袭和凋亡的作用:与si-SNHG16+anti-miR-NC组比较,si-SNHG16+anti-miR-22-3p组OD值显著升高(P<0.05),迁移及侵袭细胞数显著增多(P<0.05),凋亡率显著降低(P<0.05),CyclinD1、MMP-2、MMP-9、Bcl-2蛋白水平显著升高(P<0.05),p21、Bax蛋白水平显著降低(P<0.05),见表8、表9、图4。
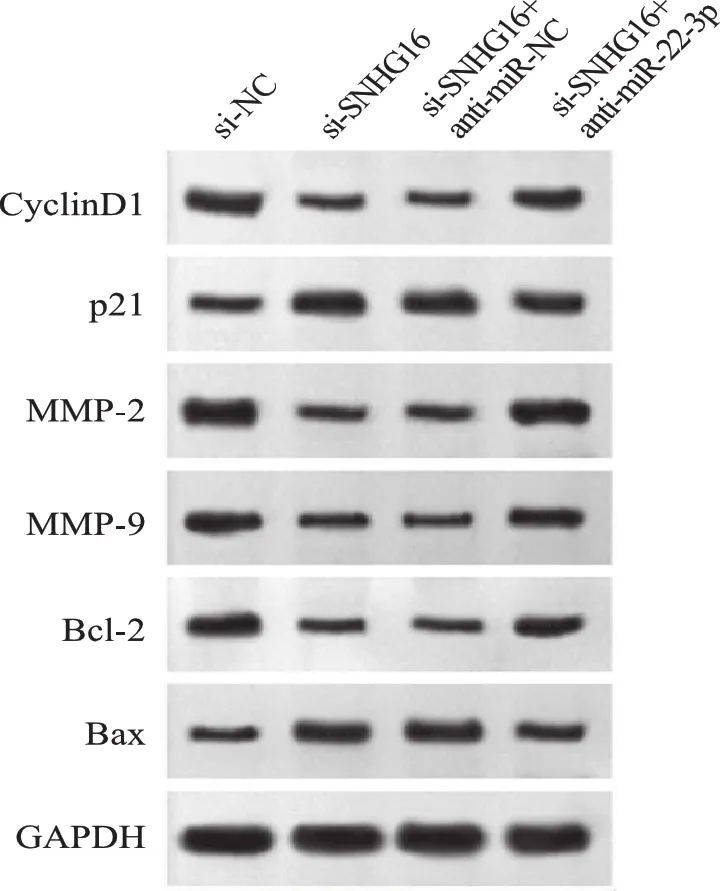
图4 增殖、迁移侵袭和凋亡相关蛋白表达
表8 下调miR-22-3p表达逆转了抑制lncRNA SNHG16表达对肾母细胞瘤WIT49细胞增殖、迁移侵袭和凋亡的作用

表9 下调miR-22-3p表达逆转了抑制lncRNA SNHG16表达对肾母细胞瘤WIT49细胞增殖、迁移侵袭和凋亡相关蛋白表达的作用
讨论
肾母细胞瘤患儿临床表现为肿瘤包块破溃引起的血尿及腹部疼痛,其治疗效果已取得巨大进步,但其已给患儿家庭造成一定负担,lncRNA表达异常可调控肾母细胞瘤细胞增殖、凋亡等生物学过程,Zhu等[7]研究表明LINC00473可充当miR-195的海绵分子而调控肾母细胞瘤发生及发展过程。lncRNA可充当miRNA的海绵分子而参与肾母细胞瘤发生及发展过程[8-10]。但lncRNA在肾母细胞瘤形成及发展过程中的作用机制尚未完全阐明。
SNHG16在喉鳞状细胞癌中的表达水平升高,并可通过介导miR-877-5p / FOXP4轴促进喉鳞状细胞癌的发展[11]。敲低SNHG16可通过充当miR-342-3p的海绵分子而抑制多发性骨髓瘤细胞增殖[12]。SNHG16通过下调DKK3的表达促进胃癌上皮-间质转化[13]。本研究结果显示,肾母细胞瘤组织中SNHG16的表达水平明显升高,进一步研究显示抑制SNHG16表达可明显降低OD值及CyclinD1蛋白水平,提高p21蛋白水平。研究表明CyclinD1可正向调控细胞周期促进细胞增殖,p21可负向调控细胞周期抑制细胞增殖[14]。本研究结果进一步证实抑制SNHG16表达可抑制肾母细胞瘤细胞增殖。细胞转移能力增强与肿瘤进展密切相关,MMP-2、MMP-9属于基质金属蛋白酶,其可通过降解细胞外基质沉积从而促进细胞迁移及侵袭[15]。本研究结果显示抑制SNHG16表达可明显减少迁移及侵袭细胞数,降低MMP-2、MMP-9的表达水平,提示抑制SNHG16表达可抑制肾母细胞瘤细胞迁移及侵袭。细胞增殖与凋亡异常可促进肿瘤发生及发展,Bcl-2表达下调可抑制细胞凋亡,Bax表达上调可促进细胞凋亡[16]。本研究结果显示抑制SNHG16表达可提高凋亡率,促进Bax表达及抑制Bcl-2表达,提示抑制SNHG16表达可促进肾母细胞瘤细胞凋亡。
本研究证实SNHG16可靶向结合miR-22-3p,并可负向调控miR-22-3p的表达及活性。 LINC00858通过充当miR-22-3p的ceRNA而促进细胞增殖、迁移和侵袭[17]。lncRNA NNT-AS1通过调节miR-22-3p / YAP1轴促进非小细胞肺癌的进展[18]。lncRNA DGCR5通过抑制miR-22-3p而促进肺腺癌进程[19]。miR-22-3p靶向α-烯醇酶1调节视网膜母细胞瘤细胞的增殖[20]。本研究结果显示肾母细胞瘤组织中miR-22-3p的表达水平降低,miR-22-3p过表达可抑制肾母细胞瘤细胞增殖、迁移及侵袭,促进细胞凋亡,提示miR-22-3p在肾母细胞瘤发生及发展过程中可发挥重要调控作用。同时本研究将si-SNHG16与anti-miR-22-3p共转染至肾母细胞瘤细胞,结果显示细胞增殖、迁移及侵袭能力明显增强,凋亡率明显降低,提示下调miR-22-3p表达可明显逆转抑制SNHG16表达对肾母细胞瘤细胞增殖、迁移侵袭和凋亡的作用。
综上所述,抑制SNHG16表达可通过上调miR-22-3p的表达从而抑制肾母细胞瘤细胞增殖、迁移及侵袭,促进细胞凋亡,可为揭示肾母细胞瘤发病机制奠定实验基础,还可能作为肾母细胞瘤靶向治疗的潜在靶点。但关于其作用机制尚需进一步探究。
