基于网络药理学探讨真武汤治疗糖尿病肾病的作用机制
2021-10-16杜广华
刘 武,丁 宁,姜 赫,杜广华,宋 双,张 诏
(山东中医药大学中医学院,山东 济南 250355)
糖尿病肾病(diabetic kidney disease,DKD)的发病率约占糖尿病患者总发病人数的40%,是一种糖尿病微血管并发症,是导致终末期肾病的最常见因素[1,2]。据统计,在2015年,全球大约有4.15 亿糖尿病患者,预计到2040年,糖尿病患者将上升至6.42 亿人。1990~2012年,DKD导致的死亡率达到94%,是造成全球疾病负担的重要原因之一,因此,对DKD的治疗至关重要[1]。DKD发生机制已被证实与炎症反应、膜结合Toll样受体、核苷酸结合寡聚域等有关,受Wnt信号通路、TGF-beta信号通路以 及PI3K/AKT等 多 种 信 号 通 路 的 调 控[2,3]。目前,对DKD的治疗尚无特效措施,主要是对症治疗,即控制血糖、血压、血脂、蛋白尿等,至其发展到终末期肾衰竭则选择肾脏替代。现已有大量临床研究发现,中医中药在治疗DKD,延缓肾脏病理进展方面起到了重要作用,具有较好的疗效和安全性[4,5]。
真武汤源自张仲景的《伤寒论》,其药物组成为附子、茯苓、白术、白芍、生姜,整方具有温阳利水之效,现代医学扩展其应用于临床多种疾病的治疗,其治疗肾病综合征、慢性肾小球肾炎、DKD等肾脏疾病的疗效显著[6]。临床研究发现,真武汤对于痰瘀互结证2型糖尿病肾病患者具有良好的临床疗效,且能够改善血管内皮生长因子水平[7]。此外,动物实验证明,真武汤能够降低血清胰岛素样生长因子1(insulin-like growth factor1,IGF-1)水平,使组织中IGF-1明显下调,以保护肾脏功能[8,9]。真武汤治疗DKD疗效显著,但是真武汤由五种药物组成,化学成分复杂,对于其治疗DKD的靶点和作用机制尚未明确。而网络药理学能够系统地反映药物对疾病网络的干预机制,体现中医药复方的多成分、多靶点、多途径的作用特征,有利于揭示中医药复方的科学性[10]。因此,本文采用网络药理学的方法,通过构建“中药-化学成分-疾病靶点”网络,以探究真武汤治疗DKD的作用机制,为临床应用真武汤提供证据。
1 资料与方法
1.1 真武汤中药物及其潜在靶点预测
利用中药系统药理学数据库(Traditional Chinese Medicine System Pharmacology,TCMSP)数据库分别检索真武汤中单味药:茯苓、白芍、生姜、白术、附子的化学成分,以口服生物利用度(OB)≥30%,且类药性(DL)≥0.18 为条件进行筛选,得出相应有效成分化合物信息。利用UniProt数据库对所获得的成分靶点信息进行规范统一。
1.2 DKD的疾病靶点收集
在人类基因组注释数据库(Genecards)、人类孟德尔遗传数据库(OMIM)、Therapeutic Target Databas数 据 库(TTD)中 以“diabetic nephropathy”、“diabetic kidney disease”为检索词,获取DKD的疾病相关靶点。
1.3 真武汤治疗DKD靶点筛选
利用生物信息学与进化基因组学网(http://bioinformatics.psb.ugent.be/)将真武汤有效成分靶点与DKD疾病靶点进行分析合并,绘制Venn图,将其交集作为作用于方药对疾病的直接作用靶点。
1.4 蛋白相互作用(PPI)网络的构建
将交集所得到的靶点上传至String数据库,物种选择“Homo sapiens”,设置最低相互作用阈值为“medium confidence(0.400)”,余为默认值,构建PPI网络图。
1.5 真武汤成分-DKD-靶点网络的构建
将真武汤中各味中药及其化学成分、作用靶点以及DKD疾病靶点上传至Cytoscape3.7.2 软件中,构建中药-化学成分-疾病靶点网络图。
1.6 GO富集分析与KEGG通路分析
将交集所得到的靶点上传至DAVID数据库中进行GO富集分析,包括生物过程(biological process,BP)、细胞组分(cellular components,CC)、分子 功 能(molecular function,MF)及KEGG通 路分析。
2 结果
2.1 真武汤药物活性化学成分及对应靶点
通过TCMP数据库搜索真武汤中活性化学成分,根据所设置OB≥30%,DL≥0.18 为条件筛选,初步获取白芍活性化学成分13个,附子21个,白术7个,茯苓15个,生姜5个,去重后共得到59个化学成分。在TCMP数据库中共搜索得到对应靶点281个,运用Uniprot进行蛋白标准化命名,最终去重后得到靶蛋白103个。见表1。
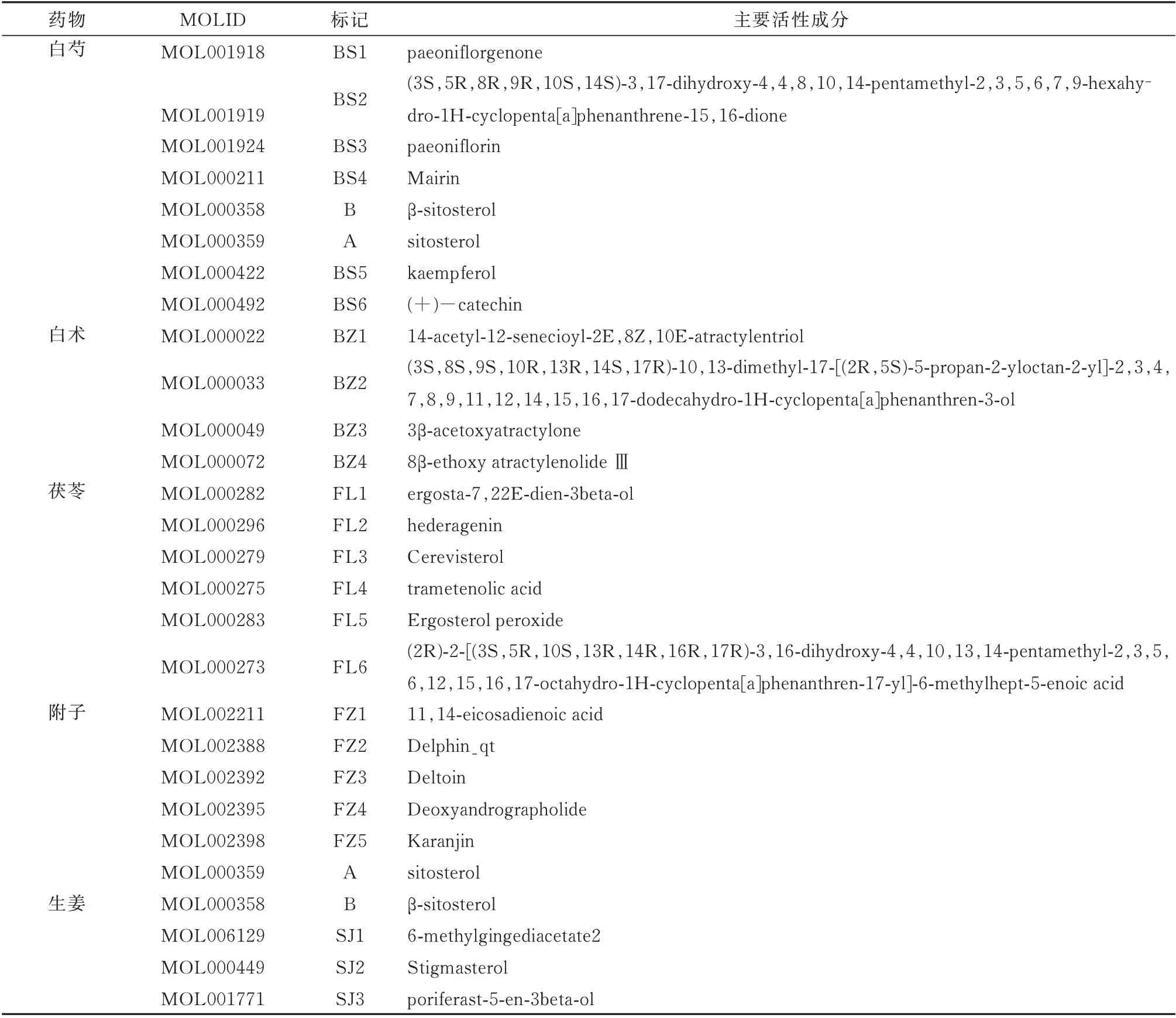
表1 真武汤主要活性成分Tab1 Main active constituents of Zhenwu Tang
2.2 DKD相关靶点的获取
通过Genecards数据库搜索,收集到DKD相关靶点11247个,DN相关靶点3082个,设定Score大于中位数的目标靶点为DKD潜在靶点,最终筛选获得DKD相关靶点1408个,DN相关靶点1541个;通过OMIM数据库搜索收集到DKD相关靶点475个,DN相关 靶 点252个;通过TTD数据 库搜索收 集到DN相 关靶点19个,DKD相 关靶点1个,合并去重后最终得到疾病相关靶点2569个。
2.3 真武汤靶点与DKD靶点的筛选与PPI网络的构建
将真武汤获得的靶点基因与DKD潜在靶点取交集后,获得共用靶点66个,制作韦恩图,见图1。将获得的靶点上传至String数据库,获得蛋白相互作用PPI网络,见图2。在PPI网络图中共有66个节点,505条边,平均degree值为15.3 。通过Cytoscape3.7.2 中的cytoHubba插件以MCC算法对PPI网络中各个节点进行分析,筛选排名前10位的靶点,如图3。
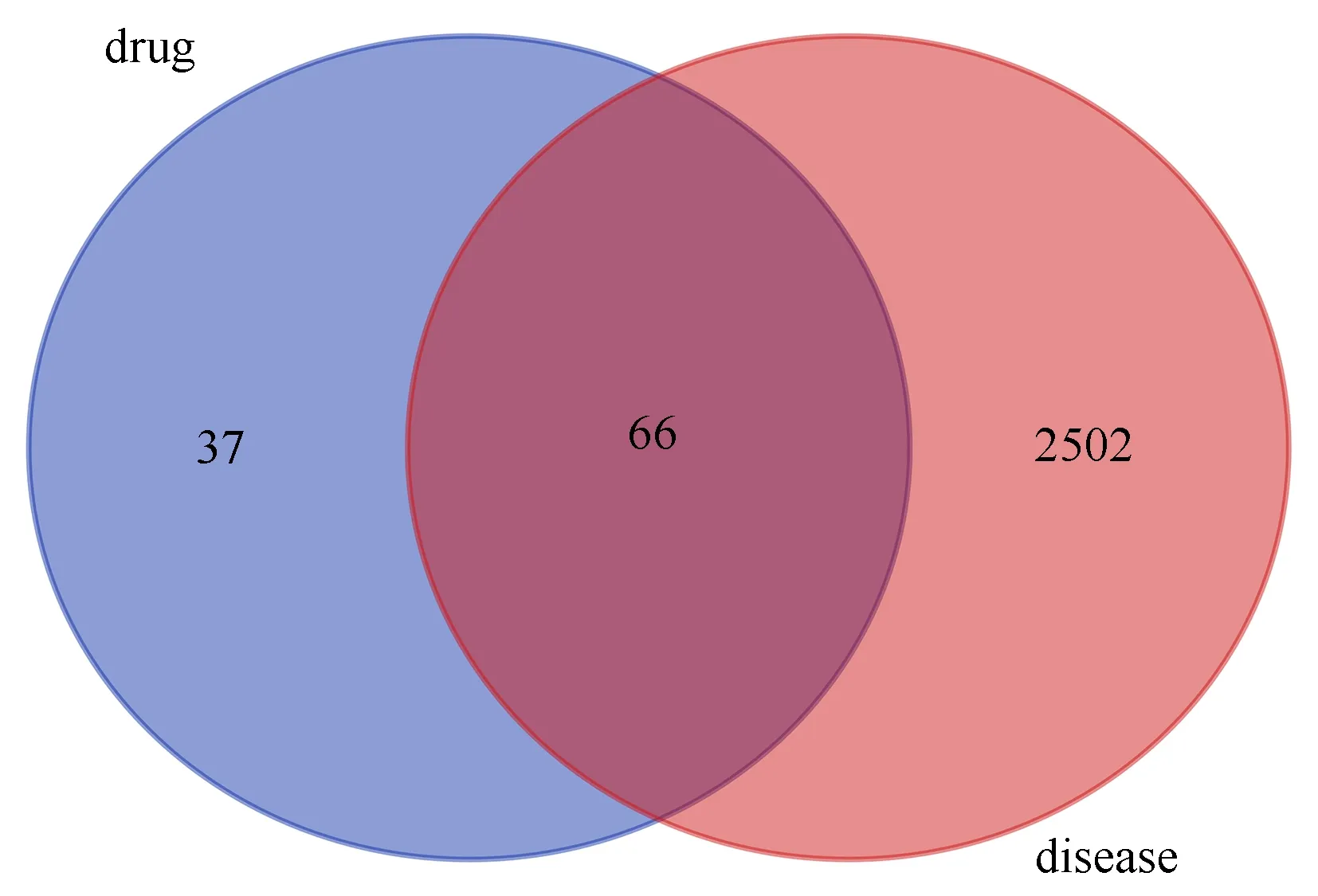
图1 真武汤-DKD靶点韦恩图Fig1 Venn diagram of Zhenwu Tang-DKD targets
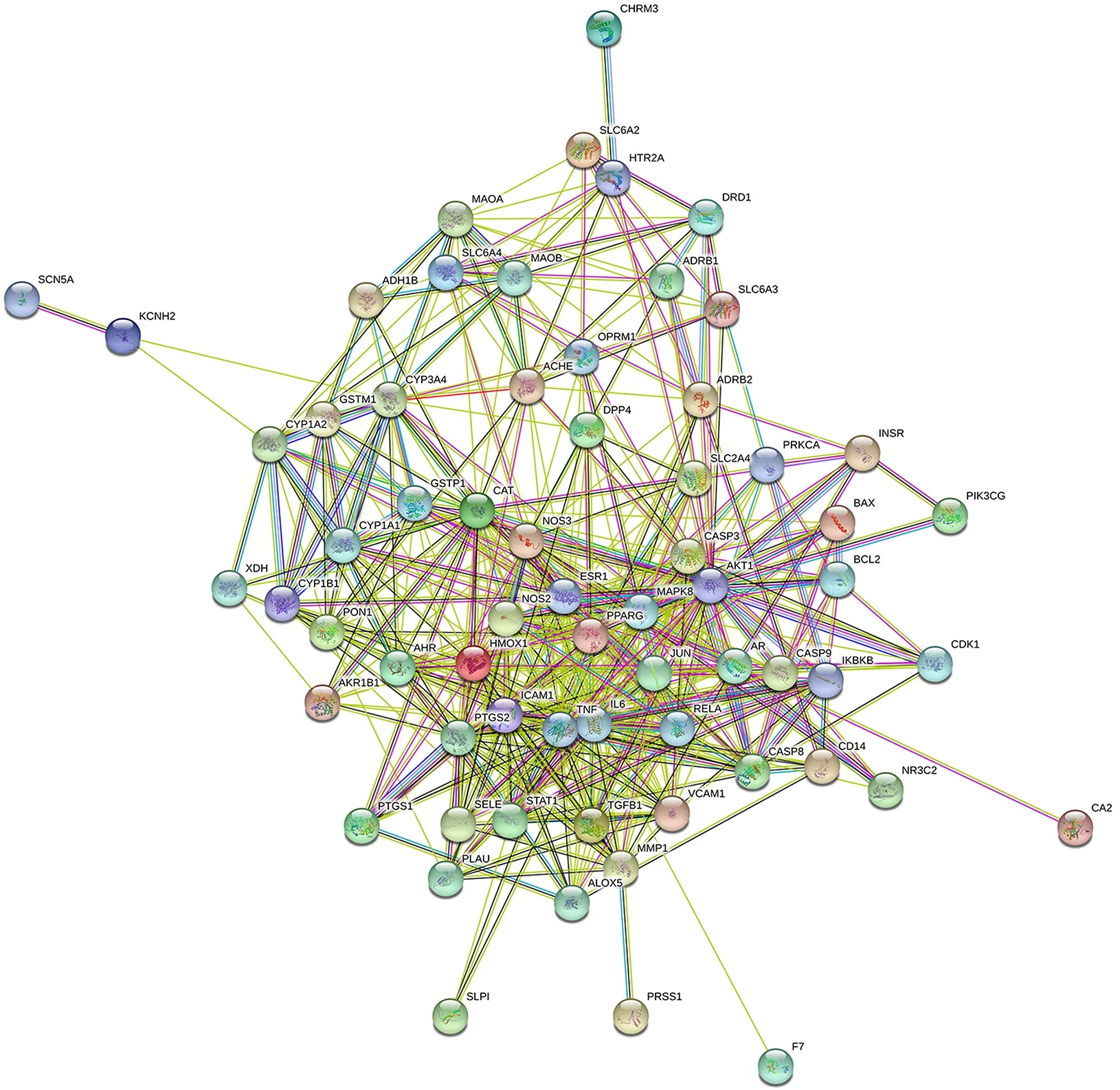
图2 真武汤-DKD靶点PPI网络Fig2 PPI network of Zhenwu Tang-DKD targets
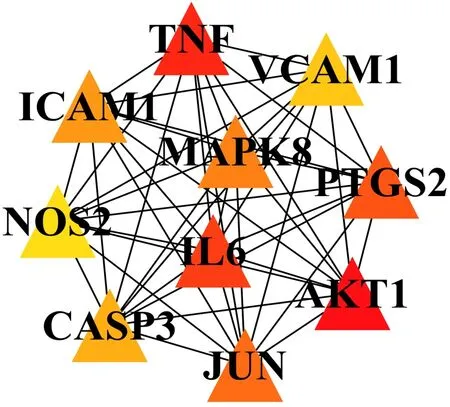
图3 基于MCC算法的前十位Hub基因Fig3 Top10hub genes based on MCC algorithm
2.4 真武汤成分-DKD-靶点网络构建
利用Cytoscape3.7.2 构建真武汤中中药各化学成分-DKD-靶点网络图,如图4所示。运用Cytoscape3.7.2 中的NetworkAnalyzer分析得出各参数的degree值,degree值排名前5的化学成分是:β-谷甾 醇(β-sitosterol)、山 柰 酚(kaempferol)、豆 甾 醇(stigmasterol)、常春藤皂苷元(hederagenin)、3β-乙酰氧基苍术酮(3β-acetoxyatractylone)。
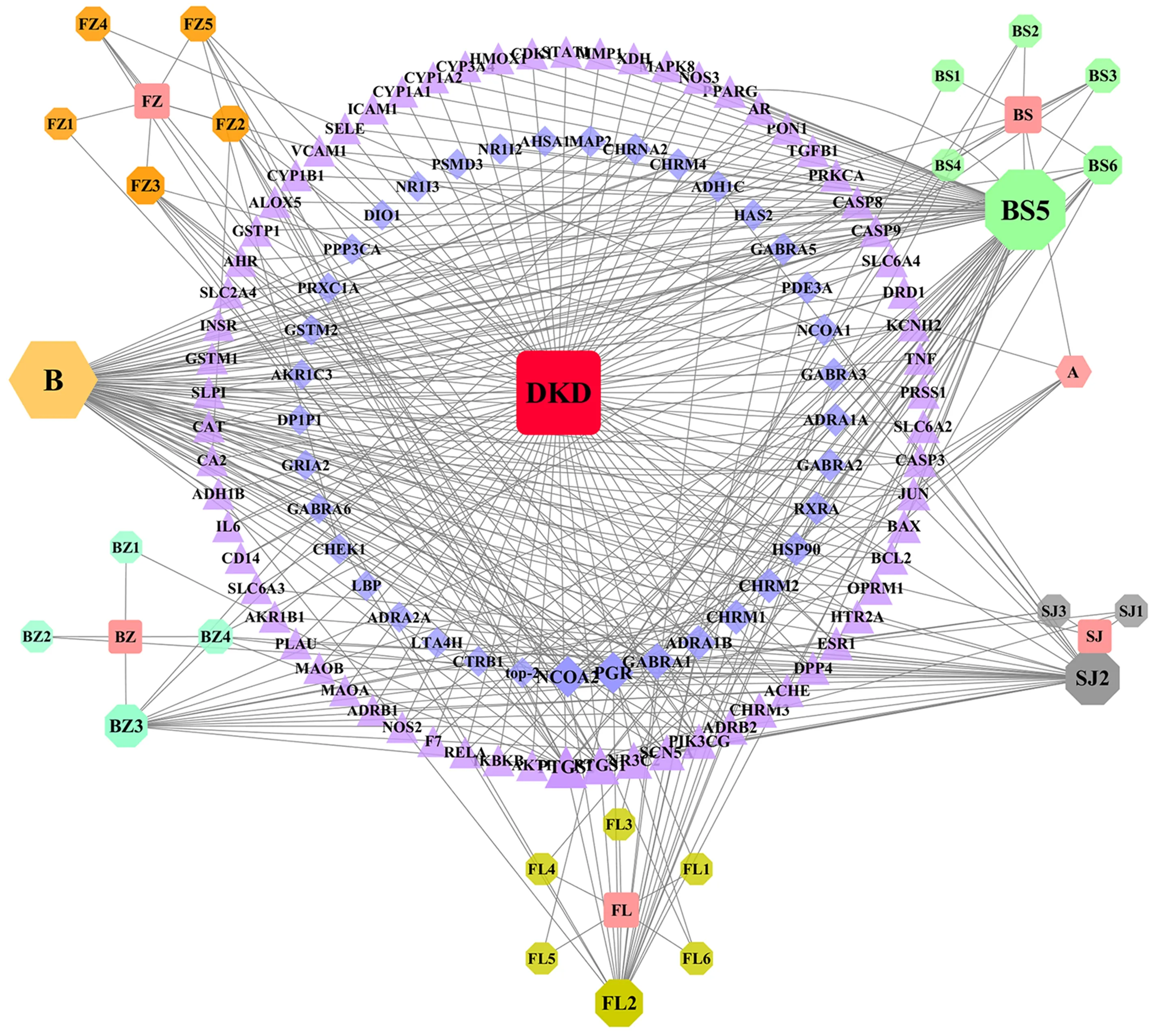
图4 真武汤成分-DKD-靶点网络图Fig4 Network of Zhenwu Tang components-DKD-targets
2.5 GO富集分析和KEGG通路分析
将上述66个靶点导入至DAVID数据库进行GO富集分析和KEGG通路分析,真武汤参与的生物过程(BP)包括药物反应、雌二醇反应、脂多糖反应等,参与膜筏、细胞膜穴样凹陷、质膜、细胞外空隙等细胞组分(CC),参与酶结合、蛋白同源二聚化、血红素结合、氧化还原酶活动等分子功能(MF),对BP、CC、MF中排名前十的条目绘制气泡图,见图5~7。KEGG通路分析最终获得100条信号通路,主要涉及hepatitis B、TNF信号通路、肿瘤信号通路等,对排名前十的条目绘制气泡图,见图8。
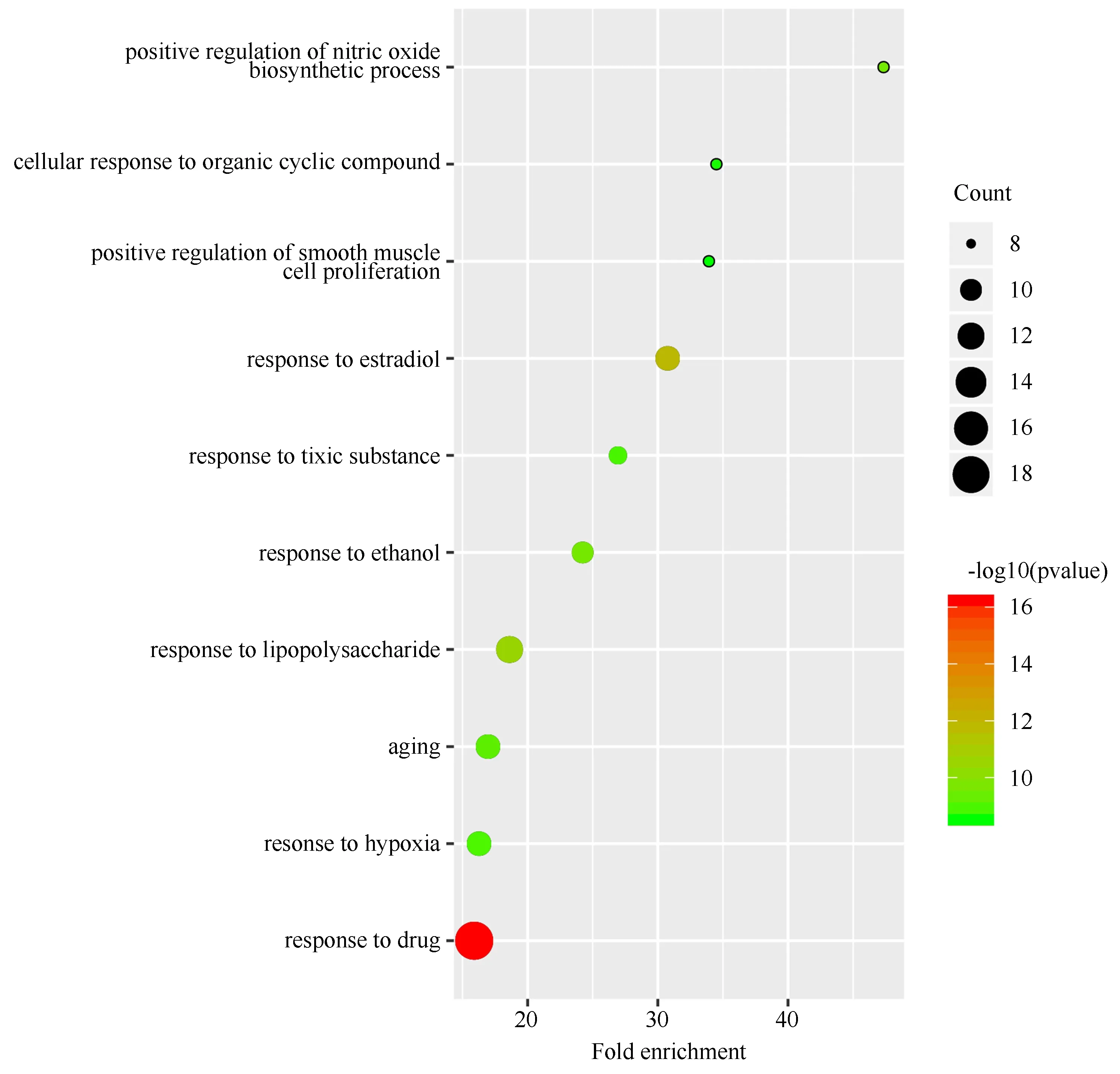
图5 GO生物过程富集分析Fig5 GO biological process enrichment analysis
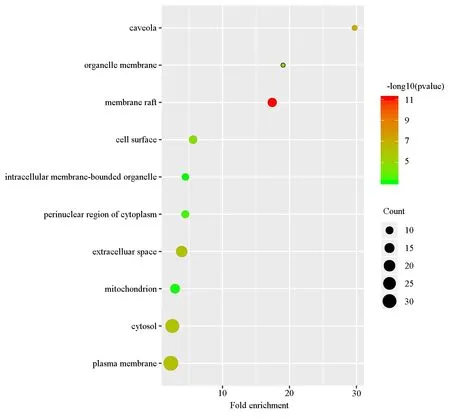
图6 GO细胞组分富集分析Fig6 GO cellular component enrichment analysis
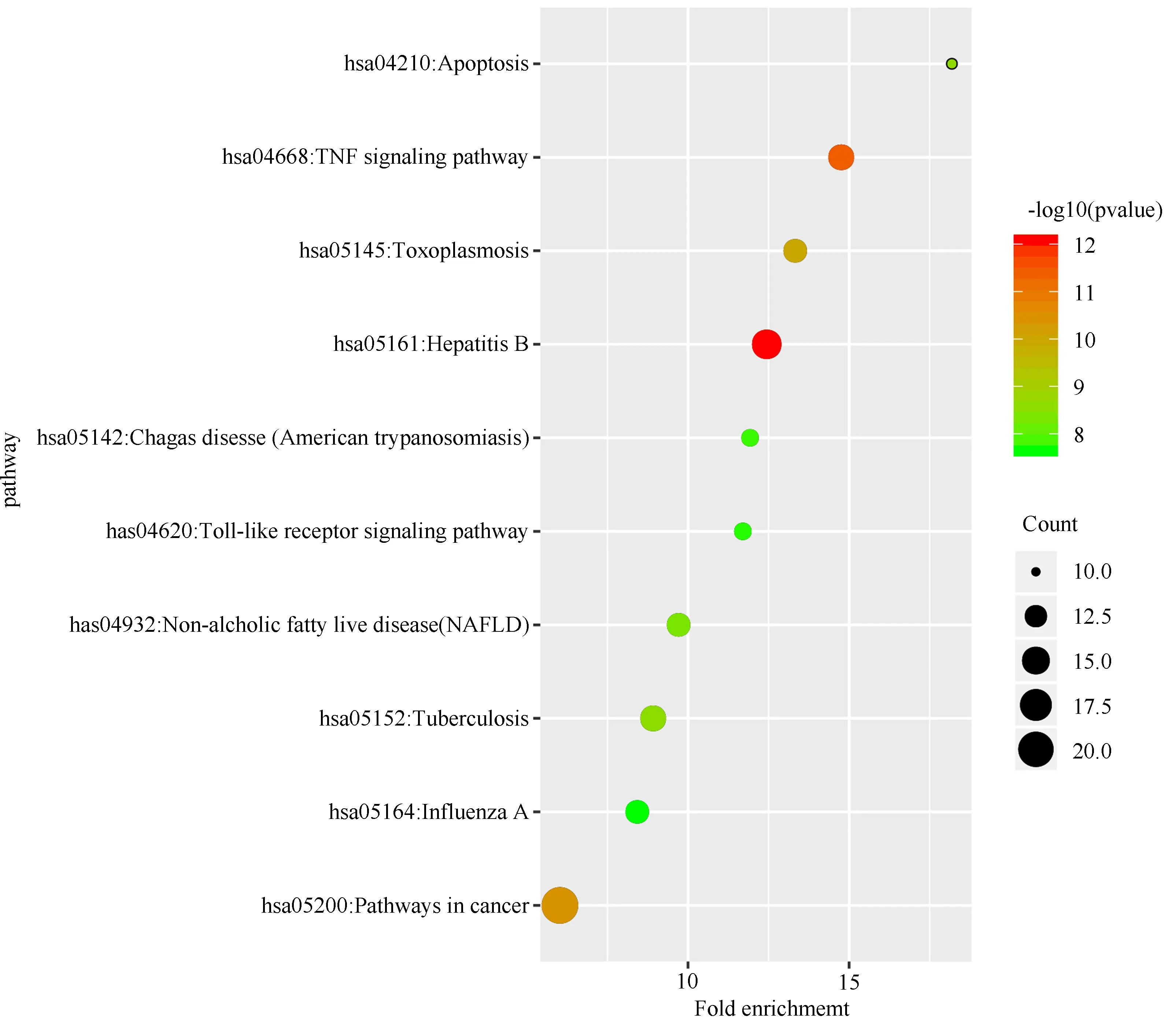
图8 KEGG通路分析Fig8 KEGG pathway analysis
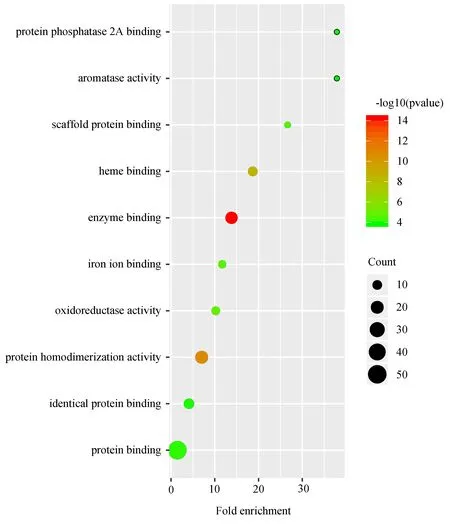
图7 GO分子功能富集分析Fig7 GO molecular function enrichment analysis
3 讨论
根据DKD的临床表现特点,中医将其归为“水肿”、“尿浊”等范畴,本病的发生多因饮食不节、情志失调、劳倦内伤、先天禀赋不足等所致,由消渴病发展而来。如《圣济总录》所言:“消渴病久,肾气受伤”、“此病久不愈,能为水肿痈疽之病”,消渴病日久伤及肾气,肾气受伤,精微不固,流失则成尿浊,水液代谢失常,犯溢肌肤又发为水肿,最终发展为消渴病肾病。本病与肺、脾、肾三脏相关,而多从脾肾立论,为本虚标实之症,以脾肾亏虚为本,瘀血、痰浊、湿热等邪气稽留为标。现代医家对DKD的认识不断发展,南征[11]认为气虚、阳虚、痰凝、气滞、瘀血等多种病理因素相互作用、互为标本,导致脏腑气机失调,阴阳失衡,其中毒邪寓于诸邪之中,为共性因素,最终提出毒损肾络是消渴肾病的病机关键。高亚斌等[12]认为内热为DKD的始动因素,内热日久伤及血分,化瘀生痰,郁结肾络,形成癥瘕,DKD的核心病机即为“内热致癥”。
真武汤可用于DKD脾肾阳虚,水湿内蕴之证,以温补脾肾之阳,化浊利水。方中以附子温肾阳,暖脾土,用为君药,使水湿得以运化。以茯苓、白术为臣药,行健脾燥湿、渗湿之功,使湿邪自小便而去。白芍为佐,《神农本草经》谓“利小便”,在此利小便以行水气,且能够制约君药附子之燥烈,舒筋缓急止痛。生姜亦能温阳散寒,以助附子散水湿。本研究通过对真武汤中5味中药活性化学成分进行分析,构建真武汤活性化学成分-疾病-靶点网络图,得到网络中关键化学成分为β-谷甾醇(β-sitosterol)、山柰酚(kaempferol)、豆甾醇(stigmasterol)、常春藤皂苷元(hederagenin)、3β-乙酰氧基苍术酮(3βacetoxyatractylone)。β-谷甾醇是一种植物固醇,与胆固醇结构相似,能够参与多种细胞信号通路进程,包括细胞的凋亡、增殖、转移、炎症等[13],且具有抗糖尿病、降血脂、抗癌等多种作用[14]。Babu等[15]实验发现β-谷甾醇与受体后胰岛素信号分子β-arrestin-2,c-Src和IRS-1以及Akt蛋白具有高亲和力,能够减弱胰岛素抵抗,减轻高脂饮食所引起的脂肪组织有害变化。豆甾醇与β-谷甾醇均为甾醇类提取物,在葡萄糖利用及肝糖原降解途径方面起到重要作用,研究表明,豆甾醇与β-谷甾醇均能够使糖异生酶及丙酮酸激酶恢复正常水平,使糖尿病大鼠的β细胞明显再生[16]。山柰酚具有抗氧化、抗炎、抗病毒、抗菌以及心脏保护等功能,是一种常见的饮食类黄酮化合物[17],研究发现山柰酚能够抑制高血糖环境下NRK-52E、RPTEC细胞中RhoA的活化并降低氧化应激反应、促炎性因子的表达以及延缓纤维化形成[18]。研究表明[19],常春藤皂苷元亦具有抗氧化、抗炎、抗血小板凝集、保肝等作用,常春藤皂苷元能够抑制IL-6、TNF-α以及COX-2等促炎细胞因子的mRNA表达,且能够通过促进AKT、ERK的激活以阻止p38MAPK的激活,参与抑制细胞凋亡进程。
根据PPI网络结果显示,本研究推测真武汤治疗DKD的关键 靶点主 要包括TNF、AKT1、IL6、PTGS2、MAPK8等。既往研究发现,DKD的发病机制与炎症因子的介导关系密切[20],本研究所得到的关键靶点中,TNF-α、IL6是参与炎症反应的炎性细胞因子,可以由脂肪细胞分泌,能够参与能量代谢、葡萄糖和脂质代谢等,在生殖、心血管以及免疫系统的调节方面起到重要作用[21]。高血糖诱导的氧化应激反应能够增加内皮细胞的损伤,增加微血管通透性,并刺激炎性细胞因子TNF-α、IL6等的分泌以促进加重炎症反应[22]。AKT1是一种丝氨酸/苏氨酸激酶,能够调节胰岛素代谢。研究表明[23,24],AKT1是PI3K/AKT通 路 的重要因 子,PI3K/Akt细胞信号通路在调节葡萄糖稳态、脂质代谢、蛋白质合成以及细胞存活等方面起到了重要作用,且胰岛素能够通过PI3K/AKT信号通路以调节胰岛B细胞功能。PTGS2是花生四烯酸转化为前列腺素的主要酶,PTGS2诱导的前列腺素合成能够刺激细胞增殖,促进血管生成,抑制细胞凋亡并且能够增加转移潜力[25]。
KEGG通路富集分析显示,真武汤调控DKD的主要通路有hepatitis B、TNF、肿瘤信号通路等,这些通路大多参与炎症反应过程。其中hepatitis B信号通路能够参与调节细胞的分化、增殖、凋亡、细胞信号级联等[26]。TNF信号通路中的TNF是一种促炎细胞因子,在调节炎症反应等方面起到了重要作用,从而影响DKD的发病机制[22]。
综上所述,本文通过网络药理学方法,系统阐述了真武汤的活性化学成分以及其治疗DKD多靶点、多通路的机制过程,为进一步探究真武汤治疗DKD的作用机制提供了理论依据。但本文仍然存在一定的局限性,本文仅依据生物信息学等数据挖掘OB≥30%,DL≥0.18 的活性化学成分,但仍有部分化学成分未纳入数据处理,且部分化学成分未在数据库中找到对应靶点。本研究仍需进行动物或细胞实验研究,以期为真武汤治疗DKD提供更为清晰的理论依据。
