从肠道菌群改变探讨青砖茶对非酒精性脂肪肝的预防作用
2021-10-16周婷婷陈桂婷曹楠何建刚何功威肖长义李世刚
周婷婷,陈桂婷,曹楠,何建刚,何功威,肖长义,,李世刚,*
从肠道菌群改变探讨青砖茶对非酒精性脂肪肝的预防作用
周婷婷1,陈桂婷1,曹楠1,何建刚2,何功威2,肖长义1,2,李世刚1,2*
1. 三峡大学医学院,湖北 宜昌 443002;2. 湖北长盛川青砖茶研究所,湖北 宜昌 443000
通过肠道菌群改变研究青砖茶(GBT)对小鼠非酒精性脂肪肝(NAFLD)的预防作用。C57BL/6小鼠随机分为5组,即正常对照组(NC),模型对照组(MC),阳性药物对照组(PC)以及青砖茶低剂量组(LD)、高剂量组(HD),高脂饲料喂养小鼠建立NAFLD模型,同时预防性给予低、高剂量青砖茶水提取物和阳性药物血脂康,分别测定小鼠的体重、食物利用率、肝重、肝指数、TC、LDL-C/HDL-C及ALT含量,HE染色和油红O染色观察肝组织病理切片,ELISA检测肝组织IL-1、IL-18含量变化,16 S rDNA V3-V4区高通量测序分析肠道菌群变化,Spearman相关性分析方法分析菌群与NAFLD表型的相关性。与模型组比较,青砖茶组小鼠体重、食物利用率、肝重、肝指数、血清TC、LDL-C/HDL-C、ALT、肝组织TC、IL-1、IL-18含量均有显著性降低,肝脏病变程度有所改善;肠道菌群分析及相关性分析显示物种丰度降低,且与NAFLD表型呈正相关,、、物种丰度增加,且与NAFLD表型呈负相关,与NAFLD表型相关性最强的菌群为和。青砖茶对NAFLD具有一定的预防作用,其作用可能与影响肠道菌群的改变有关。
肠道菌群;非酒精性脂肪肝;青砖茶;高通量测序;相关性分析
非酒精性脂肪肝(Non-alcoholic fatty liver disease,NAFLD)是指除酒精或病毒等明确的肝损伤因素引起的,以肝脏脂质蓄积和炎症反应为主要特征的营养代谢性疾病,包括单纯性脂肪变性、非酒精性脂肪性肝炎、肝纤维化、肝硬化以及肝癌[1]。目前,NAFLD全球患病率约为25%[2],随着生活水平的提高和饮食习惯的改变,特别是高脂食物的大量摄入,NAFLD发病率逐年升高,严重威胁人类健康,已成为全球主要公共卫生问题之一。
目前,NAFLD的确切发病机制尚不清楚,除了经典的“二次打击”[3]、“多重打击”学说[4]外,近年来随着深入研究,“肠-肝轴”理论得到广泛的关注,肠道和肝脏通过门静脉直接关联,肠道菌群失调会导致肠黏膜屏障受损,肠道通透性增加,肠道菌群及代谢物会转移到肝脏并引发相应的炎症免疫反应,这些反应会导致NAFLD的发生和进展[5-6]。肠道菌群与NAFLD具有一定的相关性,但与NAFLD有关的肠道菌群具体种类及其明确的相关关系仍需进一步探究。
青砖茶(Green brick tea,GBT)是中国特种黑茶,属于后发酵茶,主产于湖北省鄂南地区,是中国西北高寒地带以及高脂饮食地区少数民族人民的生活必需品[7],近年来,随着其独特的品质特征及保健功效被人们所认知,越来越多的内陆消费者开始关注、品饮青砖茶,其不仅具有生津解渴的效果,还具有抑菌、减肥、降脂、抗氧化、改善胃肠道功能等功效[8-9]。动物试验研究表明,青砖茶能有效降低大鼠血脂,改善脂质代谢,增强机体抗氧化能力,减轻高脂对肝细胞的损伤[10];临床研究显示,青砖茶可以改善2型糖尿病患者的胰岛素抵抗和血脂代谢紊乱[11],但其具体作用机理尚不清楚。本研究以高脂饮食建立小鼠NAFLD模型,研究青砖茶对NAFLD的预防作用,探讨其作用是否与肠道菌群有关,以期为青砖茶的降脂保肝作用提供一定的理论基础和试验依据。
1 材料和方法
1.1 材料
1.1.1 实验动物
SPF级C57BL/6小鼠,6~7周龄,雄性,购于三峡大学实验动物中心,动物生产许可证编号:SCXK(鄂)2017-0012。
1.1.2 药品与试剂
高脂饲料购于江苏省协同医药生物工程有限责任公司,许可证号:苏饲证(2014)01008;青砖茶水提物由湖北长盛川青砖茶研究所提供,提取率为(10±5)%;血脂康购于北京北大维信生物科技有限公司;总胆固醇(TC)、低密度脂蛋白-胆固醇(LDL-C)、高密度脂蛋白-胆固醇(HDL-C)、丙氨酸氨基转移酶(ALT)试剂盒购于北京普利莱基因技术有限公司;白介素-1(Interleukin-1,IL-1)、白介素-18(Interleukin-18,IL-18)试剂盒购于武汉伊莱瑞特生物科技股份有限公司;E.Z.N.ATMMag-Bind Soil DNA Kit购于OMEGA公司;Qubit3.0 DNA检测试剂盒购于Life公司。
1.2 试验方法
1.2.1 剂量设计
成人茶叶推荐剂量为9.0 g·d-1,成人身体质量按60 kg计,即单位体质量的茶叶推荐剂量为0.15 g·kg-1,选择人体推荐量的5、20倍为小鼠的低、高剂量[12],青砖茶的水提物提取率按10%计算,则低、高剂量分别为75、300 mg·kg-1。阳性药物血脂康剂量为成人(60 kg)每日用药10 mg·kg-1,换算为小鼠的剂量,即为90 mg·kg-1[13]。
1.2.2 分组与给药方案
60只雄性C57BL/6小鼠在试验环境下(温度20~25℃,相对湿度45%~65%及12 h/12 h光暗循环)适应性喂养1周,自由摄食和饮水。按照体重随机分为5组,即正常对照组(NC)、模型对照组(MC)、阳性药物对照组(PC)、青砖茶低剂量组(LD)、青砖茶高剂量组(HD),其中NC饲喂普通饲料,其他4组均喂高脂饲料,各组小鼠均自由饮用纯净水。采用预防模型,同时给药与饲喂高脂饲料,LD组和HD组分别灌胃75 mg·kg-1和300 mg·kg-1的青砖茶水提物(均用纯净水新鲜配制);PC组灌胃90 mg·kg-1的血脂康;NC组和MC组均灌胃等量纯净水,每只小鼠按0.01 mL·g-1灌胃,每周灌胃4次,连续14周。试验期间观察每组动物饮水、粪便、毛发、活动等情况,每周记录摄食量和体重。
1.2.3 常规指标检测
每周记录摄食量(g)和体质量(g),试验结束时称量肝脏质量(g),计算肝指数。摄食量=给食量-剩食量;食物利用率=体质量增量/总食物摄入量×100%;肝指数=肝脏质量/体质量×100%。
1.2.4 组织形态学观察
分别取小鼠肝右叶同一位置少量组织,置于4%多聚甲醛固定液中固定48 h,常规石蜡包埋,切片,用于HE染色;分别取少量小鼠肝组织,蔗糖溶液脱水,OCT包埋,冰冻切片,用于油红O染色,显微镜下观察肝组织的脂肪堆积和炎症反应情况。
1.2.5 生化指标检测
血样经4℃下3 000 r·min-1离心15 min,分离出血清样本,分装冻存于–80℃用于后续试验。称取100 mg肝组织,加入1 mL裂解液,用生物样品均质器匀浆,离心,取上清液即为肝组织匀浆上清液。血清总胆固醇(Total cholesterol,TC)、低密度脂蛋白-胆固醇(Low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白-胆固醇(High-density lipoprotein cholesterol,HDL-C)、谷丙转氨酶(Alanine transferase,ALT)和肝组织上清TC按试剂盒说明书要求进行测定。
1.2.6 肝组织IL-1、IL-18含量变化
称取一定量肝组织,按质量体积比1︰12加入预冷的PBS,再加入少量蛋白酶抑制剂,匀浆,离心,取上清液,按ELISA试剂盒说明书要求测定,IL-1、IL-18含量。
1.2.7 肠道菌群变化
每组随机选取3只小鼠,用酒精棉签刺激小鼠肛门促其排便,分别用高压灭菌后的离心管储存每只小鼠的粪便,全程保证无菌,用于16 S rDNA基因高通量测序分析。按照E.Z.N.ATMMag-Bind Soil DNA Kit试剂盒步骤提取细菌DNA,采用16 S rDNA基因V3-V4区特异性引物[341F(正向引物):CCTACGGGNGGCWGCAG,805R(反向引物):GACTACHVGGGTATCTAATCC]进行PCR扩增,PCR产物经琼脂糖电泳检测,扩增完成后进行产物纯化,利用Qubit 3.0 DNA检测试剂盒对回收的DNA精确定量,每个样品DNA量取10 ng,采用Illumina Miseq 2×300 bp平台进行高通量测序,最终上机测序浓度为20 pmol,测序数据平均为40 000条。对测序数据进行生物信息学分析,序列预处理之后得到靶区域序列,使用Usearch软件(5.2.236版本),根据97%的相似度对序列进行OTU聚类,使用R语言根据各样本OTU丰度计算多样性距离矩阵作主成分分析(Principal component analysis,PCA)图;采用RDP classifier和Blast对OTU序列进行分类学分析,比对RDP数据库(http://rdp.cme.msu.edu/misc/resources.jsp)和Silva数据库(www.arb-silva.de),从而对每个OTU进行物种分类,再利用R语言对物种注释结果进行可视化展示;利用LEfSe分析寻找组间差异菌群。
1.2.8 肠道菌群与NAFLD相关性分析
采用Spearman相关性分析方法分析肠道菌群与NAFLD表型间的相关性,其中差异菌群为LEfSe分析得到的差异菌群,NAFLD表型为血清TC、LDL-C/HDL-C、ALT、肝组织TC、IL-1、IL-18,利用R语言和Cytoscape软件作相关分析可视化热图和网络图,相关分析热图展示了按至少有一个相关性<0.05和/或至少有一个相关系数||>0.5的标准筛选后所有符合标准的数据,相关分析网络图仅展示<0.05,且||>0.5的相关菌群。
1.3 统计学处理

2 结果与分析
2.1 各组小鼠体重、食物利用率、肝指数变化
如图1所示,各组小鼠给药前体重差异不明显,经过14周喂养后,模型组体重最高,增重最多,较正常对照组差异显著(<0.01),阳性对照组次之,青砖茶低、高剂量组增重较小,与模型组比较有显著性差异(<0.01)。
各组小鼠平均进食量无明显差异,食物利用率模型组最大,而青砖茶低、高剂量组相对较小(图2-A和图2-B),说明青砖茶减轻小鼠体重不是由于减少摄食量引起的。与正常对照组比较,模型组肝重显著增加(<0.01),肝指数最大,与模型组比较,青砖茶高剂量组肝重显著降低,肝指数显著减小(<0.01,图2-C和图2-D)。试验结果说明青砖茶可以有效抑制小鼠体重和肝重的增加,以及肝指数增大。
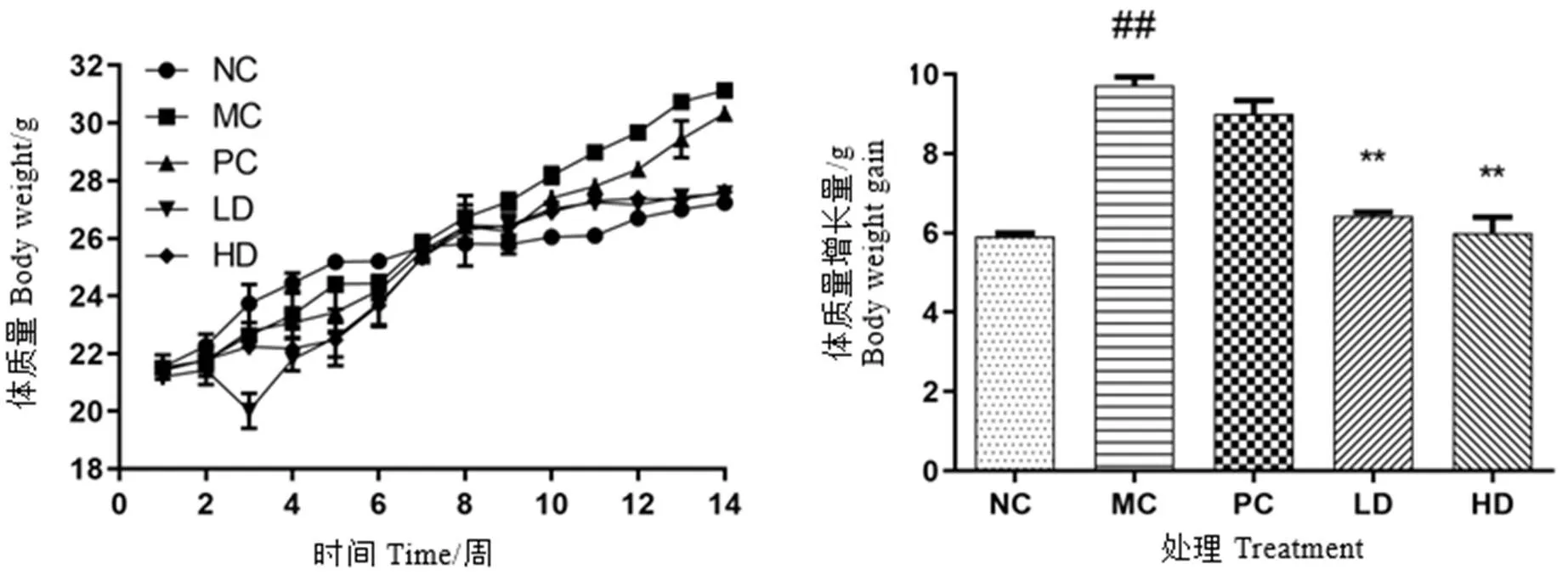
注:NC:正常对照组,MC:模型对照组,PC:阳性药物对照组(血脂康90 mg·kg-1),LD:青砖茶低剂量组(75 mg·kg-1),HD:青砖茶高剂量组(300 mg·kg-1)。n=8,±SD,与正常对照组比较,#P<0.05,##P<0.01;与模型对照组比较,*P<0.05,**P<0.01。下同
2.2 各组小鼠肝组织病理切片
HE染色结果(图3)显示,正常对照组小鼠的肝细胞界限分明,细胞核清晰,胞浆均匀,肝索排列整齐,肝窦结构清晰;模型组小鼠的肝细胞大小不一,细胞界限不清,部分细胞出现肿胀,肝索排列出现紊乱,肝窦变小,肝细胞胞浆有圆形空泡,同时伴有炎症浸润;阳性药物组小鼠及青砖茶干预组小鼠肝脏病理有不同程度改善。油红O染色结果(图4)显示,模型组小鼠肝组织有大量脂滴存在,阳性药物及青砖茶干预组有所改善。这些结果表明高脂饮食可以引起小鼠肝细胞脂肪变性和炎症,青砖茶可有效预防高脂饮食诱导的脂肪肝的发生。
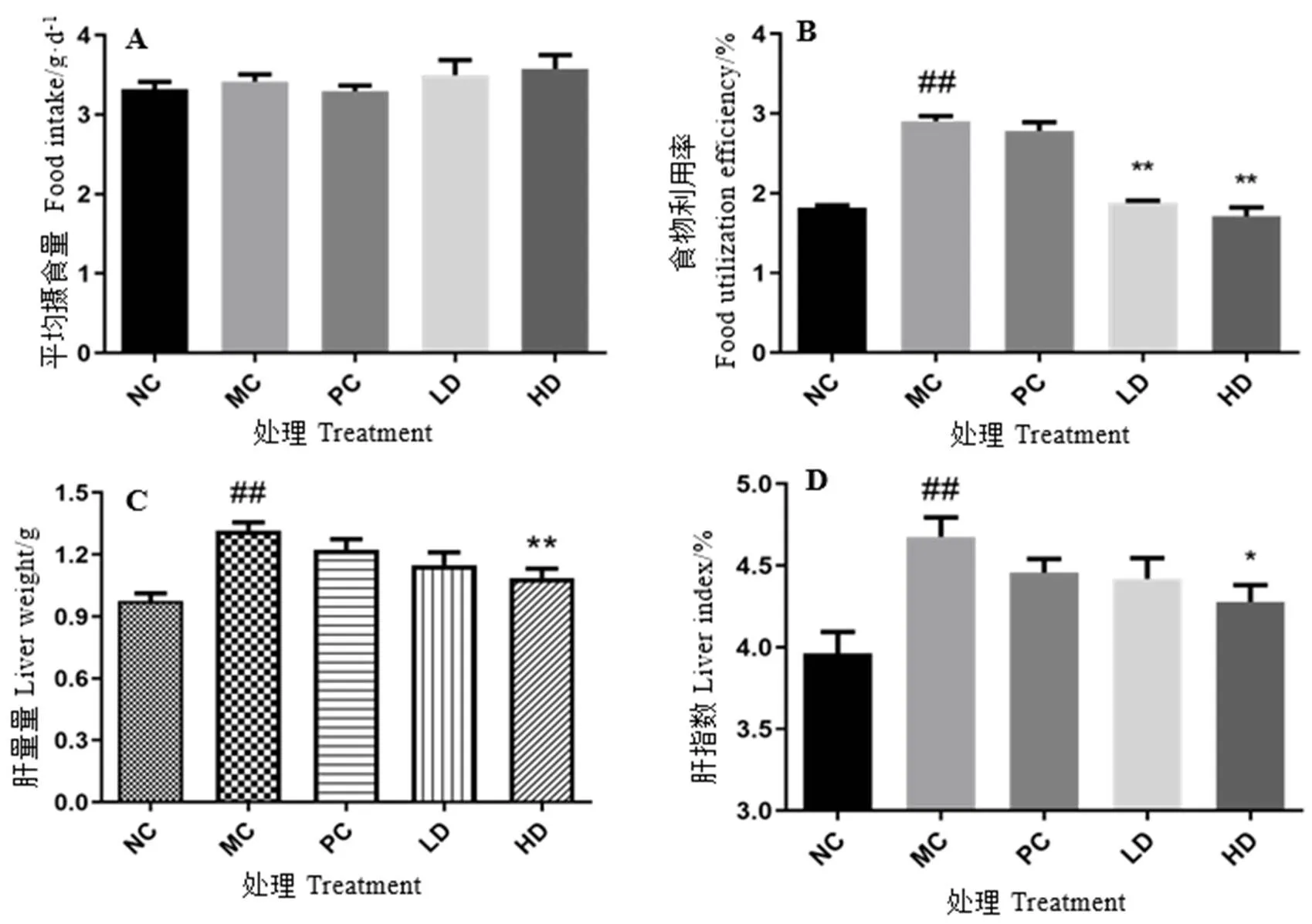
图2 各组小鼠食物利用率和肝指数
2.3 各组小鼠生化指标变化
如图5和图6所示,与正常对照组比较,模型组小鼠血清TC、LDL-C、ALT和肝组织TC含量均显著增高(<0.01),HDL-C含量有所降低,但无统计学意义(>0.05),而LDL-C/HDL-C显著性增高(<0.01);与模型组比较,阳性药物组小鼠血清TC显著性降低(<0.05),LDL-C/HDL-C、肝组织TC水平极显著性降低(<0.01),青砖茶干预组小鼠血清TC、LDL-C/HDL-C、ALT和肝组织TC含量均极显著性降低(<0.01)。这些结果表明,青砖茶能有效调节小鼠的脂质代谢平衡,降低血脂,改善高脂小鼠的肝功能,减轻肝组织受损的程度。
2.4 各组小鼠肝组织IL-1β、IL-18含量变化
由图7可见,与正常对照组比较,模型组小鼠肝组织IL-1、IL-18含量均极显著增高(<0.01);与模型组比较,阳性药物组及青砖茶干预组上述指标均极显著降低(<0.01)。结果表明,14周高脂饮食可以引起小鼠肝脏产生炎症,青砖茶可有效改善炎症的发生。
2.5 肠道菌群变化分析
通过对各组小鼠粪便中的16 S rDNA基因V3-V4区进行高通量测序,主成分分析结果显示青砖茶干预组小鼠肠道菌群的整体分布与模型组小鼠明显不同(图8)。基于分类学分析结果,青砖茶干预组小鼠肠道菌群结构和丰度与模型组小鼠有明显区别(图9和图10)。LEfSe分析结果显示,属水平差异菌群有4种,即、、和(图11),其中,与正常对照组比较,模型组小鼠物种丰度增加,、、物种丰度降低;与模型组比较,干预组小鼠物种丰度降低,、、物种丰度增加(图12)。

图4 油红O染色结果(×400)
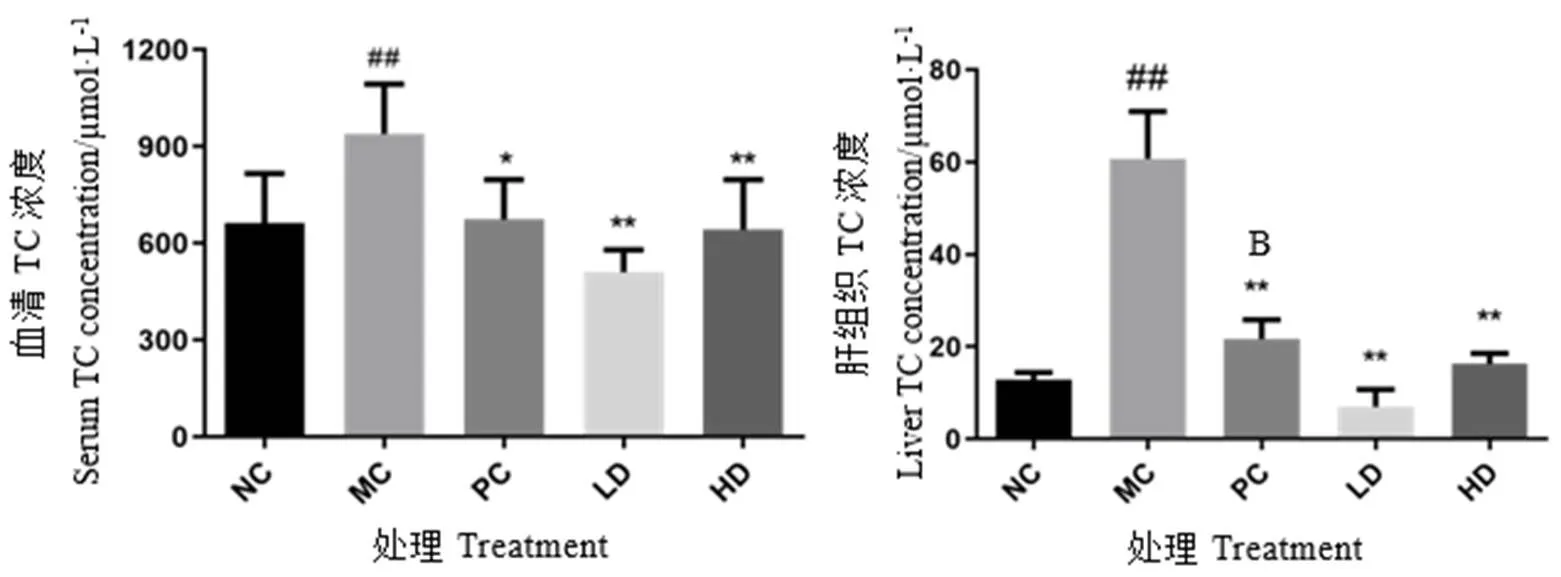
图5 血清和肝组织中TC浓度变化
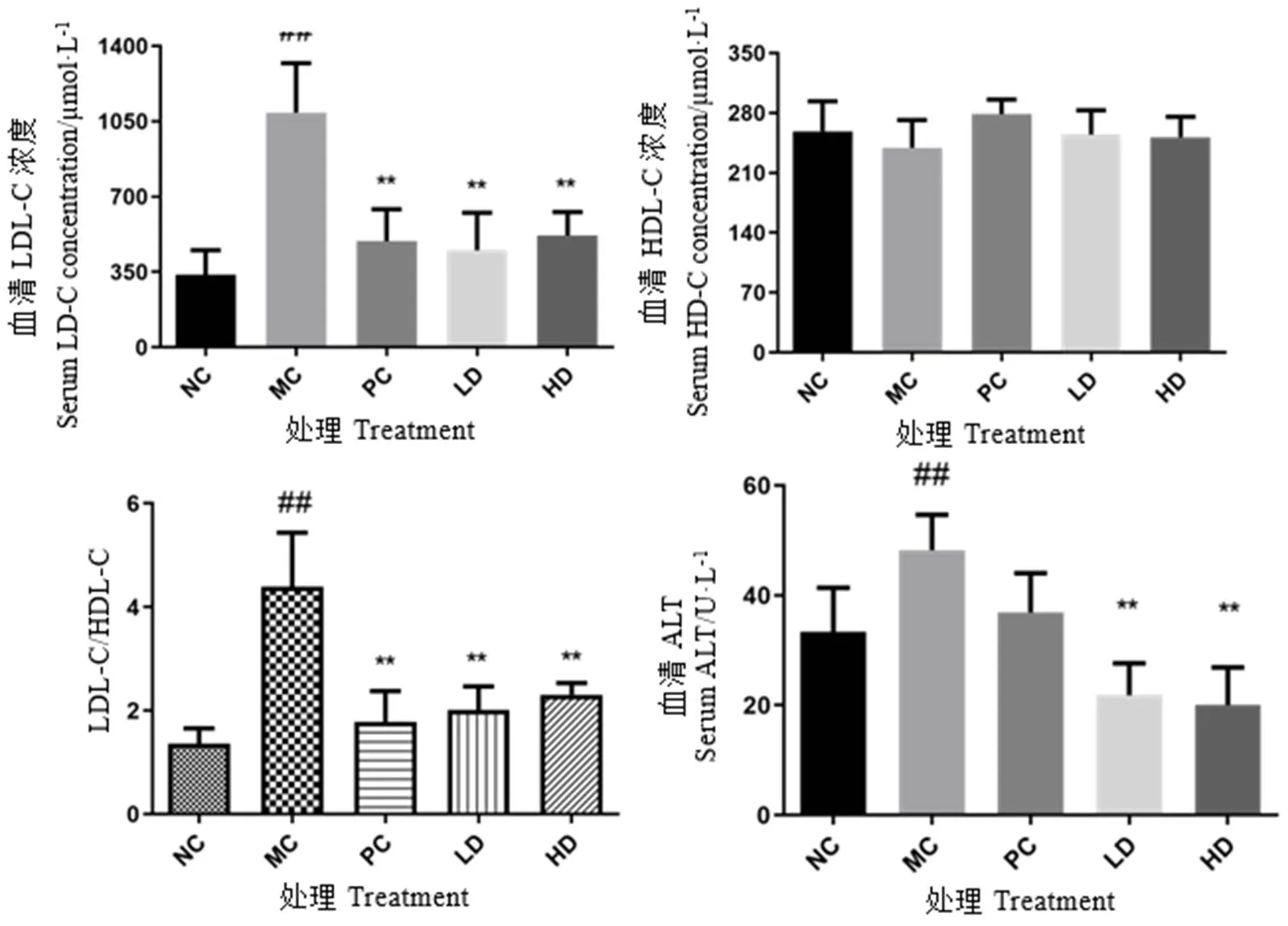
图6 血清中LDL-C/HDL-C和ALT变化

图7 肝组织中IL-1β和IL-18含量变化

图8 主成分分析3D图和2D图
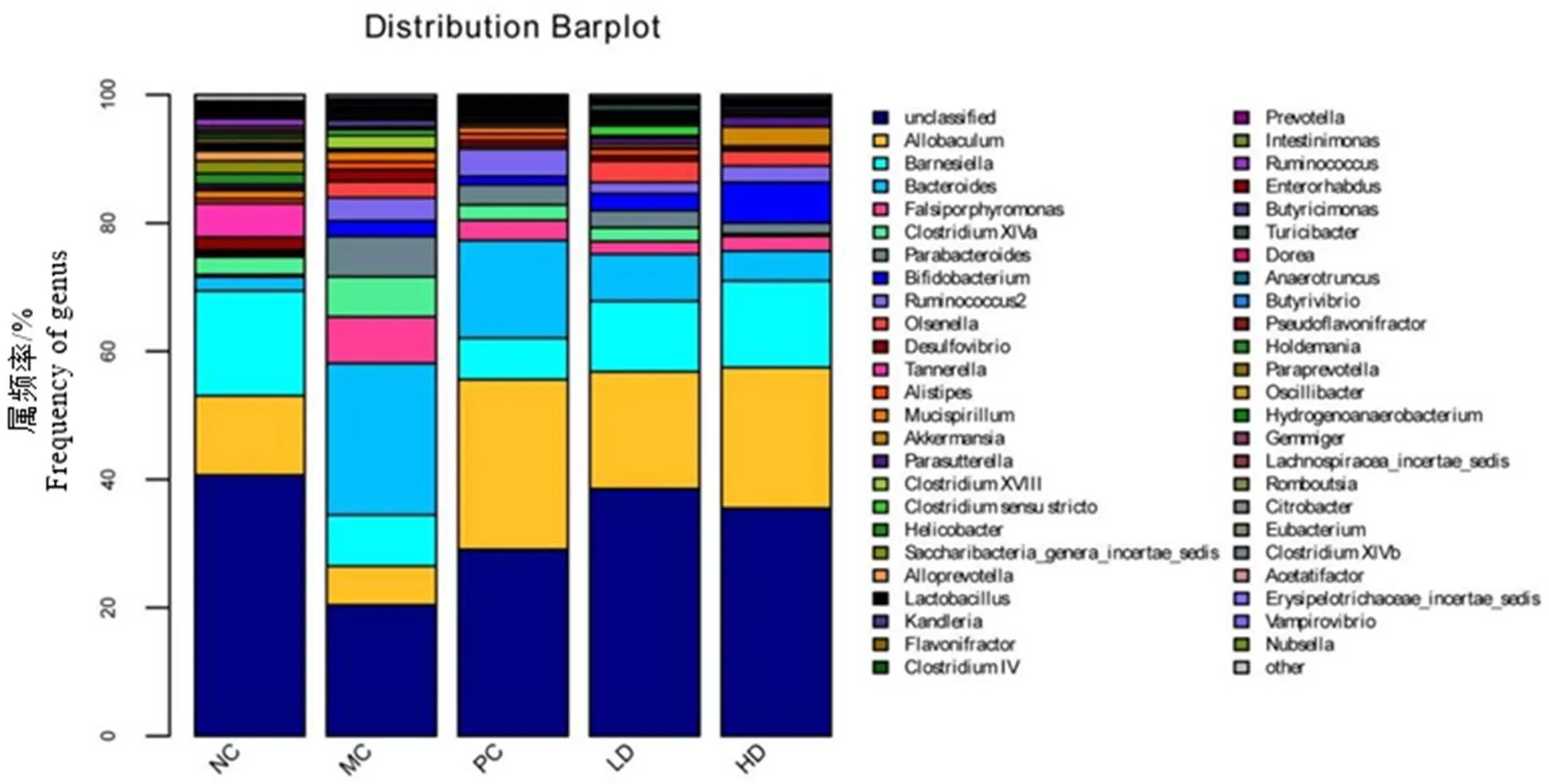
图9 属水平各组群落结构分布图

图10 属水平物种丰度热图

图11 LEfSe分析环形树状图
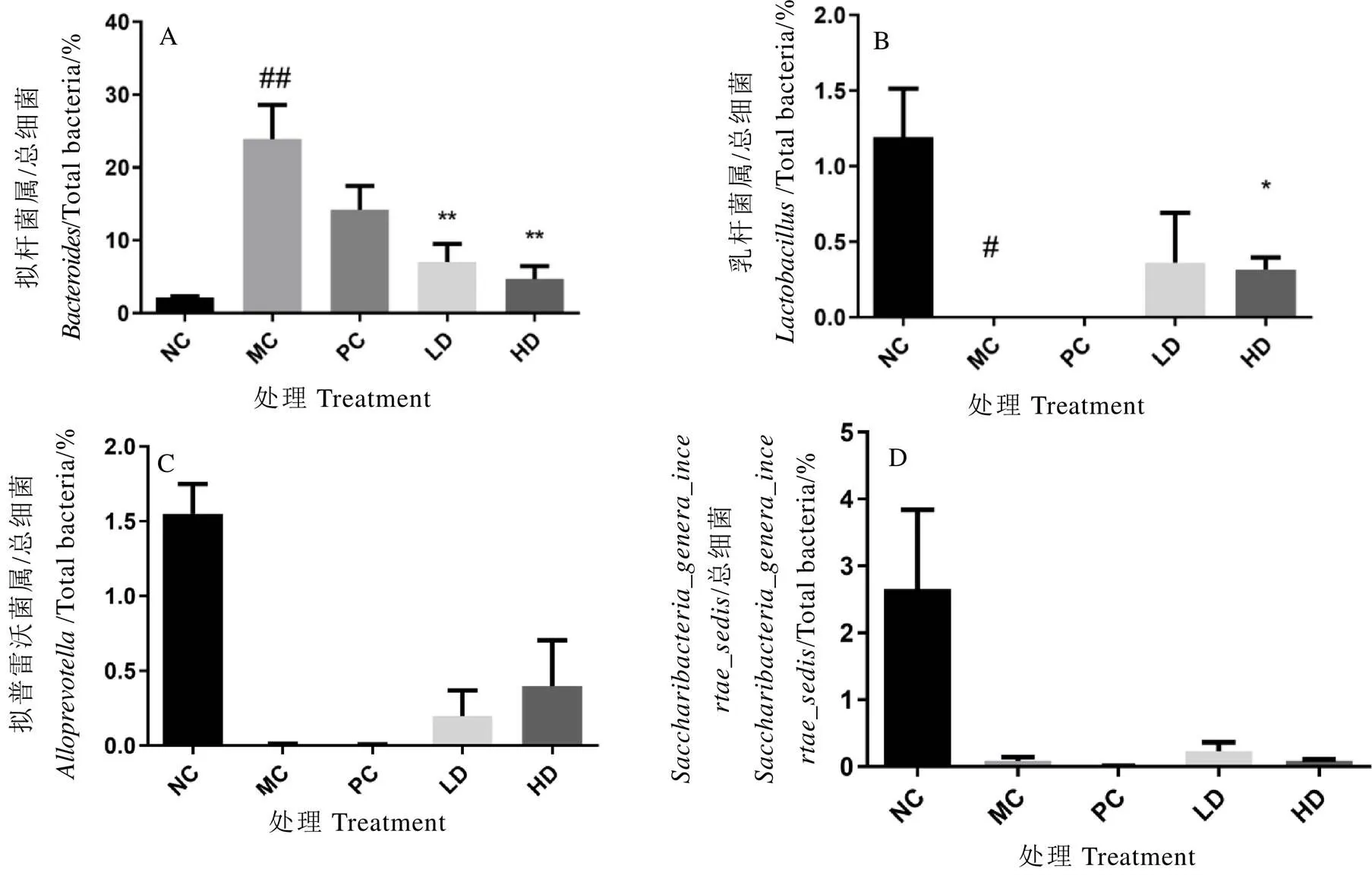
注:n=3,±SD。与正常对照组比较,#P<0.05,##P<0.01;与模型对照组比较,*P<0.05,**P<0.01。A:各组小鼠拟杆菌属菌群丰度变化,B:各组小鼠乳杆菌属菌群丰度变化,C:各组小鼠拟普雷沃菌属菌群丰度变化,D:各组小鼠Saccharibacteria_genera_incertae_sedis菌群丰度变化
2.6 肠道菌群变化与NAFLD表型相关性分析
肠道菌群与NAFLD表型相关分析可视化结果见图13和图14,NAFLD表型与呈正相关,与、、呈负相关,其中,相关性最强的菌群为和。
3 讨论
NAFLD为非酒精因素引起的肝脏代谢综合征,常以高脂饮食诱导动物模型模拟人类NAFLD发病机制。本课题组前期体外研究发现青砖茶对HepG2细胞脂肪变性具有改善作用[14],在此基础上,本研究以14周高脂饮食诱导小鼠NAFLD模型并予以青砖茶干预,试验结果显示,模型组小鼠体重、肝重均显著性升高,食物利用率、肝指数最大,病理切片显示脂肪堆积和炎症浸润,血清TC、LDL-C/HDL-C、ALT、肝组织TC、IL-1、IL-18含量均有显著性升高,表明模型组造模成功,而青砖茶干预组小鼠体重、肝重均有显著性降低,食物利用率、肝指数较小,肝脏脂质沉积与炎症反应有所改善,血清TC、LDL-C/HDL-C、ALT、肝组织TC、IL-1、IL-18含量均有显著性降低,说明青砖茶可有效预防NAFLD的发生及进展。

图13 相关分析热图
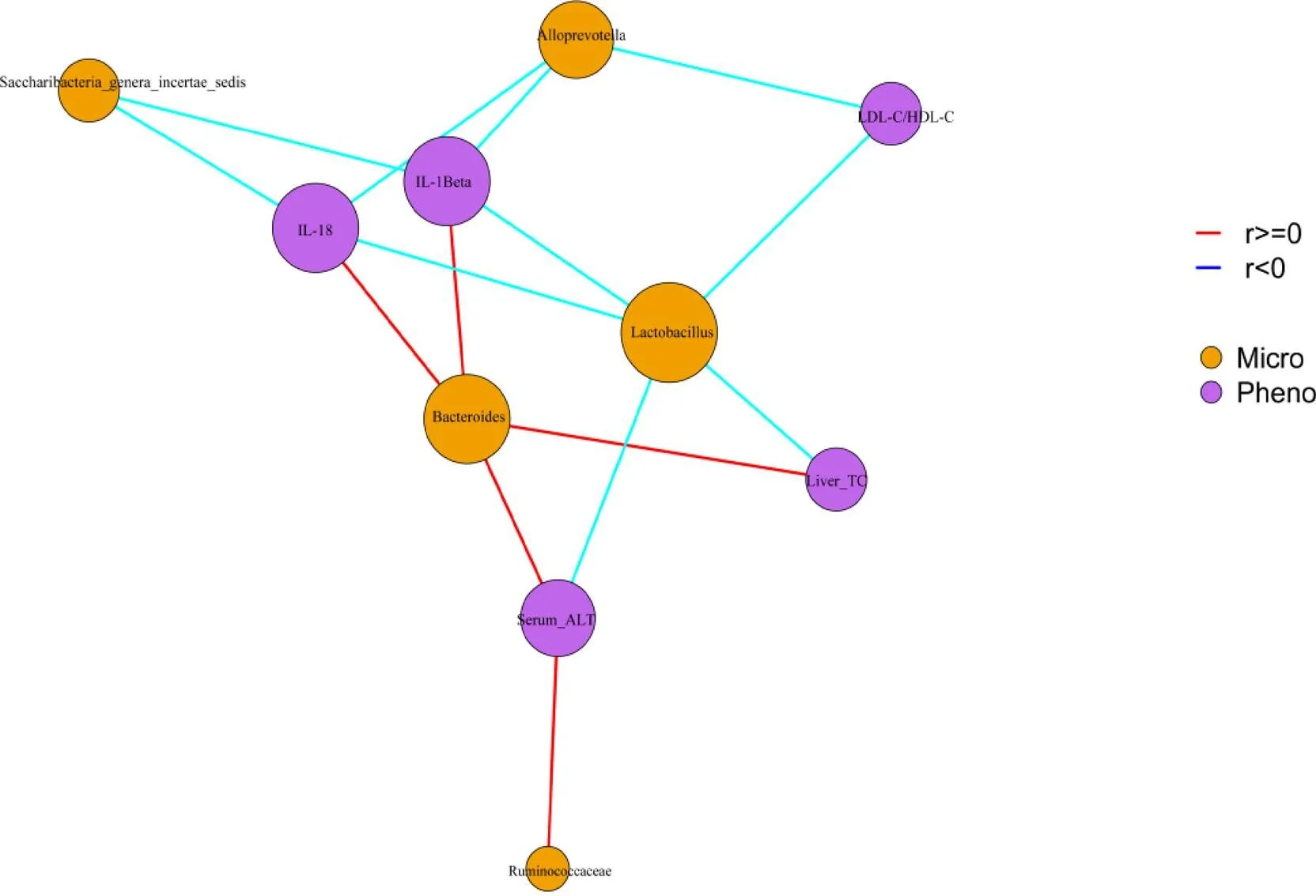
图14 相关分析网络图
目前,NAFLD确切发病机制尚不清楚。近年来肠道菌群成为研究热点,作为与宿主存在共生关系包含1 000~1 500种约10~100万亿细菌的复杂生态系统,约为人体基因组的150倍,人类肠道菌群主要包括厚壁菌、拟杆菌、放线菌以及少量的变形杆菌[15-16]。正常情况下,菌群间、菌群与宿主间存在一个动态平衡,当平衡出现紊乱,就会引起多种疾病的发生,越来越多文献报道肠道菌群与NAFLD有关[17-18]。解剖结构上肠道和肝脏通过门静脉直接关联,肠道菌群紊乱会直接影响肝脏,即通过“肠-肝轴”促进NAFLD的发生和进展[19]。本研究探究与NAFLD相关的肠道菌群以及青砖茶对其的影响,结果显示,模型组小鼠肠道菌群的结构和丰度与正常对照组比较有明显不同,而青砖茶可有效调节小鼠肠道菌群的变化,使之趋于正常对照组,分析找到4种属水平差异菌群,其中,模型组物种丰度增加,、、物种丰度降低,而青砖茶干预组物种丰度降低,、、物种丰度增加。4种属水平差异菌群与NAFLD表型作相关分析显示,与NAFLD表型正相关,、、与NAFLD表型呈负相关,其中,相关性最强的菌群为和。有研究报道,与健康个体相比,NAFLD患者中拟杆菌数量增加,厚壁菌数量减少[20],另有研究表明,摄取乳酸杆菌,如嗜酸乳杆菌、发酵乳杆菌和植物乳杆菌,可以通过降低胆固醇来改善非酒精性脂肪变性的发展[21],本试验研究结果与这些相关研究报道一致。
肠道菌群促进NAFLD发展的机制主要包括:(1)肠道菌群紊乱会导致机体对游离脂肪酸的吸收增加及产热减少,最终引起储存的脂肪量增加,引起肥胖;(2)肠道菌群紊乱会改变肠道黏膜通透性,有害菌尤其是革兰氏阴性菌增多,引起脂多糖-内毒素-TLRs介导炎症反应;(3)肠道菌群通过其代谢产物介导NAFLD:如增加短链脂肪酸;参与胆碱代谢;调节胆汁酸代谢;增加内源性乙醇量等[22-24]。本课题后期试验将研究肠道菌群代谢产物胆汁酸与NAFLD的关系,探究肠道菌群的改变引起的代谢产物胆汁酸产生的变化与NAFLD的内在联系。
总之,本研究发现肠道菌群与NAFLD表型呈正相关,与NAFLD表型呈负相关,青砖茶干预后物种丰度降低,物种丰度增加,青砖茶通过影响肠道菌群变化对NAFLD具有一定的预防作用,这为青砖茶的实际应用提供了一定的试验依据,然而这些差异菌群参与NAFLD的发病机制还需通过更多的动物及临床粪便移植研究进一步验证,以期肠道菌群作为代谢性疾病潜在的诊断工具和治疗靶点成为现实。
[1] Mantovani A, Dalbeni A. Treatments for NAFLD: state of art [J]. Int J Mol Sci, 2021, 22(5): 2350. doi: 10.3390/ijms22052350.
[2] Huang D Q, El-Serag H B, Loomba R. Global epidemiology of NAFLD-related HCC: trends, predictions, risk factors and prevention [J]. Nat Rev Gastroenterol Hepatol, 2021, 18(4): 223-238.
[3] Day C P, James O F. Steatohepatitis: a tale of two "hits"? [J]. Gastroenterology, 1998, 114(4): 842-845.
[4] Buzzetti E, Pinzani M, Tsochatzis E A. The multiple-hit pathogenesis of non-alcoholic fatty liver disease (NAFLD) [J]. Metabolism, 2016, 65: 1038-1048.
[5] Borrelli A, Bonelli P, Tuccillo F M, et al. Role of gut microbiota and oxidative stress in the progression of non-alcoholic fatty liver disease to hepatocarcinoma: current and innovative therapeutic approaches [J]. Redox Biol, 2018, 15: 467-479.
[6] Tripathi A, Debelius J, Brenner D A, et al. The gut-liver axis and the intersection with the microbiome [J]. Nat Rev Gastroenterol Hepatol, 2018, 15(7): 397-411.
[7] 卢素芳, 郑鹏程, 刘盼盼, 等. 青砖茶研究进展[J]. 茶叶学报, 2018, 59(3): 162-167.
Lu S F, Zheng P C, Liu P P, et al. Research progress on Qingzhuan tea [J]. Acta Tea Sinica, 2018, 59(3): 162-167.
[8] 张伟. 青砖茶对实验大鼠的减肥和调节血脂作用及其机制研究[D]. 武汉: 华中农业大学, 2009.
Zhang W. Studies on anti-obesity, blood lipid regulation effects and mechanisms of dark brick tea on rats [D]. Wuhan: Huazhong Agricultural University, 2009.
[9] 何建刚, 李世刚, 肖长义, 等. 青砖茶的抗氧化作用研究[J]. 农技服务, 2016, 33(3): 94-95.
He J G, Li S G, Xiao C Y, et al. Research on antioxidant effect of Qingzhuan tea [J]. Agricultural Technology Service, 2016, 33(3): 94-95.
[10] 陈玉琼, 张伟, 倪德江, 等. 湖北青砖茶辅助降血脂作用及其抗氧化效果[J]. 茶叶科学, 2010, 30(2): 124-128.
Chen Y Q, Zhang W, Ni D J, et al. Study on the hypolipidemic effect and antioxidative activity of Hubei Qingzhuan tea [J]. Journal of Tea Science, 2010, 30(2): 124-128.
[11] 刘云涛, 何建刚, 肖长义, 等. 湖北长盛川青砖茶对2型糖尿病合并血脂异常患者胰岛素抵抗、血脂的影响[J]. 中国老年学杂志, 2019, 39(6): 1317-1320.
Liu Y T, He J G, Xiao C Y, et al. Effects of Hubei Changshengchuan green brick tea on insulin resistance and blood lipid in type 2 diabetes patients with dyslipidemia [J]. Chinese Journal of Gerontology, 2019, 39(6): 1317-1320.
[12] 王蝶, 黄建安, 叶小燕, 等. 茯砖茶减肥作用研究[J]. 茶叶科学, 2012, 32(1): 81-86.
Wang D, Huang J A, Ye X Y, et al. The anti-obesity effects of Fuzhuan brick tea on high-fat-diet induced obesity in rats [J]. Journal of Tea Science, 2012, 32(1): 81-86.
[13] 赵伟, 孙国志. 不同种实验动物间用药量换算[J]. 畜牧兽医科技信息, 2010(5): 52-53.
Zhao W, Sun G Z. Conversion of dosage between different kinds of experimental animals [J]. Chinese Journal of Animal Husbandry and Veterinary Medicine, 2010(5): 52-53.
[14] 余婕, 闫梦真, 陈桂婷, 等. 青砖茶水提物对HepG2细胞脂肪变性的干预作用[J]. 三峡大学学报(自然科学版), 2020, 42(2): 107-112.
Yu J, Yan M Z, Chen G T, et al. Intervention effect of water extract of green brick tea on steatosis of HepG2 cells [J]. Journal of China Three Gorges University (Natural Sciences), 2020, 42(2): 107-112.
[15] Pierantonelli I, Svegliati-Baroni G. Nonalcoholic fatty liver disease: basic pathogenetic mechanisms in the progression from NAFLD to NASH [J]. Transplantation, 2019, 103(1): e1-e13.
[16] Safari Z, Gérard P. The links between the gut microbiome and non-alcoholic fatty liver disease (NAFLD) [J]. Cell Mol Life Sci, 2019, 76(8): 1541-1558.
[17] Fan Y, Pedersen O. Gut microbiota in human metabolic health and disease [J]. Nat Rev Microbiol, 2021, 19(1): 55-71.
[18] Suk K T, Kim D J. Gut microbiota: novel therapeutic target for nonalcoholic fatty liver disease [J]. Expert Rev Gastroenterol Hepatol, 2019, 13(3): 193-204.
[19] Milosevic I, Vujovic A, Barac A, et al. Gut-liver axis, gut microbiota, and its modulation in the management of liver diseases: a review of the literature [J]. Int J Mol Sci, 2019, 20(2): 395. doi: 10.3390/ijms20020395.
[20] Zhu L, Baker S S, Gill C, et al. Characterization of gut microbiomes in nonalcoholic steatohepatitis (NASH) patients: a connection between endogenous alcohol and NASH [J]. Hepatology, 2013, 57(2): 601-609.
[21] Lee N Y, Shin M J, Youn G S, et al. Lactobacillus attenuates progression of nonalcoholic fatty liver disease by lowering cholesterol and steatosis [J]. Clin Mol Hepatol, 2021, 27(1): 110-124.
[22] Bashiardes S, Shapiro H, Rozin S, et al. Non-alcoholic fatty liver and the gut microbiota [J]. Mol Metab, 2016, 5(9): 782-794.
[23] Kolodziejczyk A A, Zheng D, Shibolet O, et al. The role of the microbiome in NAFLD and NASH [J]. EMBO Mol Med, 2019, 11(2): e9302. doi: 10.15252/emmm.201809302.
[24] Leung C, Rivera L, Furness J B, et al. The role of the gut microbiota in NAFLD [J]. Nat Rev Gastroenterol Hepatol, 2016, 13(7): 412-425.
Preventive Effect of Green Brick Tea on Non-alcoholic Fatty Liver Disease via Gut Microbiota Changes
ZHOU Tingting1, CHEN Guiting1, CAO Nan1, HE Jiangang2,HE Gongwei2, XIAO Changyi1,2, LI Shigang1,2*
1. Medical College of China Three Gorges University, Yichang 443002, China; 2. Changshengchuan Green-brick Tea Research Institute of Hubei Province, Yichang 443000, China
The preventive effect of green brick tea (GBT) on the mouse non-alcoholic fatty liver disease (NAFLD) model was studied by affecting changes in gut microbiota.C57BL/6 mice were randomly divided into 5 groups, including normal control group (NC), model control group (MC), positive drug control group (PC), low-dose group (LD) and high-dose group (HD) of GBT. A NAFLD model was established by feeding mice with high-fat diet, and supplemented with low and high doses of GBT water extract and positive drug (Xuezhikang) respectively. The body weight, food utilization efficiency, liver weight, liver index, TC, LDL-C/HDL-C and ALT contents of mice were determined. Liver tissue pathological sections were observed by HE staining and Oil Red O staining. ELISA method was used to detect changes of IL-1and IL-18 in liver tissue. The changes of gut microbiota were analyzed by high-throughput sequencing in 16 S rDNA V3-V4 region, and Spearman's correlation analysis method was used to analyze the correlation between gut microbiota and NAFLD phenotype. Compared with the model control group, the body weight, food utilization efficiency, liver weight, liver index, serum TC, LDL-C/HDL-C, ALT, liver tissue TC, IL-1, and IL-18 contents of mice in the GBT group were significantly reduced, and the degree of liver disease was improved. Gut microbiota analysis and correlation analysis show that the species abundance ofdecreased, and it was positively correlated with the NAFLD phenotype. The species abundance of,, andincreased, and they were negatively correlated with the NAFLD phenotype.andhad the strongest correlation with NAFLD phenotype.Green brick tea has a certain preventive effect on NAFLD, and its effect may be related to the changes in gut microbiota.
gut microbiota, NAFLD, green brick tea, high-throughput sequencing, correlation analysis
S571.1;Q946.84+1
A
1000-369X(2021)05-669-12
2021-02-05
2021-04-23
湖北省区域创新发展科技专项(2020BGC015)、宜昌市科技研究与开发项目(A21-1-075)、三峡大学学位论文培优基金资助项目(2020SSPY112)
周婷婷,女,硕士,主要从事中药有效性与安全性评价方面的研究。*通信作者:fox201@163.com
(责任编辑:赵锋)
