纳米硅酸镁锂-壳聚糖-海藻酸钠复合支架材料的制备与性能
2021-10-15王明霞刘志辉李凌锋王博蔚
王明霞,刘志辉,朱 镇,李凌锋,王博蔚
(1.吉林大学第二医院,长春130021;2.吉林大学口腔医院,长春130021;3.镇江市口腔医院,镇江212001)
由于外伤、炎症、肿瘤切除术、先天性骨骼发育畸形、骨再生异常、伴随人口老龄化或全身疾病出现的骨萎缩和骨质疏松等都会导致临床骨缺损[1].随着再生医学的进步与组织工程学的发展,骨组织工程开始被广泛研究[2].支架材料作为骨组织工程中的关键角色,既为种子细胞和各种细胞因子提供了载体,又为新生骨组织生长营造了局部微环境,为细胞的黏附、增殖和组织的生长提供支持[3],进而构建出作为缺损骨组织替代物的细胞-支架-生物因子复合体.本文将纳米硅酸镁锂(nLMS)、壳聚糖(CS)和海藻酸钠(SA)3种材料混合,制备了一种新型的nLMS-CS-SA复合支架材料,分析了其微观形态与三维立体结构,检测其溶胀率、孔隙率和降解速度,并通过与L929细胞体外共培养评价其生物相容性,探讨了在nLMS-CS-SA复合支架材料中改变纳米硅酸镁锂的含量对其理化性能和生物性能产生的影响.
1 实验部分
1.1 试剂与仪器
壳聚糖购自国药集团化学试剂有限公司(脱乙酰度80.0%~95.0%,平均相对分子量10000);海藻酸钠(12~20 cp)购自美国Sigma公司;纳米硅酸镁锂购自上海源叶公司;无水乙醇和磷酸盐缓冲液(PBS)购自北京化工厂;L929细胞系由吉林大学口腔实验中心提供;H-DMEM培养基购自Hyclone公司;小牛血清购自Clark公司;胰酶购自北京鼎国昌盛公司;CCK-8试剂盒购自三邦医药公司.
CO2培养箱购自日本SANYO公司;真空冷冻干燥机购自北京博医康公司;S-4800型扫描电子显微镜(SEM,束流:20 μA,电子加速电压:5.0 kV,放大倍数:100倍和200倍)和E-1010型离子溅射仪购自日本Hitachi公司;酶标检测仪购自美国Bio-TEK公司;ALPHA型傅里叶变换红外光谱仪(FTIR)购自德国Bruker公司(检测范围:600~4000 cm−1,分辨率:4 cm−1);AG-X型电子万能试验机购自日本岛津公司.
1.2 nLMS-CS-SA复合支架材料的制备
1.2.1 各组分水溶液的配制分别将1,2,3和4 g nLMS粉末充分溶解于100 mL去离子水中,制备质量分数为1%,2%,3%,4%的nLMS溶液;将4 g SA充分溶解于100 mL去离子水中,制备质量分数为4%的SA溶液;将6 g CS充分溶解于100 mL质量分数为2%的冰醋酸溶液中,制得质量分数为6%的CS溶液.
1.2.2 nLMS-CS-SA复合支架材料的制备将4 mL 1%(或2%,3%,4%)的nLMS溶液加入至12 mL 6%
的CS溶液中,于500 r/min转速下搅拌30 min;将5 mL混合液在200 r/min转速下缓慢加入到20 mL 4%的SA溶液中,用质量分数为4%的NaOH溶液调节体系pH值为7.0±0.5,反应完成后即制得透明凝胶状复合材料;在100 W功率下超声振荡30 min后,于4℃冰箱中静置2 h以排除气泡.将上述凝胶状材料按2.5 mL/孔的量加入24孔板中,放入−20℃冰箱冷冻24 h后再于−80℃冰箱冷冻24 h;然后置于冻干机中干燥24 h,即制得含有不同质量分数的nLMSH的nLMS-CS-SA多孔复合支架材料,记为xnLMSCS-SA(其中x代表所用nLSM溶液的质量分数).
1.3 性能表征
1.3.1 溶胀率的测定称量各组复合支架材料,记为m0(g);将材料完全浸泡于PBS中0.5 h后用湿滤纸拭去表面水分并称量其湿重,并记为mt(g);于1,2,3,4,12,24和48 h重复上述操作,记录每次测量时的质量变化.每组样品设置3个平行检测组.按下式计算nLMS-CS-SA复合支架材料的溶胀率:

1.3.2 孔隙率的测定将烧杯内装满无水乙醇并称重,记为m1(g);将经过充分冻干的质量为m0(g)的nLMS-CS-SA复合支架材料完全浸入其中,待完全浸透后再加满无水乙醇称重,记录为m2(g);将样品取出后剩余的无水乙醇和烧杯质量记为m3(g).每组设3个平行检测组.孔隙率的计算公式如下:

1.3.3 体外降解性能测定将经过充分冻干的nLMS-CS-SA复合支架材料[质量记为w0(g)],浸泡于PBS中,于37℃培养7 d后弃掉缓冲液,将剩余材料再次冻干[质量记为wt(g)],更换新PBS溶液,连续重复上述步骤直至第7周.每组设置3个平行样.体外降解性以质量损失分数表示,计算方法如下:

1.4 细胞相容性评价
1.4.1 细胞培养采用含10%小牛血清的H-DMEM培养基,于细胞培养箱(37℃,5%CO2)中培养小鼠成纤维细胞L929细胞系.
1.4.2 细胞毒性测试将充分灭菌后的nLMS-CS-SA复合支架材料放入50 mL离心管内,培养基体积与nLMS-CS-SA复合支架材料表面积比为0.9 mL∶1 cm2,使复合支架材料完全浸没,于37℃培养72 h后收集离心管中液体,并在4℃冰箱中密封保存备用.将处于对数生长期的L929细胞重悬、计数并稀释为10000 cell/mL,按2000 cell/孔将细胞接种于96孔板内.实验共设置6组,5种nLMS-CS-SA复合支架材料浸提液作为实验组,单纯培养基作为对照组,每组设置8个平行孔.待细胞完全贴壁后,实验组及空白对照组分别加入5种nLMS-CS-SA复合支架材料浸提液或细胞培养基,每孔200 μL.孵育48 h后弃去各孔内的上清液,实验组及对照组每孔加入100 μL预先配制好的CCK-8混合液,孵育4 h后用酶标仪在450 nm波长处测定各孔的吸光度值(OD).利用相对增殖率[Relative growth rate(RGR),%]评价细胞毒性.计算公式如下:
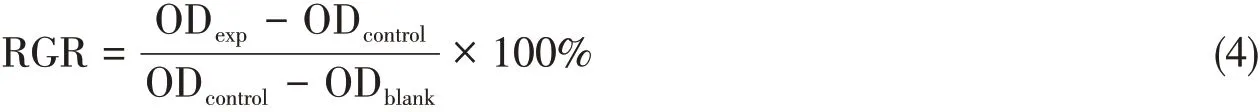
1.5 统计学分析
实验所得数据采用ISM SPSS Statistics 18.0软件进行统计学分析,当P<0.05时,认为差异有统计学意义.使用Origin Pro 9.0,Microsoft Excel 2019和Adobe Photoshop CS6软件进行图像处理和图表绘制.
2 结果与讨论
2.1 nLMS-CS-SA复合支架材料的形态表征
图1 示出了nLMS-CS-SA复合支架材料的宏观形态.宏观条件下各组支架都具有可塑性.nLMSCS-SA复合支架材料冻干前为具有良好可塑性的凝胶状,冻干后呈圆柱状.直径约1.5 cm,高约1.0~1.5 cm,颜色为乳白色,表面呈网格状结构,具有疏松多孔的三维立体结构.

Fig.1 General view of nLMS⁃CS⁃SA composite scaffolds
2.2 傅里叶变换红外光谱
图2 给出不同nLMS含质量的nLMS-CS-SA复合支架材料的傅里叶变换红外光谱.硅酸镁锂的Si—O和—OH振动吸收峰分别出现在1040和3400 cm−1附近[4,5];壳聚糖中C—N键的特征峰出现在1159 cm−1处,酰胺键的特征峰出现在1647 cm−1处,伯氨键的特征峰出现在1578 cm−1附近,在3330 cm−1附近出现了O—H和N—H吸收峰[6,7];1614 cm−1处为海藻酸钠的C=O特征峰,—OH的伸缩振动峰为3305 cm−1处的宽峰,C—O振动峰出现在1029 cm−1处[7];与空白对照组相比,5组实验组未出现明显的新吸收峰.在3%nLMS组中,SA的C=O特征峰与LMS向低波数方向移动的Si—O特征峰重叠,在1024 cm−1处出现增强的特征峰.3207 cm−1处增强的特征宽峰是由nLMS在3400 cm−1附近的—OH,SA在3305 cm−1处的—OH及CS在3330 cm−1附近的O—H,N—H吸收峰向低波移动并重叠而成.与Alif等[6]的研究相同,因nLMS的特征峰被1024和3207 cm−1处的拉伸振动所掩盖并向低波数移动,故未观察到明显的nLMS特征峰.SA-CS与nLMS之间未发生化学反应,主要以氢键或分子间作用力结合.
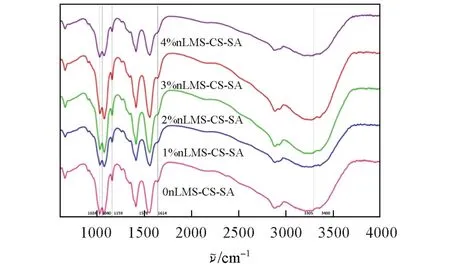
Fig.2 FTIR spectra of nLMS⁃CS⁃SA scaffold materials
2.3 微观结构与孔隙率
图3 给出nLMS-CS-SA复合支架材料的SEM照片.由图3可以看出,5组复合支架材料的内部均呈疏松多孔结构,连续分布于材料全层.纵断面呈均匀片层状,层间距基本均匀.微观结构内具有高度的连通性,呈三维网络状.图4给出nLMS-CS-SA复合支架材料的孔隙率结果.所有组的孔隙率均高于60%,当所用nLMS溶液的质量分数为1%~3%时,复合支架材料的孔隙率都低于空白组(P<0.01);当所用nLMS质量分数增加到4%时,nLMS-CS-SA复合支架材料的孔隙率急剧增大(P<0.01).

Fig.3 SEM images of nLMS⁃CS⁃SA scaffolds
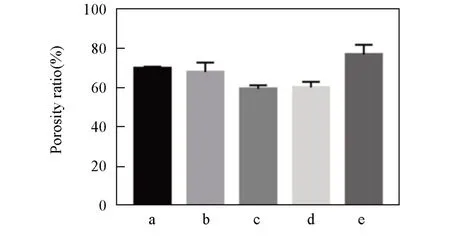
Fig.4 Porosity ratios of nLMS⁃CS⁃SA composite scaffolds
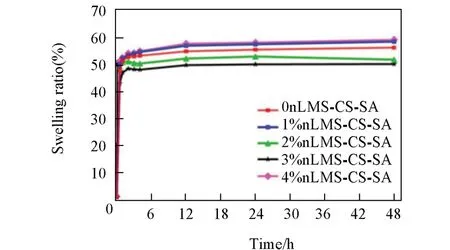
Fig.5 Swelling ratios of nLMS⁃CS⁃SA composite scaffolds as a function of time
2.4 溶胀率
图5 给出nLMS-CS-SA复合支架材料溶胀率随时间的变化.各组材料均表现出相似的溶胀过程和优秀的亲水性,浸入水中后较快发生亲水溶胀,且在1 h后溶胀速度变化基本趋于稳定.图6给出24 h时nLMS-CS-SA复合支架材料的溶胀率.由图6可见,随着nLMS含量逐渐增加,nLMS-CS-SA复合支架材料的溶胀率先降低后增高.2%nLMS-CS-SA和3%nLMS-CS-SA组的溶胀率均低于0nLMS-CS-SA组,组间差异具有统计学意义(P<0.05).
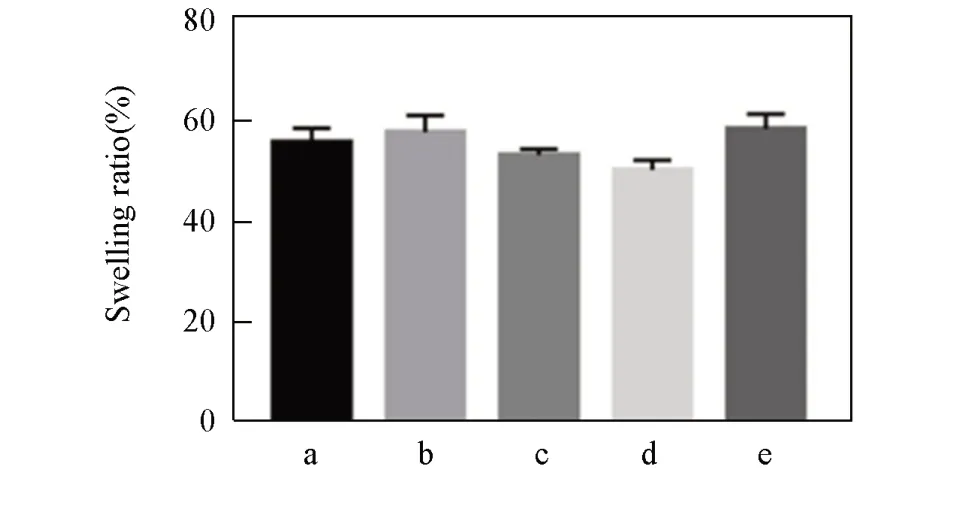
Fig.6 Swelling ratios of nLMS⁃CS⁃SA composite scaffolds at 24 h
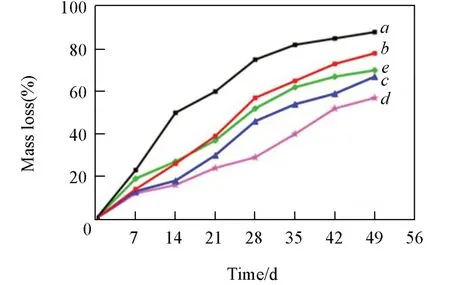
Fig.7 Mass loss curves of nLMS⁃CS⁃SA composite scaffolds in vitro
2.5 体外降解性能
图7 给出nLMS-CS-SA复合支架材料的体外降解曲线.所有组别的降解曲线基本都呈线性,其中空白组支架的降解最快,在第28 d时降解率达到70%左右.当所用nLMS溶液的浓度在1%~3%区间内时,所制备的nLMS-CS-SA复合支架材料的降解率依次降低.4%nLMS-CS-SA的降解率介于1%nLMSCS-SA和2%nLMS-CS-SA组之间,3%nLMS-CS-SA的降解速率在第49 d时仍小于60%(P<0.01).
2.6 力学性能
图8 给出所制备的nLMS-CS-SA复合支架材料的弹性模量.可以看出,加入nLMS后,在所测试区间内复合支架材料的弹性模量与nLMS的质量分数无明显相关性.
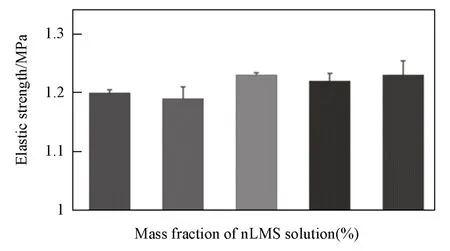
Fig.8 Elastic modulus of nLMS⁃CS⁃SA composite scaffolds
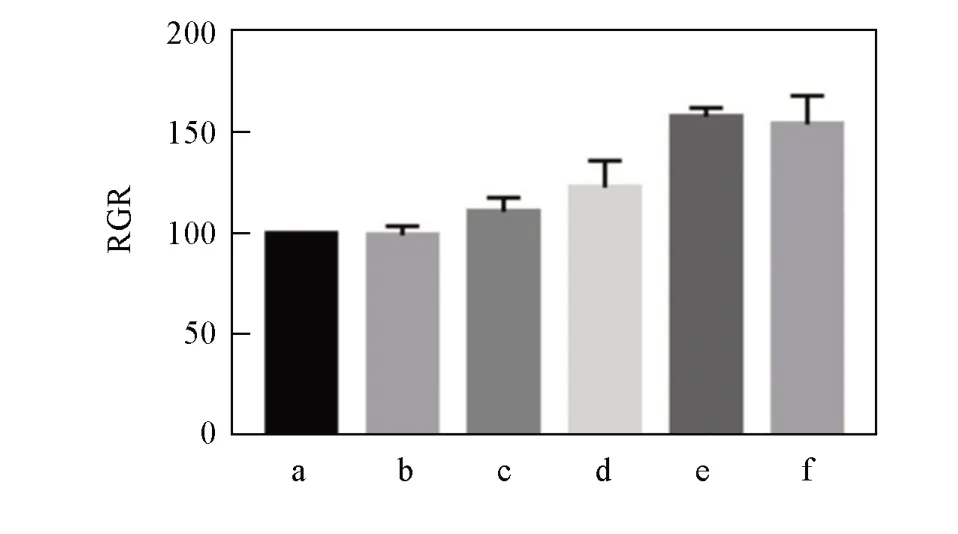
Fig.9 RGR of nLMS⁃CS⁃SA composite support
2.7 生物相容性
检测不同nLMS含量的nLMS-CS-SA复合支架材料浸提液培养的细胞在48 h时CCK-8的吸光度值并计算各个组的细胞相对增殖率(RGR)值,各组材料浸提液的细胞毒性结果见图9.各组细胞增殖率差异无明显统计学意义(P>0.05),其中,1%nLMS-CS-SA组(RGR=101.46%),2%nLMS-CS-SA组(RGR=104.73%),3%nLMS-CS-SA组(RGR=154.52%)和4%nLMS-CS-SA组(RGR=147.57%)细胞毒性为0级,0nLMS-CS-SA组RGR=98.73%的细胞毒性为1级.
2.8 讨 论
在骨组织工程中,理想的骨支架材料应具有一定的机械强度、适宜的理化性能和良好的生物相容性[8,9].大量研究表明,单一组分的骨支架材料往往功能单一,难以具备理想支架材料的性能[10].将不同骨支架材料人工合成为复合材料可以弥补单一组分材料的不足.壳聚糖[11]和海藻酸钠[12]形成的聚电解质天然高分子化合物以其良好的生物活性、无毒性及易降解等优势而被广泛应用于骨组织工程领域,在骨重建与骨修复中展示出巨大潜能[5,13,14].硅酸镁锂是一种人工合成的具有2D结构的纳米级材料[15].研究表明,硅酸镁锂能促进细胞的增殖、黏附及成骨分化.即使在不含成骨诱导因子的体外环境中,硅酸镁锂也能促进干细胞的成骨分化进程[16].本文将两种有机材料壳聚糖、海藻酸钠与无机材料纳米硅酸镁锂复合在一起,各物质间通过氢键及各种分子间作用力进行有机整合,最终制备出一种新型复合骨支架材料.
疏松多孔的骨支架材料有利于骨缺损的重建与修复.研究表明,在保证一定物理机械强度的条件下,支架的孔隙率应尽可能地大(一般认为应大于70%).较高的孔隙率可提供足够大的表面积,有利于细胞和支架的相互作用.大小适宜的孔径和孔隙的贯通性既便于细胞的迁移扩散和新生组织结构的生长,又有利于营养代谢过程和各种物质的交换[8].骨支架材料应与骨组织内部结构相似,其孔径介于200~400 μm之间,接近机体骨单元大小[17].本文合成的5组支架材料孔隙率介于60%~75%之间,均具有相似的疏松多孔结构,其纵断面在扫描电子显微镜下均呈现出比较均匀的片层状,孔径大小可达180 μm以上且高度连通.
实验采用的壳聚糖、海藻酸钠与纳米硅酸镁锂3种原材料均具有良好的生物活性.傅里叶变换红外光谱显示,在合成壳聚糖-海藻酸钠-纳米硅酸镁锂新型复合骨支架材料的整个过程中并未发生化学反应,不仅无新物质生成,也不会产生有毒的降解产物.细胞细胞毒性实验结果显示,各组材料细胞相对增值率为0级或1级,表明此种新型复合骨支架材料具有良好的生物相容性.复合支架材料中的硅酸镁锂发生溶胀,使镁离子和锂离子析出,从而促进细胞增殖活性的提高[18].
制备的新型支架均具有良好的亲水性,在0.5 h内吸水溶胀率显著上升,在1~48 h范围内,溶胀曲线逐渐趋于平稳.其中硅酸镁锂的添加量会直接影响支架材料的溶胀率,当所用nLSM溶液的浓度由1%增加到3%时,所得nLMS-CS-SA复合支架材料的溶胀率逐渐下降,3%nLMS-CS-SA的溶胀率最低.这是由于nLSM具有良好的亲水性,当支架中nLSM比例较少时,可以增加支架的亲水能力,最终表现为溶胀率的增加.但当支架中nLSM含量逐渐增加时,其质量因素比亲水因素对支架的吸水溶胀率影响更大,表现为支架的吸水溶胀率逐渐减小.但当所用nLMS溶液的浓度为4%时,所得复合支架材料的溶胀率又转而增大,这是由于复合体系原本维持一种均匀分散的状态,当nLSM浓度进一步增加时会打破这种临界平衡.复合体系难以在电荷作用下均匀分散,从而出现局部的聚集、沉淀,造成局部结构的塌陷和断裂,导致材料内部孔隙不均匀增大,允许更多的水分子的进入.
骨支架材料应具有一定的降解速率,具有可被宿主酶和其它生物过程降解的特性.但降解速率不能过快或过慢,应在保证其足够骨支撑强度的同时又能允许组织细胞向内部逐渐生长.随着时间推移,降解的支架结构被新生组织替代,以维持局部空间结构的稳定.本文制备的各组支架材料均具有良好的降解性,其中3%nLMS-CS-SA组复合支架材料降解最慢.这可能是由于高浓度的nLSM使分子间作用力增强,抑制了nLMS-CS-SA复合支架材料中的聚合物分子向溶剂体系中扩散.虽然加入nLSM后的nLMS-CS-SA复合支架材料的降解速率相比对照组有所减慢,但仍短于一些学者提出的6个月的降解时间[19].这可能是本文工作是在体外模拟环境下进行,忽略了生物体内多种酶消化作用和吞噬细胞等的分解作用.
骨支架材料应具有一定的骨传导性和骨诱导性,单一的骨支架材料骨形成活性较低,因此人们通过在骨支架材料上负载生长因子或包载某些生物信号来促进干细胞的增殖、黏附和成骨分化.本文用到的壳聚糖可促进细胞的黏附,其原理是利用侧链上的氨基基团与细胞膜相关蛋白结合[20].微血管结构的形成亦可影响骨支架材料的骨修复能力,硅酸镁锂通过促进人脐静脉血管内皮细胞(HUVEC)的黏附和迁移来发挥促成血管活性,并为新生的组织结构提供营养支持[21].此外,硅酸镁锂在体内和体外的降解产物Mg2+,Si(OH)4和Li+可上调成骨相关基因的表达,并促进Ⅰ型胶原合成,从而发挥 成 骨诱导活性.
3 结论
通过溶液-凝胶法和冷冻干燥技术合成了nLMS-CS-SA复合支架材料,其合成过程容易,操作简单,产物形态可塑,冻干后大小、形状与所在容器一致.由于患者骨缺损处大小形态不一,因此具有良好可塑性及疏松多孔三维网络状结构的nLMS-CS-SA复合支架材料有望应用于骨缺损修复的个性化设计.掺入nLMS的nLMS-CS-SA复合支架材料孔隙率下降,但在亲水溶胀性和稳定性方面更具优势,且无细胞毒性,体外降解时间延长,并具有良好的细胞相容性.