用于磁性靶向治疗肺纤维化的聚多巴胺包覆的Fe3O4/甲强龙/环磷酰胺复合超粒子
2021-10-15孙启睿刘树威张乐宁
孙启睿,赵 楠,刘树威,辛 华,张 皓,张乐宁
(1.吉林大学化学学院,长春130012;2.吉林大学中日联谊医院胸外科,长春130033)
2020年以来,新冠病毒在全球疯狂肆虐,现已造成近2.0亿人感染,逾400万人死亡.除造成大量患者死亡外,肺纤维化作为重症新冠肺炎的后遗症之一,持续威胁患者生命.肺纤维化是一种进行性、致命性的间质性肺部疾病,其主要病理特征是成纤维细胞过度增殖、活化,细胞外基质沉积增多,并伴有炎症损伤和组织结构破坏,最终导致患者肺功能丧失和呼吸衰竭死亡[1].肺纤维化患者的平均生存期仅为3~5年,死亡率高于大多数肿瘤.目前,肺纤维化的治疗方法主要包括临床常规疗法、细胞因子及其抑制剂疗法、抗氧化药物、基因疗法和肺移植等[2].其中,常规疗法是使用甲强龙(MPS)等糖皮质激素和环磷酰胺(CTX)等免疫抑制剂进行联合治疗[3,4],由于具有价格优势而易被广大患者接受.虽然糖皮质激素和免疫抑制剂联合疗法对肺纤维化有较好的疗效,但该方法存在明显的不良反应[5].需要发展新的药物递送方法降低血液中药物分子的浓度,同时提高药物分子在病灶部位的富集量.
可穿戴磁性靶向技术是近年来发展起来的一种体外辅助控制药物递送方法,主要原理是在外加磁场作用下引导磁性纳米载体药物在目标部位的富集,具有简便、无损伤、增加药物滞留率及降低对正常组织毒副作用等优点[6].作为磁性靶向技术的核心,磁性纳米载体药物的设计尤为重要,需要根据药物分子的特性和治疗机理,选择适当的磁性纳米载体,建立合理的复合方法[7].Fe3O4纳米材料是一种经过美国食品药品监督管理局认证的生物安全的超顺磁性材料,具有低毒、低成本及高顺磁性等特点[8].从纳米载体药物制备角度来看,纳米尺寸的Fe3O4粒子便于和药物分子进行组合、装配及修饰,是设计纳米载体的首选[9].但Fe3O4纳米粒子(Fe3O4NPs)的磁性与其尺寸大小密切相关,粒子的尺寸越大磁性越强[10].因此,从提高磁靶向性能来看,制备纳米载体时,还需要将尺寸较小的Fe3O4NPs按照一定的方式在载体内部进行组装,获得Fe3O4超粒子(Fe3O4SPs)[11].此外,为了提高纳米载体的生物相容性,通常需要在载体表面修饰生物相容的高分子材料.其中,聚多巴胺(PDA)是一种具有优良表面吸附性、生物相容性和可降解性的高分子材料,可以在室温、碱性条件下由多巴胺单体聚合获得[12].由于性能优异,PDA已经被广泛用于各种金属、金属氧化物及半导体纳米粒子等的表面修饰[13],极大地促进了各种纳米粒子及纳米载体的诊疗应用.
基于磁性靶向治疗肺纤维化的思路,本文设计了一种聚多巴胺包覆的Fe3O4纳米粒子/甲强龙/环磷酰胺复合超粒子(Fe3O4/MPS/CTX@PDA SPs),研究了其制备方法、稳定性、磁性、药物负载及释放,分析了其生物毒性,并建立动物模型验证了其磁性靶向功能.
1 实验部分
1.1 试剂与仪器
乙酰丙酮铁(纯度≥99.9%)、1,2-十六烷醇(纯度90%)、十八烯(ODE,纯度90%)、油酸(OA,纯度90%)、油胺(OLA,纯度70%)和盐酸多巴胺(DA,99%)购自美国Sigma-Aldrich公司;甲苯(分析纯)购自北京化工厂;无水乙醇(分析纯)和正己烷(分析纯)购自国药集团化学试剂有限公司(京试);十二烷基硫酸钠(SDS,化学纯)购自国药集团化学试剂有限公司(沪试);三羟甲基氨基甲烷(Tris,纯度≥99.9%)和环磷酰胺(CTX,纯度97%)购自阿拉丁试剂有限公司;注射用甲泼尼龙琥珀酸钠(40 mg/支)由美国辉瑞公司生产;磷酸盐缓冲溶液(PBS,粉剂)购自北京鼎国昌盛生物技术有限责任公司;细胞实验培养基采用索莱宝DMEM高糖培养基;血清采用Gemini胎牛血清(FBS);动物实验采用辽宁长生生物技术股份有限公司KM小鼠(雄性,28 d龄);所有试剂均直接使用,未做进一步纯化处理.实验过程中配制样品与洗涤样品均使用无水乙醇和去离子水.
H-800型透射电子显微镜(TEM),日本Hitachi公司;Agilent technologies G7114A型高效液相色谱仪(HPLC),色谱条件:色谱柱采用Diamonsil C18(250 mm×4.6 mm,5 μm),流动相为乙腈/水/3%冰醋酸水溶液(体积比为35/60/5)的混合物,检测速度1.0 mL/min,检测波长195 nm,254 nm,柱温20℃,进样量20 μL;UV-2600型紫外-可见吸收光谱仪(UV-Vis),日本岛津公司;ZETA SIZER Nano-ZS型动态光散射纳米粒度仪(DLS),英国Malvern公司;VERTEX 80V型傅里叶变换红外光谱仪(FTIR),德国布鲁克公司;SQUID-MPMS-XL型磁性测量系统[磁场测试范围-30~30 kOe(1 kOe=80 kA/m),测试温度300 K];Q500型热重分析仪(TGA),美国TA仪器公司;ICP-5000型电感耦合等离子体原子发射光谱仪(ICP-OES),杭州聚光科技股份有限公司.
1.2 Fe3O4/MPS/CTX@PDA SPs复合超粒子的制备
首先通过热分解法制备OA修饰的Fe3O4NPs[14].将0.7064 g乙酰丙酮铁、1.2922 g 1,2-十六烷醇、10 mL ODE、1.91 mL OA和1.975 mL OLA依次加入圆底三颈烧瓶中,抽真空后于氮气保护下搅拌15 min后再升温至200℃并反应30 min,然后以3℃/min的速率升温至265℃并反应30 min;待反应溶液冷却至室温后加入40 mL无水乙醇洗涤,离心后的固体产物使用甲苯分散,得到OA修饰的Fe3O4NPs.
进一步通过水包油的微乳液模板法制备Fe3O4SPs[15].将12.5 mL SDS水溶液(4 mg/mL)和4 mL Fe3O4NPs甲苯溶液(7 mg/mL)加入到三颈烧瓶中,置于超声搅拌水浴加热装置中,室温超声搅拌10 min使甲苯溶液在水中均匀分散,再于56℃加热至甲苯完全挥发,得到Fe3O4SPs水溶液.
在室温条件下,将10 mL Fe3O4SPs水溶液、2 mL DA水溶液(5.6 mg/mL)、10 mg CTX、10 mg甲泼尼龙琥珀酸钠依次加入40 mL Tris(10 mmol/L,pH=8.5)水溶液中,置于摇床上于室温下振荡4.5 h后离心,即得到Fe3O4/MPS/CTX@PDA SPs复合超粒子.
1.3 细胞毒性实验
在37℃、5%CO2条件下将人肠系膜下腔动脉血管内皮细胞(Ealy926细胞)以5000 cell/孔的密度接种在96孔板中,24 h后将Ealy926细胞与浓度分别为0,25,50,100,150,200 μg/mL的Fe3O4/MPS/CTX@PDA SPs共培养;24 h后向每孔中加入10 μL CCK-8,继续孵育2 h后使用酶标仪测试450 nm处的光密度值,计算细胞的相对存活率.按照相同的实验方法考察Fe3O4@PDA SPs的细胞毒性.
1.4 动物磁性靶向实验
本文所涉及动物实验方案通过了吉林大学动物实验伦理审查.KM小鼠体内磁性靶向实验分为对照组和实验组两组,每组包含5只小鼠.在两组实验中,小鼠的给药方式和剂量相同,均为经尾静脉注射60 μL含有300 μg Fe3O4/MPS/CTX@PDA SPs的生理盐水.对照组不穿戴磁性靶向设备,实验组穿戴磁性靶向设备;24 h后,对两组小鼠进行安乐死,解剖获取小鼠肺脏,热消解后,用去离子水稀释;使用ICP-OES测试溶液中铁离子含量,用于反映Fe3O4/MPS/CTX@PDA SPs在肺部的富集程度,验证磁性靶向效果.
2 结果与讨论
2.1 Fe3O4/MPS/CTX@PDA SPs的制备
制备Fe3O4/MPS/CTX@PDA SPs需要预先合成Fe3O4SPs.图1(A)给出用于合成Fe3O4SPs的Fe3O4NPs的TEM照片和平均尺寸.从图1(A)可以看出,Fe3O4NPs为近球形粒子,尺寸分布较均一,平均直Fig.1 TEM images of Fe3O4NPs(A)and Fe3O4/MPS/CTX@PDA SPs(B)and DLS size distribution of Fe3O4/MPS/CTX@PDA SPs(C) Insets of(A)and(B):the corresponding TEM size distribution.
径为5.1 nm.Fe3O4NPs表面修饰了OA,因此可分散在甲苯等疏水溶剂中[14].利用Fe3O4NPs疏水的特点,通过构筑水包油微乳液模板法合成了Fe3O4SPs.该方法将Fe3O4NPs甲苯溶液与水混合,并以SDS为稳定剂,经搅拌形成分散在水中的甲苯液滴,Fe3O4NPs存在于甲苯相中.在持续搅拌下,于56℃蒸发体系中的甲苯后,得到SDS包覆的Fe3O4SPs.由于SDS包覆的Fe3O4SPs表面带负电,带正电的多巴胺单体能够吸附在Fe3O4SPs表面,并进一步在室温碱性条件下发生聚合,得到Fe3O4@PDA SPs[16].在形成PDA壳层时引入甲泼尼龙琥珀酸钠和CTX,得到Fe3O4/MPS/CTX@PDA SPs.图1(B)为Fe3O4/MPS/CTX@PDA SPs的TEM照片,可以看到Fe3O4/MPS/CTX@PDA SPs的核由小粒子堆积而成,核的表面有平均厚度为6.8 nm的低衬度壳层,整体SPs的 平 均 直 径 为79.5 nm.图1(C)为Fe3O4/MPS/CTX@PDA SPs的DLS图,其平均尺寸为86.7 nm,略大于TEM观测到的尺寸,这是因为DLS测得的是SPs在溶液中的水合直径,而TEM观察到的是干态条件下SPs的尺寸.需要说明的是,本文使用水溶性更佳的甲泼尼龙琥珀酸钠作为MPS的前药,甲泼尼龙琥珀酸钠遇水脱除琥珀酸钠转化为MPS,并以MPS的形式存在于Fe3O4/MPS/CTX@PDA SPs中.
图2 给出各样品的FTIR光谱图.Fe3O4/MPS@PDA SPs和Fe3O4/MPS/CTX@PDA SPs Fig.2 FTIR spectra of MPS,CTX,Fe3O4@PDA SPs,Fe3O4/MPS@PDA SPs,Fe3O4/CTX@PDA SPs and Fe3O4/MPS/CTX@PDA SPs的谱 线在1655和1577 cm−1处出现MPS的特征峰,证明SPs中存在MPS.Fe3O4/CTX@PDA SPs和Fe3O4/MPS/CTX@PDA SPs的谱线在1130,977,950和894 cm−1处出现了CTX的特征峰,证明SPs中存在CTX.
2.2 磁富集性能
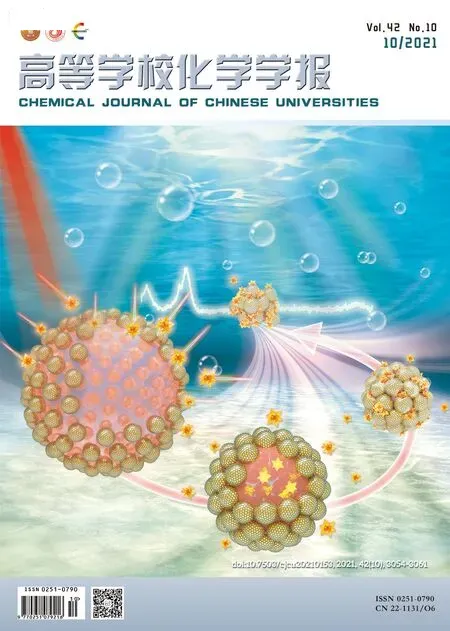
图3 (A)为300 K条件下,设定循环磁场强度为-30~30 kOe,通过磁性测量系统得到的Fe3O4/MPS/CTX@PDA SPs的M-H曲线.结果表明,该SPs展现出强的磁性能,其饱和磁化强度为42 A·m2/kg.M-H曲线没有表现出剩磁或矫顽力,说明Fe3O4/MPS/CTX@PDA SPs具有超顺磁性.Zhang等[17]发现,Fe3O4SPs及Fe3O4@PDA SPs均为超顺磁性材料,表明MPS和CTX的引入没有改变SPs的超顺磁特点.图3(B)示出了Fe3O4/MPS/CTX@PDA SPs在外加磁场引导下的富集行为,经磁铁吸引10 s后,该SPs全部被富集到磁铁周围.由于Fe3O4NPs组装成了尺寸更大的SPs,集成效应使其具有较强的磁性[10].该磁场引导下的富集过程是可逆的,撤去磁场并轻微晃动后,SPs即可重新分散到溶液中.Fe3O4/MPS/CTX@PDA SPs在磁场引导下的富集行为为进一步设计可穿戴磁装置、实现磁性靶向治疗肺纤维化提供了可能.
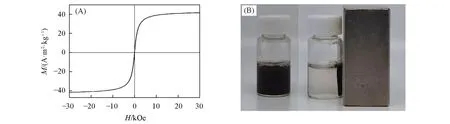
Fig.3 M⁃H curve of Fe3O4/MPS/CTX@PDA SPs(A)and photograph of the solution of Fe3O4/MPS/CTX@PDA SPs without and with a magnet(B)
2.3 稳定性、药物负载及释放
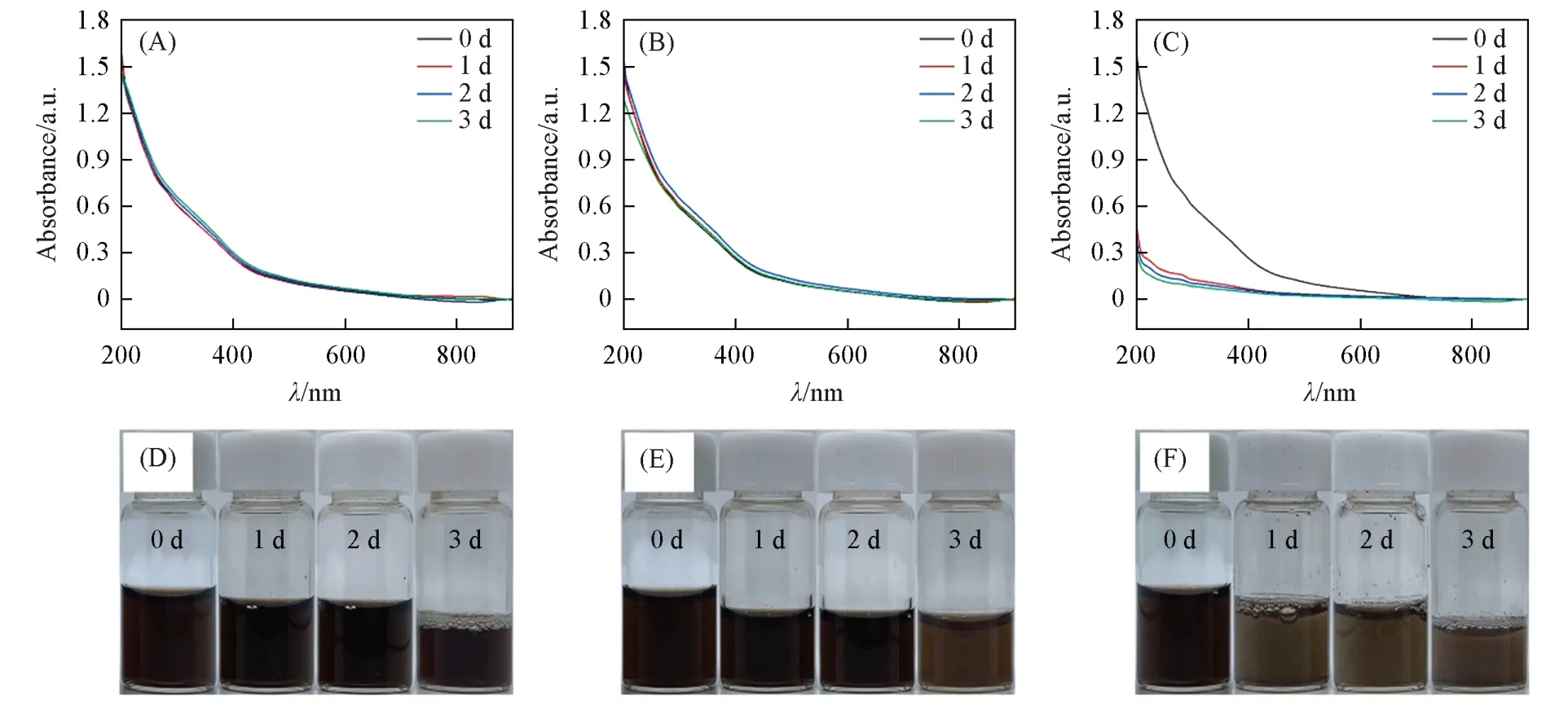
Fig.4 Temporal evolution of the UV⁃Vis absorption spectra(A—C)and the corresponding solution photographs(D—F)of Fe3O4/MPS/CTX@PDA SPs at pH of 8.0(A,D),7.4(B,E),and 6.0(C,F)
Fe3O4/MPS/CTX@PDA SPs具有较好的稳定性.由图4(A)可见,在pH=8.0的水溶液中放置3 d后,其吸收光谱基本未发生变化.图4(D)为对应溶液的照片,溶液的状态和颜色均无改变.进一步考察了Fe3O4/MPS/CTX@PDA SPs在生理盐水、PBS、细胞培养基及含10%血清的细胞培养基中的稳定性.由图5可见,放置3 d后,SPs会从生理盐水和PBS溶液中沉淀,这是因为Fe3O4/MPS/CTX@PDA SPs靠静电排斥力分散在水中,高的盐浓度会减小Fe3O4/MPS/CTX@PDA SPs之间的斥力,引起其缓慢聚集.该沉淀经振荡后可重新分散,说明聚集是可逆的,没有破坏Fe3O4/MPS/CTX@PDA SPs的结构.该SPs在细胞培养液及血清中稳定性良好,放置3 d后溶液没有发生明显变化.较好的稳定性主要归结为PDA壳层的保护作用[18].

Fig.5 Photographs of Fe3O4/MPS/CTX@PDA SPs in saline,PBS,cell culture medium and cell culture medium with 10%FBs
肺部环境的pH值与人体体液的pH值范围相同,为7.35~7.45.因此,本文考察了Fe3O4/MPS/CTX@PDA SPs在近中性和弱酸性条件下的稳定性.图4(B)和(C)分别为pH值为7.4和6.0时Fe3O4/MPS/CTX@PDA SPs随时间变化的吸收光谱.在pH=7.4条件下放置1 d后,Fe3O4/MPS/CTX@PDA SPs的吸收光谱强度产生下降,3 d后强度下降更显著,说明其发生了拆解.吸收光谱在pH=6.0条件下的变化比pH=7.4时更明显,说明酸性环境有利于Fe3O4/MPS/CTX@PDA SPs拆解.从图4(E)和(F)对应的溶液照片同样观察到明显的颜色变浅,表明Fe3O4/MPS/CTX@PDA SPs在酸性条件下发生了拆解.Fe3O4/MPS/CTX@PDA SPs在弱碱性条件下稳定、在近中性和弱酸性条件下易拆解的特点有利于MPS和CTX在肺部的释放.
通过HPLC研究了Fe3O4/MPS/CTX@PDA SPs中MPS和CTX的负载率、包封率及释放情况(图6).由图6(A)可见,在HPLC结果中MPS对应的保留时间为10.30 min,CTX对应的保留时间为3.03 min.图6(B)为MPS浓度对应HPLC峰面积的标准曲线,图6(C)为CTX浓度对应HPLC峰面积的标准曲线.它们的标准曲线均呈线性,可以根据样品实测的HPLC峰面积得到对应的药物浓度.其中,药物负载率=(SPs中药物质量)÷(SPs质量)×100%;药物包封率=[1−(溶液中残留药物质量÷药物总质量)]×100%.结合HPLC结果计算可知,Fe3O4/MPS/CTX@PDA SPs中MPS和CTX的负载率分别为8.7%和6.3%,包封率分别为9.6%和6.8%.药物的负载率和包封率均不高,这主要是由Fe3O4/MPS/CTX@PDA SPs的结构决定的.该SPs由内部疏水的Fe3O4SPs核和较亲水的PDA壳层组成.MPS和CTX均为亲水药物,无法进入Fe3O4SPs核,只能存在于PDA壳中.而PDA壳层厚度只有6.8 nm,无法负载更多的药物.我们曾尝试在Fe3O4SPs核中负载MPS和CTX,但没有成功,也验证了上述推测.此外,通过TGA表征可知,Fe3O4/MPS/CTX@PDA SPs中的有机物组分要小于40%,说明PDA壳层中30%以上的有机组分为负载的MPS和CTX.这一负载率并不低.
模拟肺部pH=7.4和37℃环境,考察了药物分子的释放动力学.由图6(D)可见,CTX的释放速率比MPS快.随时间的延长,CTX和MPS两种药物的释放率均逐渐增加.10 h后,CTX的释放率为44.7%,MPS的释放率为29.7%,符合对药物释放的基本要求.
Fig.6 HPLC characterization of Fe3O4/MPS/CTX@PDA SPs
2.4 细胞毒性及动物磁性靶向性
通过比较Fe3O4@PDA SPs和Fe3O4/MPS/CTX@PDA SPs对Ealy926细胞存活率的影响考察了细胞毒性(图7).由图7(A)可见,Fe3O4@PDA SPs的毒性较低,浓度为200 μg/mL时细胞存活率仍达到89%.较低的毒性得益于生物相容的PDA的包覆有效避免了Fe3O4@PDA SPs核中有毒物质的释放[19].轻微的毒性主要来自制备Fe3O4@PDA SPs时引入的SDS[20].由图7(B)可见,Fe3O4/MPS/CTX@PDA SPs的毒性也较低,浓度达到200 μg/mL时细胞存活率仍维持在85%以上.
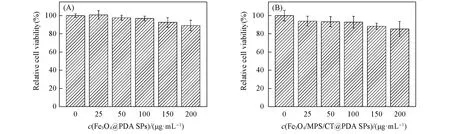
Fig.7 Cell viability of Ealy926 cells treated with Fe3O4@PDA SPs(A)and Fe3O4/MPS/CTX@PDA SPs(B)
图8 (A)和(B)为Fe3O4/MPS/CTX@PDA SPs用于可穿戴磁性靶向设备富集实验的照片,在设备与小鼠肺部对应的位置加入了起磁性靶向作用的磁铁.分别对未穿戴设备组和穿戴设备组的小鼠进行尾静脉注射Fe3O4/MPS/CTX@PDA SPs,24 h后取肺脏进行Fe元素测定,并根据Fe元素计算SPs的肺部滞留率.发现穿戴设备组的肺部滞留率为9.81%ID/g(ID:inject dose),而未穿戴设备组的滞留率为8.93%ID/g[图8(C)],证明Fe3O4/MPS/CTX@PDA SPs具有良好的磁性靶向肺部富集作用,对于磁性靶向治疗肺纤维化具有潜在应用价值.
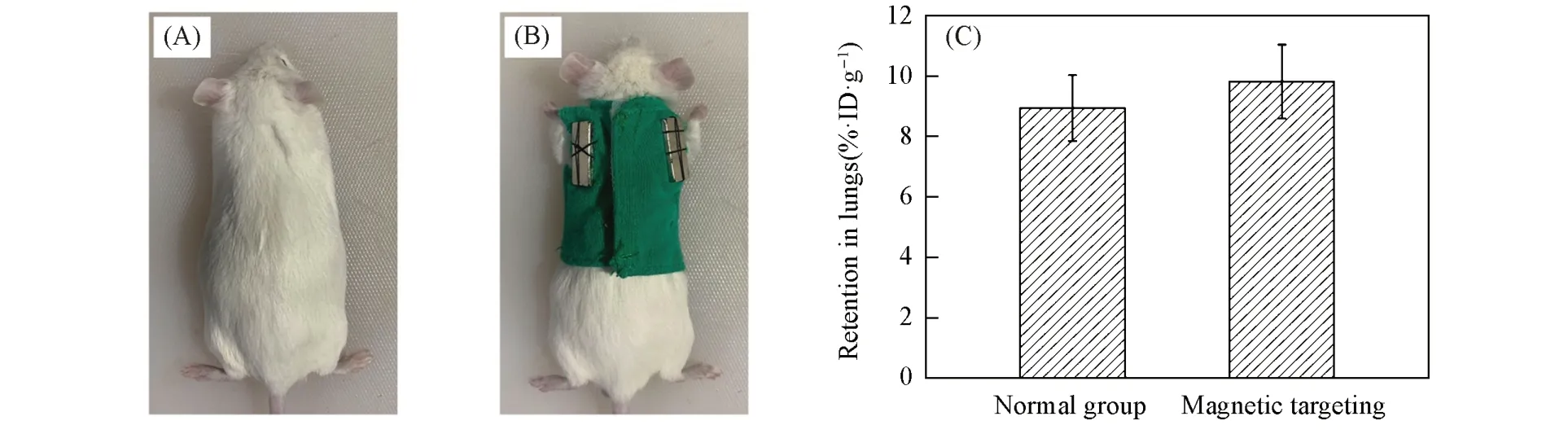
Fig.8 Photographs of a mouse without(A)or with(B)magnetic dress to achieve magnetic targeting of Fe3O4/MPS/CTX@PDA SPs towards lungs and comparison of the retention of SPs in lungs without or with magnetic dress(C)
3 结 论
从调控油溶性Fe3O4NPs自组装出发,首先借助水包油微乳液模板法制备了Fe3O4SPs,并在包覆PDA壳层的过程中同时引入治疗肺纤维化的药物MPS和CTX,得到Fe3O4/MPS/CTX@PDA SPs.作为核的Fe3O4SPs赋予材料优异的超顺磁性,可以在外加磁场引导下发生富集.PDA壳层的引入一方面提高了材料的生物相容性,另一方面有利于负载MPS和CTX.Fe3O4/MPS/CTX@PDA SPs在模拟肺部pH值条件下可以释放出MPS和CTX.体外细胞实验表明Fe3O4/MPS/CTX@PDA SPs具有较低的生物毒性.可穿戴磁性靶向动物实验证明Fe3O4/MPS/CTX@PDA SPs具有良好的磁性靶向肺部富集功能.本文提出了一种磁性靶向治疗肺纤维化的策略,为解决目前临床常规的MPS联合CTX治疗方案的毒副作用问题提供了新思路.