线粒体转运系统和降解系统的研究进展
2021-10-15王梦伊李倩竹张世武张伟华
王梦伊,李倩竹,张世武,舒 凤,张伟华
(哈尔滨医科大学 病理生理学教研室,黑龙江 哈尔滨 150080)
线粒体是大多数真核细胞有氧呼吸的主要场所,负责为机体生命活动提供ATP,也参与维持离子平衡、传递信号、调节氧化应激和调控细胞凋亡。线粒体双层膜上有负责运输线粒体蛋白的转运系统,以保证其与胞质间的物质交换和信号传递。线粒体自身存在蛋白质量控制机制,可以监测线粒体蛋白稳态。线粒体转运障碍会引起一系列应激反应,激活线粒体降解途径来恢复线粒体功能。线粒体功能障碍是代谢性疾病及其并发症的发生机制之一。近年来,很多研究表明糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病患者发生心力衰竭的主要原因。因此,研究糖尿病患者的心肌线粒体病变具有重要意义。
1 线粒体转运系统
哺乳动物线粒体中,13种参与氧化磷酸化的核心蛋白由线粒体基因(mtDNA)编码,另外1 000多种蛋白由核基因编码,这些蛋白在胞质合成前体,再进入线粒体进行加工整合。
1.1 转位酶复合物
TOM(translocase of the outer mitochondrial membrane)复合物是90%以上前体的入口,它由7种亚基构成:Tom5、Tom6、Tom7、Tom20、Tom22、Tom40和Tom70。核心通道Tom40是一个跨外膜的β-桶状蛋白。Tom20和Tom22可以识别前体N端的基质定位信号(matrix-targeting signals,MTSs)。含有MTS样信号(internal MTS-like signals,iMTS-Ls)的线粒体蛋白Atp1进入线粒体需要Tom70的存在,证明了Tom70主要识别iMTS-L[1]。Tom5和Tom6参与各亚基间的功能性连接,Tom7则与复合物的解离有关[2]。外膜SAM(sorting and assembly machinery)复合物由Sam35、Sam37、Sam50和辅因子Mdm10组成,负责整合外膜β-桶状蛋白。β-桶状蛋白参与线粒体和胞质的物质交换,Sam35(在哺乳动物中为metaxin2)特异性识别其C端的反向平行链。Sam37(在哺乳动物中为metaxin1)稳定复合物的结构,还参与β-桶状蛋白的释放。Sam50是通道蛋白,Mdm10参与TOM复合物的组装。外膜MIM(mitochondrial import machinery)复合物是一种阳离子门控通道,负责整合含α跨膜信号的外膜蛋白。在酵母菌中,Tom70识别到的前体经MIM复合物插入外膜,而与SAM复合物结合的MIM还能促进TOM复合物的早期装配过程[3]。
内膜TIM23(translocase of the inner mitochondrial membrane)和PAM(presequence translocase-associa-ted motor)复合物介导大部分基质蛋白和内膜蛋白的转运。TIM23复合物由Tim17、Tim21、Tim23和Tim50组成。Tim23是复合物的中心通道,与其结合的Tim17参与介导TIM23-PAM复合物的连接。最近的一项研究总结了Tim50的作用:识别前体蛋白的前导序列,并促进其转移至Tim23通道中[4]。Tim21与Tom40和Tom22结合,连接TIM23-TOM复合物。PAM复合物主要包括Pam16/Tim16、Pam17、Pam18/Tim14、Tim44和mtHsp70。核心成分mtHsp70水解ATP供能,促进底物在Tim23通道中移动,其辅因子Pam18/Tim14和Pam16/Tim16调控ATP的水解与再生。Tim44维持PAM复合物的结构稳定,介导TIM23-PAM复合物相互作用,Pam17促进前导序列穿过内膜,Tim44帮助加工后的蛋白导入基质。TIM22复合物由Tim18、Tim22、Tim54和Sdh3组成,负责整合内膜载体蛋白。Tim22是复合物的核心通道,其缺乏会导致TIM22复合物失去结构稳定性[5]。Tim54与周围的小Tim分子作用。呼吸复合物Ⅱ的亚基Sdh3也可以与Tim22相连,参与TIM22复合物的组装[6]。膜间隙的小TIM复合物主要由Tim8、Tim9、Tim10、Tim12和Tim13组成,最近的一项研究揭示了其三维结构特点[7]:Tim9-Tim10和Tim8-Tim13分别形成六聚体,可以特异性结合不同前体并使其保持易运输的伸长状态。Tim12对内膜的亲和力较强,可以促进Tim9-Tim10靠近TIM22复合物。
1.2 前体蛋白的运输途径
60%的线粒体蛋白经前导序列途径进入线粒体,Tom20和Tom22负责识别此类蛋白N端带正电的MTS(前导序列),前体通过Tom40通道后再由Tim50引导通过TIM23复合物,然后在mtHsp70的作用下单向运动进入基质。线粒体加工肽酶(mitochondrial processing peptidase,MPP)切除前导序列后,在其他肽酶进一步的作用下,前体蛋白最终转变为成熟形式。沉默信息调节因子SIR2(silent information regulator 2)家族的Sirt3是一种由核基因编码的线粒体去乙酰化酶,可以通过调节线粒体蛋白的乙酰化水平来调控线粒体的生理活动。Ⅱ型糖尿病小鼠心肌细胞线粒体中Sirt3的水平明显下降,多种代谢关键酶处于高度乙酰化状态,导致线粒体能量代谢紊乱[8]。Sirt3含有MTS,通过前导序列途径进入线粒体。因此,检测糖尿病心肌线粒体中TOM复合物或TIM23复合物各亚基的含量和活性可能有助于明确Sirt3减少的分子机制。
在MTS后含有疏水分选信号的内膜蛋白经过TIM23复合物,再由小疏水蛋白Mgr2介导侧向释放到内膜;已进入基质的内膜蛋白(如Tim18)由内膜蛋白Oxa1(oxidase assembly)介导整合。Tom70识别含iMTS-L的内膜载体蛋白,然后蛋白经Tom40跨越外膜,在小TIM复合物的帮助下经TIM22横向整合到内膜。外膜β-桶状蛋白(如Tom40)先经Tom40进入膜间隙与小TIM复合物作用,然后经SAM复合物整合到外膜。外膜α-螺旋蛋白(如Tom20)由Tom70识别后经MIM直接插入外膜。膜间隙蛋白(如Tim12)多含特征性半胱氨酸序列,经Tom40进入膜间隙。
线粒体蛋白的导入途径复杂且灵活,各转位酶可以重新组合成新的通路发挥作用,不同物种之间、同一物种不同组织之间,复合物的成分也有所改变。更多元的转运途径及其分子机制还有待进一步研究。
2 线粒体降解系统
线粒体降解系统能在蛋白发生异常折叠、错误定位或结构损伤时维持蛋白稳态。泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)在线粒体质量控制中起重要作用。泛素蛋白是UPS的降解标签,其与底物的共价结合需要3种泛素酶催化:E1激活酶活化泛素,驱动其转移至E2结合酶处,E3连接酶催化泛素与底物连接。第一个泛素与底物结合后,后续的泛素与其赖氨酸残基相连,形成结构不同的泛素链。泛素化蛋白的降解主要由26S蛋白酶体完成,这种蛋白酶体包含两种亚基:19S识别并结合泛素化蛋白,引导其进入20S通道进行水解。
2.1 线粒体蛋白的降解
在线虫中,线粒体未折叠蛋白应答(mitochon-drial unfolded protein response,mtUPR)由转录因子Atfs-1(activating transcription factor associated with stress-1)介导。Atfs-1含有线粒体定位序列和核定位序列,正常情况下,线粒体基质蛋白酶会迅速降解进入线粒体的Atfs-1。蛋白过度积累时,Atfs-1进入胞核,上调保护性分子伴侣和蛋白酶的表达,通过促进蛋白导入和折叠、增强UPS活性以及增加ATP的单独产生来恢复线粒体功能;Atfs-1还会下调三羧酸循环途径和氧化磷酸化途径的酶来减少转录产物的积累。受损蛋白通过影响Atfs-1的定位来充当激活mtUPR的信号[9],可见mtUPR能通过调节多种代谢途径来保护线粒蛋白稳态和正常功能。酵母菌线粒体蛋白的导入减慢或过度积累会导致蛋白质合成抑制和蛋白酶体活性增强,这一过程称为错误定位蛋白应答(unfolded protein response activated by mistargeting of proteins,UPRam)[10]。在低等真核生物中,mtUPR和UPRam可能同时发生,也可能存在还未发现的特异性底物识别能力。哺乳动物的蛋白应激反应更复杂,mtUPR途径中核基因表达的调控机制和关键蛋白还有待进一步研究。
线粒体相关降解(mitochondria-associated degradation,MAD)主要清除聚集在线粒体表面的蛋白。结合在酵母菌TOM复合物的降解蛋白Ubx2在外膜出现蛋白聚集体时招募ATP酶Cdc48/VCP,后者捕获聚集体并交由蛋白酶体降解[11]。Ufd3(ubiquitin-fusion degradation protein 3)/Doa1和Vms1(VCP-associated mitochondrial stress-responsive 1)是Cdc48发挥作用所需的辅因子[12]。此外,外膜蛋白Msp1 (mitochondrial sorting of proteins 1)可以作为Cdc48的提取酶,负责清除来自其他细胞器的错定位蛋白[13]。
受损蛋白应答(mitochondrial compromised pro-tein import response,mitoCPR)是在酵母菌中新发现的质量控制机制,积累的受损蛋白激活转录因子Pdr3(pleiotropic drug-resistant 3),上调转位酶相关蛋白Cis1,促进Msp1移除受损蛋白。mitoCPR途径还能保护mtDNA、恢复氧化还原电位并促进脂质代谢[14]。哺乳动物中尚未发现mitoCPR,其分子机制也有待进一步研究。
2.2 线粒体蛋白酶
线粒体内的蛋白酶既负责降解受损蛋白,也参与正常生理条件下蛋白质的加工和更新。Lon/Pim1(proteolysis in mitochondria 1)和ClpP(caseinolytic protease proteolytic subunit)是线粒体基质中参与蛋白质量控制的主要蛋白酶。Lon的底物是轻度氧化损伤的蛋白,如乌头酸酶、转录因子A(mitochondrial transcription factor A,TFAM)等[15]。小鼠体内ClpP缺乏引起的代偿反应能预防饮食诱导的肥胖和胰岛素抵抗[16]。m-AAA(matrix AAA prote-ase)和i-AAA(intermembrane space AAA protease)位于内膜,分别降解基质和膜间隙的受损蛋白。哺乳动物线粒体内膜的Parl(presenilin associated rhomboid-like protein)蛋白酶参与Pgam5(phosphoglycerate mutase 5)等蛋白的更新[17]。凋亡相关蛋白酶HtrA2存在于膜间隙,HtrA2基因敲除鼠表现为线粒体ATP减少、ATP合成酶缺陷和膜电位下降,说明HtrA2可能参与ATP合成酶成分的翻译后修饰[18]。
3 线粒体功能障碍与糖尿病心肌病
3.1 线粒体自噬
线粒体严重受损时会触发自噬,哺乳动物中存在调控自噬的多条途径。急性应激诱导的线粒体自噬由Pink1(PTEN induced putative kinase 1)和E3连接酶Parkin介导。正常情况下,线粒体蛋白酶会立即降解进入线粒体的Pink1。线粒体去极化时,Pink1在外膜积累,招募并活化Parkin启动自噬。缺乏Tom40会影响Pink1在线粒体的定位,降低线粒体自噬的效率,说明转运系统的缺陷不仅阻碍前体转入,也会影响质量控制机制[19]。哺乳动物的自噬受体Fundc1特异性调节低氧引起的自噬。正常情况下,磷酸化的Fundc1稳定存在于线粒体外膜上,而低氧时,线粒体表面的Pgam5去磷酸化Fundc1而激活自噬。同时,外膜E3连接酶March5促进Fundc1泛素化降解,通过抑制线粒体自噬来增加低氧时的能量供应。Fundc1基因敲除鼠在高脂喂养时表现出更严重的肥胖和胰岛素抵抗,其白色脂肪组织的线粒体质量控制机制受损[20]。线粒体各降解途径共同维持线粒体和胞质的蛋白稳态,未来的研究重点仍在于揭示这些途径的分子机制。
3.2 糖尿病心肌病
糖尿病心肌病(DCM)是除冠心病、高血压、先天性心脏病等已知心脏疾病之外,由糖尿病引起的心室收缩和舒张障碍,而心力衰竭是DCM严重的并发症[21]。Ⅱ型糖尿病小鼠的心肌线粒体活性氧(reactive oxygen species,ROS)生成增多,氧化呼吸链复合物(如复合物Ⅰ、复合物Ⅲ和ATP合酶)酶活性减弱,ATP合成减少。此外,线粒体自噬标志物LC3Ⅱ(light chain 3 Ⅱ)减少,表明DCM患者心肌线粒体的电子传递链(electron transport chain,ETC)活性降低,ROS生成增多,ATP产生减少,线粒体自噬能力下降。能量不足会降低转运效率,引起前体积累和蛋白错折叠,激活mtUPR;蛋白聚集体可能在转位酶上积累,激活MAD。线粒体内ROS增多会激活Lon-ClpP途径,通过降解呼吸复合物减少ROS的产生[15]。ETC功能障碍引起的线粒体去极化导致自噬,缺乏Parkin的糖尿病小鼠心肌线粒体自噬受到抑制,并伴有脂质蓄积和DCM加重,而激活线粒体自噬则可以预防高脂饮食诱导的DCM[22]。
Hsp60上调可以看作低等生物发生mtUPR的标志,而Ⅱ型糖尿病小鼠细胞中Hsp60含量下降[24]。这可能是DCM中mtUPR途径受阻而导致受损蛋白过度积累的原因。糖尿病心肌线粒体的ETC复合物成分缺失导致其活性受到抑制,ATP产生减少。缺乏能量既可以通过影响心肌线粒体的蛋白平衡间接损伤心肌,也可以直接降低心脏舒张和收缩能力,造成心力衰竭。此外,ROS增多也会降低UPS的效率。环境改变或线粒体缺陷引起的急性氧化应激使蛋白酶体26S解离,导致有待降解的蛋白积累。这种蛋白酶体分解是可逆的,去除应激源或给予抗氧化剂可以改善泛素化蛋白的更新效率,最近的一项研究进一步确定了线粒体代谢与泛素依赖性蛋白质稳态之间存在密切关系[25]。相比之下,长期暴露在高ROS和高糖高脂环境中造成的UPS失活更容易导致线粒体破碎和细胞死亡,因此保护糖尿病患者心肌的UPS可能成为改善心功能的关键措施之一。
4 问题与展望
转运系统和降解系统的正常运作是保证线粒体健康的重要前提。在TOM、PAM、TIM23和TIM22等转位酶复合物的协作下,转运系统将重要的线粒体蛋白以前体形式运送至对应的亚区进行下一步加工和组装;而降解系统则通过mtUPR、MAD等途径最大限度地维持蛋白稳态平衡。通过对已有研究的梳理发现,DCM与这两个系统的关系密不可分。ETC的破坏导致ATP生成减少和ROS积累,ROS增多进一步损伤ECT复合物,形成恶性循环。这些因素都会对转运系统和降解系统造成不同程度的负面影响(图1)。
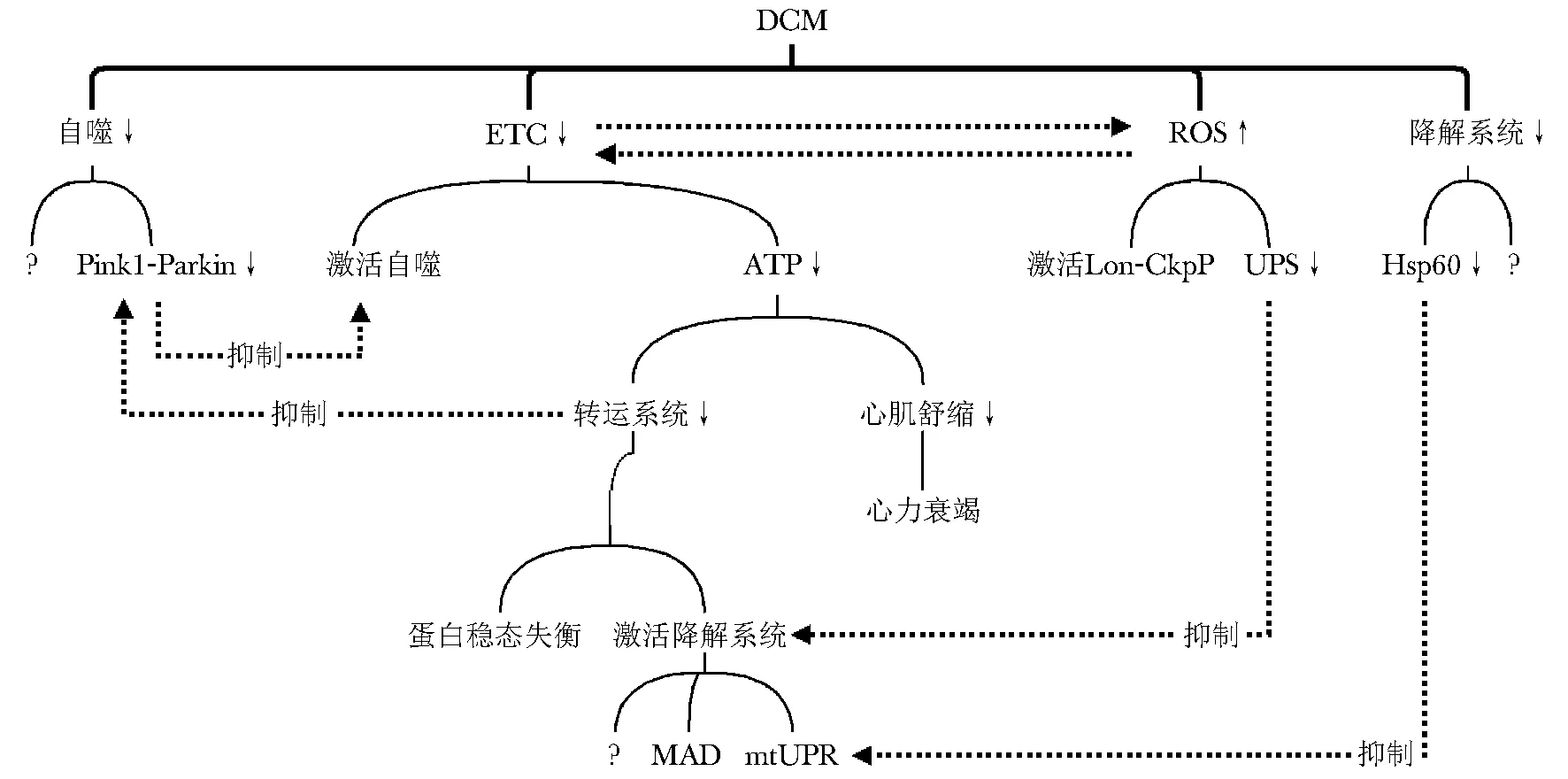
图1 DCM线粒体功能障碍的机制Fig 1 Mechanisms of mitochondrial dysfunction in DCM
目前为止,大部分的实验以酵母菌、线虫等为主要对象,但人类线粒体中转运系统和降解系统的成分与低等真核生物之间仍存在不同程度的差异,未来的研究应围绕哺乳动物以及人类细胞展开,致力于确定线粒体蛋白质量控制的分子机制和糖尿病心肌线粒体存在的相关缺陷。mtUPR在人体中如何调控核基因表达和胞质蛋白翻译?MAD途径所能降解的底物还有哪些?糖尿病心肌细胞中有哪些相关基因的表达受到抑制?在今后的科研中,线粒体仍然是糖尿病等代谢疾病的研究热点,通过实验进一步探究其在糖尿病心肌中发生的变化及分子机制可能为治疗DCM提供新的思路。
