基于RNA-seq分析顺铂下调DRG神经元轴突导向相关基因的表达
2021-10-15徐先林宋思远余春波陆红玲
徐先林,宋思远,余春波,陆红玲,卓 铭
(遵义医科大学 生物化学与分子生物学教研室,贵州 遵义 563099)
顺铂(cisplatin)是常用的化疗药物,但由于耐药和严重的毒副作用导致顺铂的应用在很大程度上受到限制[1]。周围神经损伤是铂类药物较常见的副作用[2]。目前关于顺铂神经毒性机制研究仅局限在DNA损伤及线粒体功能障碍[1],因此还有待进一步探讨。在神经系统发育过程中,神经回路的形成是神经系统正常功能的基础,神经回路发育异常可能导致神经发育障碍或者神经退行性疾病发生[3]。背根神经节(dorsal root ganglion,DRG)是铂类药物主要损伤靶点,顺铂暴露患者常出现感觉异常和麻木[4],这可能与DRG神经元轴突发育及神经回路形成异常有关。DRG神经元是收集外周感觉神经并传向中枢神经系统的中转站,需要高度活跃的转录来支持其快速的新陈代谢和轴突延伸[1]。轴突引导分子和受体是神经回路形成的关键因素,它们是轴突导向相关基因表达产物,通过局部翻译或转录控制着轴突基因表达[5]。轴突导向相关基因的异常表达或突变可导致多种神经系统疾病[5]。
本实验拟通过转录组测序技术分析顺铂对DRG神经元轴突导向相关基因表达的影响,以探讨顺铂致DRG神经元损伤的可能机制,为缓解顺铂神经元损伤提供新的研究思路。
1 材料与方法
1.1 动物与试剂
1.1.1 动物:SPF级昆明小鼠,雌雄不限,体质量25~30 g[重庆医科大学实验动物中心,生产许可证号:SCxK(渝)2018-0003]。动物实验遵循遵义医科大学伦理委员会要求。
1.1.2 主要试剂:顺铂、鼠抗NF-200抗体、胶原酶Ⅰ、多聚鸟氨酸和层黏蛋白(Sigma-Aldrich公司);山羊抗鼠二抗、RNA提取试剂盒(Invitrogen 公司);胰蛋白酶、血清、DMEM/F12(Gibco公司);DNase Ⅰ(Roche 公司);NGF(Millipore 公司),DPBS(Dulbecco’s phosphate buffered saline)、青霉素/链霉素双抗(北京索莱宝科技有限公司);其他试剂为国产分析纯试剂。
1.2 方法
1.2.1 DRG神经元的培养及分组:取1~2月龄昆明小鼠,乙醚麻醉后处死,摘取DRG神经元置于含胰蛋白酶(1 mg/mL)、胶原酶(1 mg/mL)的消化液中37 ℃消化1.5 h,1 000 r/min离心3 min后弃上清液,加入0.2 mg/mL的DNase Ⅰ 温柔吹打20次后加入DPBS液至15 mL,缓慢吹打数次,采用70 μm细胞滤器过滤后离心,弃去上清液,加入含NGF(10 ng/mL)的完全培养基温柔吹打混匀,接种于层黏蛋白和多聚鸟氨酸预处理过的24孔板中,细胞数量为每孔2×105个。实验分为对照组和损伤组。对照组细胞直接培养24 h进行后续实验;损伤组细胞接种于24孔板预培养4 h后加入20 μmol/L顺铂处理20 h。在提取RNA时,将两组细胞接种于层黏蛋白和多聚鸟氨酸预处理的6孔板中,细胞数量为2×106个。
1.2.2 免疫荧光染色检测NF-200表达情况:为了评估顺铂暴露对DRG神经元突起及生长锥形态的影响,通过免疫荧光染色检测神经元特异性骨架蛋白NF-200表达情况。取出培养板,吸去培养基,PBS清洗1次,加入4%多聚甲醛固定10 min,0.01%的triton X-100通透10 min,3%的山羊血清封闭30 min,NF-200一抗(稀释比例为1∶2 000)室温孵育3 h,PBST洗3次,二抗暗室孵育1 h,PBST洗3次,ddH2O洗1次,加入含DAPI的封片剂暗室放置30 min后在荧光显微镜下观察并拍照。
1.2.3 转录组测序分析基因表达差异:使用 RNeasy Plus Micro Kit 试剂盒进行RNA 提取,将两组RNA样本送深圳华大基因科技服务有限公司采用BGISEQ-500平台进行测序分析,每组2个重复。使用PossionDis方法进行差异检测,以log2(fold change)≥1或≤-1和FDR<0.001的基因默认为差异表达基因(differential expression genes,DEGs),并进行KEGG生物通路富集分析。
1.2.4 qPCR检测轴突导向相关基因mRNA表达:使用1.2.3中试剂盒进行RNA 提取,操作过程按照说明书要求进行。采用PrimeScriptTMRT reagent Kit将RNA反转录成cDNA,通过TB GrenTMPremix Ex TaqTMⅡ 进行qPCR扩增,反应体系为10 μL。以B2M为内参基因,通过2-△△Ct法计算基因相对表达量(表1)。

表1 qPCR引物序列Table 1 Sequence of qPCR primers
1.3 统计学分析

2 结果
2.1 顺铂对神经元突起及生长锥的影响
NF-200免疫荧光结果显示,对照组中DRG神经元突起密集,而损伤组神经元突起稀少(图1A);对照组生长锥生长状态良好,而损伤组生长锥结构出现明显坍塌并形成倒钩状回缩(图1B)。

Neurite outgrowth from DRG soma was measured by immunofluorescence of NF-200(red);A.compared with control group,the injury group had fewer neurites,and the expression of NF-200 was lower at the end of the neurites (yellow,arrows),scale bar=20 μm;B.the growth cones in control group were well extended,while the microtubule skeleton structure of the growth cones were significantly changed and obvious barbed retract in injury group (yellow,arrows),scale bar=10 μm图1 NF-200免疫荧光染色结果Fig 1 Results of NF-200 immunofluorescence staining
2.2 转录组测序结果及pathway功能分析
各样品平均产出21.79 M数据,样品比对基因组的平均比对率为 94.79%,比对基因集的平均比对率为90.52%,表明样品之间数据具有可比性,数据可用性好。与对照组相比,损伤组上调383个、下调1 101个基因(图2A)。KEGG生物通路富集分析显示,DEGs显著富集到20条通路(图2B),其中包括轴突导向通路。轴突导向通路参与神经轴突及生长锥的发育,该通路基因表达改变影响神经回路的形成。
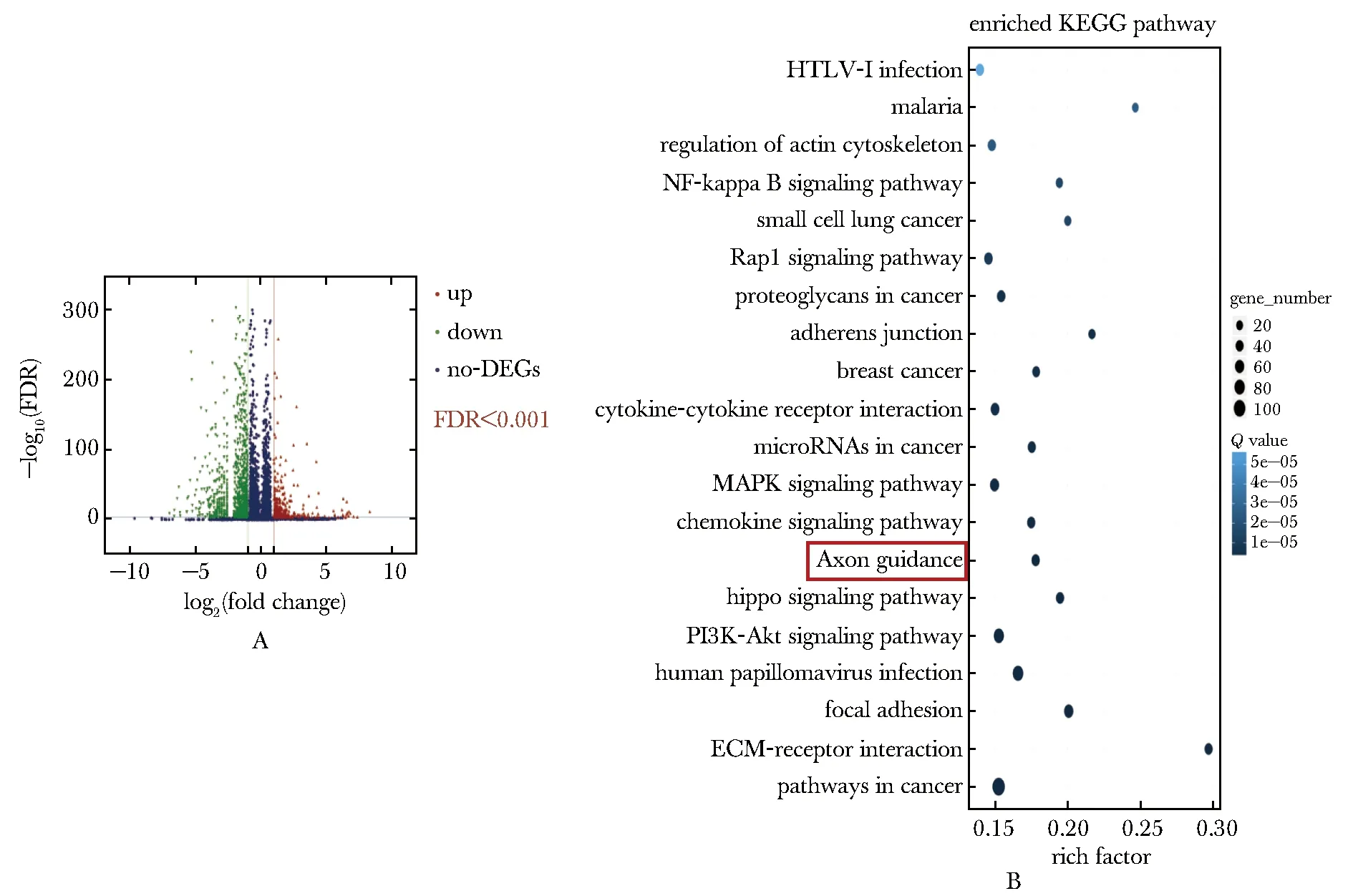
A.the Volcano-plot of the DEGs,compared with control group,383 genes are up-regulated (red)and 1 101 genes were down-regulated (green)in the injury group;B.KEGG biopathway enrichment analysis showed the differentially expressed genes (DEGs)were significantly enriched in axon guidance pathways
2.3 两组轴突导向相关基因差异分析
对231个轴突导向相关基因绘制热图和火山图(图3)。结果显示组内基因表达具有相似性,组间具有明显差异(图3A);与对照组相比,损伤组中多数轴突导向相关基因呈现表达下调(图3B)。以Log2(Fold change)≥1或≤-1和FDR≤0.001代表基因表达变化量差异,损伤组上调2个基因,下调49个基因。
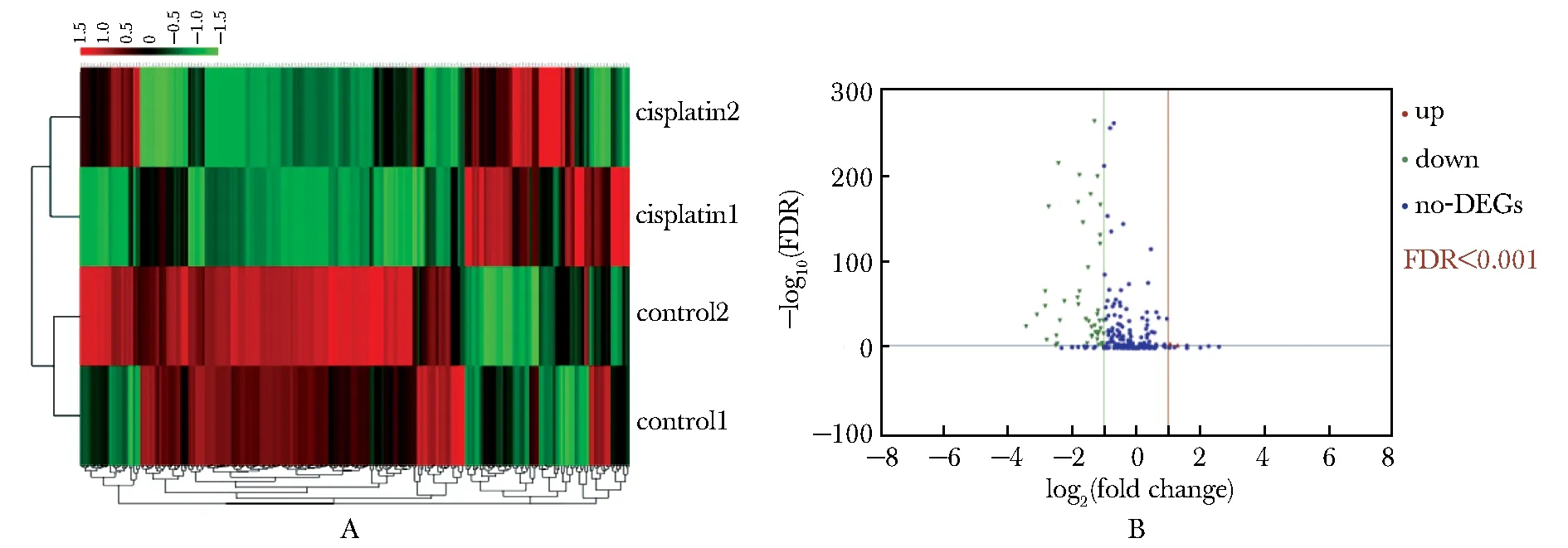
A.clustering heat map analysis of 231 axon guidance related genes in two groups;B.Volcano-plot of the differentially expressed axon guidance genes;compared with control group,2 genes were up-regulated (red)and 49 genes were down-regulated (green)in the injury group
2.4 DEGs编码蛋白质互作关系分析
蛋白质之间通常通过相互作用结合成复合物之后行使相应的功能。根据STRING蛋白质互作数据库,对51个轴突导向相关DEGs进行蛋白质互作分析(protein protein interaction network,PPI),去除无互作关系的基因。大多数DEGs的蛋白质具有直接相互作用,蛋白质相互作用主要集中在Ntn1、Nrp1、Nrp2、Sema6a、plxna2、plxna4、Slit2、Robo1等基因之间。其中,与各蛋白质联系最密切的为Ntn1、Nrp1、Nrp2、plxna4等(图4)。

Proteins interacted with each other to perform important physiological functions.Line thickness indicated the strength of data support,the thick line represented the stronger interaction图4 DEGs的蛋白质互作关系网络图Fig 4 Protein interaction diagram of DEGs
2.5 轴突导向相关基因差异表达分析
根据各个样品基因表达水平,FPKM ≤ 1为极低表达水平的基因,FPKM范围在1~10为低表达水平的基因,FPKM≥10为中高表达水平的基因。中高表达量的基因对于细胞生物学功能更加重要,选择对照组FPKM≥10,Log2(Fold change)≥1或≤-1和FDR≤0.001的基因共有15个,顺铂处理后均呈现表达下调(表2)。

表2 15个DEGs基本信息Table 2 Information of the 15 DEGs
2.6 qPCR验证部分轴突导向相关基因mRNA表达
选择差异倍数较大且在蛋白互作中与其他蛋白联系较为密切的DEGs进行qPCR验证。差异基因的mRNA相对表达量变化趋势与RNA-seq检测结果趋势一致,表明顺铂暴露后这些基因的表达下调(图5)。
3 讨论
顺铂是常用的化疗药物,它的神经毒性和相关的外周神经病变阻碍其在癌治疗中的积极作用,而目前关于顺铂神经毒性研究并不十分清楚,深入探讨其毒性机制有助于减轻顺铂副作用并促进癌治疗效果。
DRG神经元是高度极化的细胞,是感觉神经传递枢纽,其轴突生长及生长锥正确导向并形成突触连接才能发挥正常的生理功能。研究表明,轴突导向相关基因表达参与轴突生长及神经回路的形成[6]。本研究结果中,顺铂导致轴突数量减少、长度缩短及生长锥结构坍塌与回缩,且随着顺铂浓度增加轴突损伤越明显(结果未展示),表明顺铂能够抑制轴突生长及生长锥延伸并呈现剂量依赖性,这可能与顺铂改变轴突导向基因的表达有关。轴突导向基因表达产物多为轴突导向信号分子或者特异性受体,参与轴突生长发育调节。神经轴突导向因子(Ntn-1)通过与受体的特异性结合,诱导轴突的靶向生长、促进神经细胞迁移和存活、同时可抑制神经元凋亡[7]。神经纤毛蛋白-1(Nrp1)是单次跨膜受体,与Sema3a结合介导神经元轴突生长、导向及迁移[8-9]。信号素分子(semaphorinsa,semas)是广泛存在的导向分子蛋白质超家族,调节轴突引导和细胞迁移过程,如Sema6A[10]、Sema7A[11]。神经丛蛋白(plexins)是信号素家族受体,信号素分子通过神经丛蛋白参与轴突导向、神经元迁移等生理过程[12]。Slit家族参与神经轴突生长及神经细胞迁移的导向作用,Slit与受体Robo结合发挥生物学功能[13]。轴突引导信号分子与受体相互作用,调控轴突生长及生长锥的导向功能。如NELL2-Robo3复合物参与轴突的排斥[14];Sema3a-Nrp1/Plxna4信号通路促进皮层神经元基底树突分枝,但也排斥轴突[15];Ntn1与Dcc结合引导轴突生长和细胞定向迁移[16]。转录组数据显示顺铂导致众多轴突导向基因表达下调,且大多数DEGs的蛋白质直接具有相互作用,表明顺铂下调轴突导向相关基因表达可能抑制神经元轴突发育。
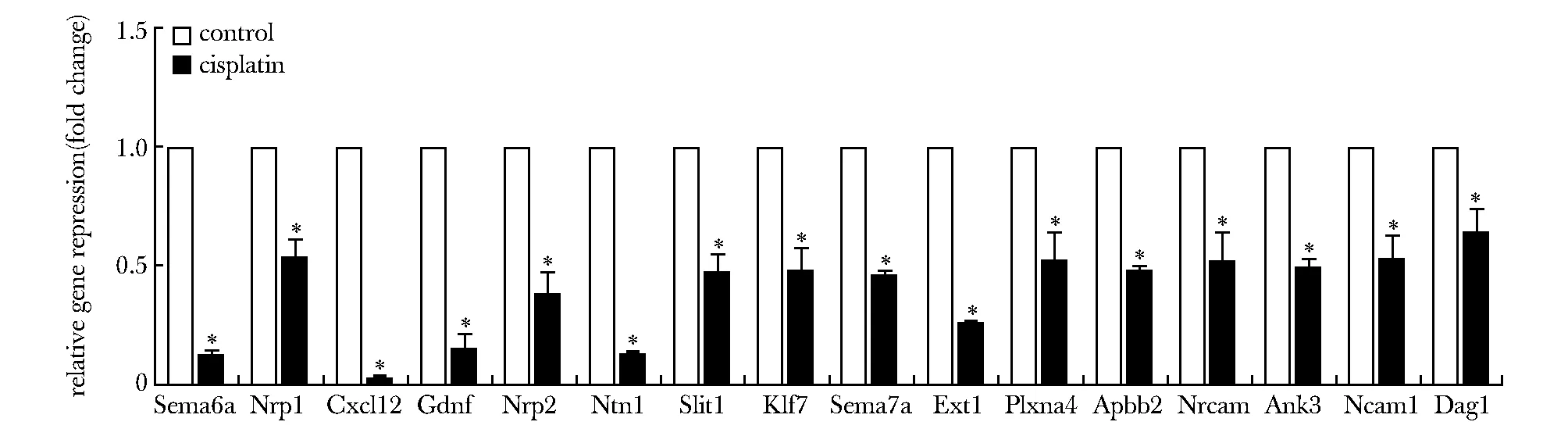
*P<0.05 compared with control group图5 qPCR检测各基因mRNA相对表达量Fig 5 Relative mRNA expression levels by n=3)
综上所述,本研究通过转录组测序技术分析顺铂暴露对轴突导向基因表达的影响,结果表明顺铂导致轴突导向相关基因表达下降可能是顺铂神经轴突毒性的重要原因,但顺铂下调这些基因的具体机制还有待探索。本研究结果对于进一步认识顺铂毒性机制并为如何改善顺铂导致的神经损伤副作用提供新的研究思路。
