特发性醛固酮增多症的病理分型和手术预后
2021-10-15王慧萍崔云英马晓森任卫东童安莉
王慧萍,崔云英,马晓森,文 进,任卫东,童安莉*
(中国医学科学院 北京协和医学院 北京协和医院 1.内分泌科,国家卫生健康委员会内分泌重点实验室;3.泌尿外科,北京 100730;2.河北北方学院 研究生学院,河北 张家口 075000)
原发性醛固酮增多症(primary aldosteronism,简称原醛)是继发性高血压最常见的原因,1955年由Conn首先发现命名,在高血压患者中占5%~18%[1]。临床常见的病因分型主要为特发性醛固酮增多症(idiopathic hyperaldosteronism,IHA,简称特醛症),约占60%,以及醛固酮瘤,约占35%,其他较少见的类型有原发性肾上腺皮质增生、家族性醛固酮增多症、分泌醛固酮的肾上腺皮质癌和异位醛固酮分泌瘤或癌[2]。醛固酮瘤可经手术切除,特醛症患者通常长期服用醛固酮受体拮抗剂治疗[3],仅极少数患者接受了手术。由于手术患者的数量很少,对特醛症患者的病理特征和手术预后的研究国内外均少见报道[3-6]。本文回顾性分析23例特醛症患者的临床和病理特点以及手术预后情况,为提高临床诊治水平提供帮助。
1 材料与方法
1.1 材料
1.1.1 研究对象:回顾性分析23例2010年至 2020 年在北京协和医院行单侧肾上腺手术切除的特醛症患者的临床资料。本组特醛症患者纳入标准:临床上均有高血压伴或不伴低血钾;立位血浆肾素活性(plasma renin activity,PRA)<1 ng/(mL·h),立位血浆醛固酮水平(plasma aldosterone concentration,PAC)>12 ng/dL,立位PAC与PRA比值(aldosterone renin ratio,ARR)>30;血浆促肾上腺皮质激素、血清皮质醇、24 h尿游离皮质醇、24 h尿儿茶酚胺结果正常,除外了库欣综合征和嗜铬细胞瘤,部分患者行1 mg小剂量过夜地塞米松抑制试验,排除了亚临床库欣综合征;CT扫描提示单侧肾上腺结节或双侧肾上腺结节样增粗或双侧肾上腺增粗;3例患者经肾上腺静脉插管取血(adrenal vein sampling,AVS)后行优势醛固酮分泌侧手术切除,对未行AVS的患者,手术切除结节较大侧的肾上腺。术后HE染色镜下病理诊断提示肾上腺皮质结节样增生,并参考2021年的国际病理学共识诊断为非经典型的患者。所有患者均签署知情同意书,本研究获得了医院伦理委员会的批准(伦理审查批号:S-K1073)。
1.1.2 临床资料:收集患者的一般情况(性别、年龄、高血压病程、低血钾病程、病程中最高血压和最低血钾)、术前指标(血压、血钾、PAC和PRA)、肿瘤情况(大小、侧别和病理诊断)、患者手术预后(血压、血钾、PAC、PRA、降压药和补钾药的使用情况)。
1.2 方法
1.2.1 HE染色和醛固酮合成酶(CYP11B2)免疫组化染色:采用苏木精-伊红染色法对手术标本染色。采用EnVision检测试剂盒(Dako公司)对切除的肾上腺组织进行醛固酮合成酶CYP11B2的免疫组织化学染色。一抗为小鼠抗CYP11B2单克隆抗体,稀释度为1∶200。小鼠CYP11B2单克隆抗体由Celso E.Gomez-Sanchez教授(美国密西西比大学医学中心)惠赠。
1.2.2 基于国际病理学共识进行分类:肾上腺皮质病变根据HE染色和CYP11B 2免疫组化染色,参考国际组织病理学共识进行分类。本组患者病理分类均为非经典型,包括:多发性醛固酮分泌结节(multiple aldosterone-producing nodules,MAPN)、醛固酮分泌微结节(aldosterone-producing micronodule,APM)、多发性醛固酮分泌微结节(multiple aldosterone-producing micronodules,MAPM),以及醛固酮分泌肾上腺皮质弥漫性增生(aldosterone-producing diffuse hyperplasia,APDH)。
1.3 统计学分析
2 结果
2.1 病理分类
本组23例患者的病理分类均为非经典型。MAPN 13例,其中2例MAPN伴APM,6例为MAPN伴MAPM。MAPM有6例,APM有 4例,1例为MAPM伴APDH(表1,图1)。这些功能结节及微结节(MAPN和MAPM)周围的增生肾上腺组织CYP11B2染色阴性,提示无功能。
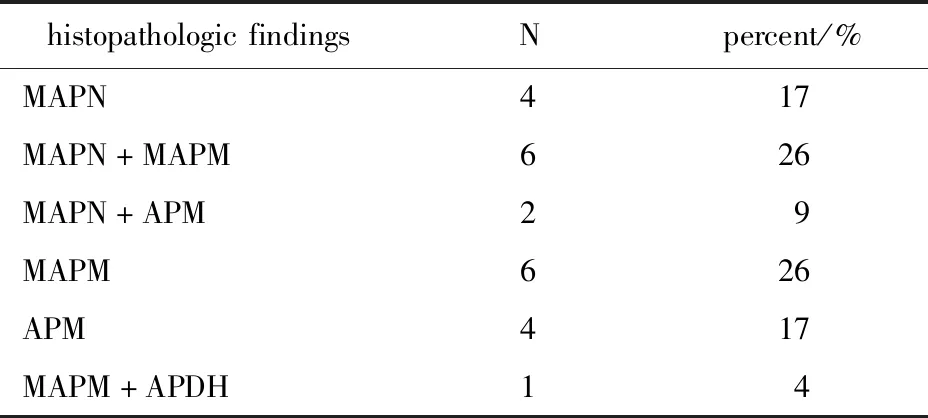
表1 患者的组织病理分类Table 1 Pathological classification of the patients
2.2 临床特点
23例患者中男性14人,女性9人,平均年龄为 (53±10,39~75)岁,高血压病程114(58,186)年,低血钾病程48(3,96)月,病程中最高SBP(186±27)mmHg (1 mmHg=0.133 kPa),最高DBP (113±19)mmHg,最低血钾(2.88±0.61)mmol/L。行单侧肾上腺手术切除,左侧17例,右侧6例(表2)。
所有患者均在术后进行了随访,中位随访时间9(6,13)个月。6例患者手术后血压和血钾恢复正常,手术治愈率为26%(6/23);17例患者术后高血压均有所缓解但血压未恢复到正常范围,术后缓解率为74%(17/23),其中16例患者需要服用降压药。除1例患者术后血钾不详外,其余16例患者中有13例血钾恢复正常(表2)。
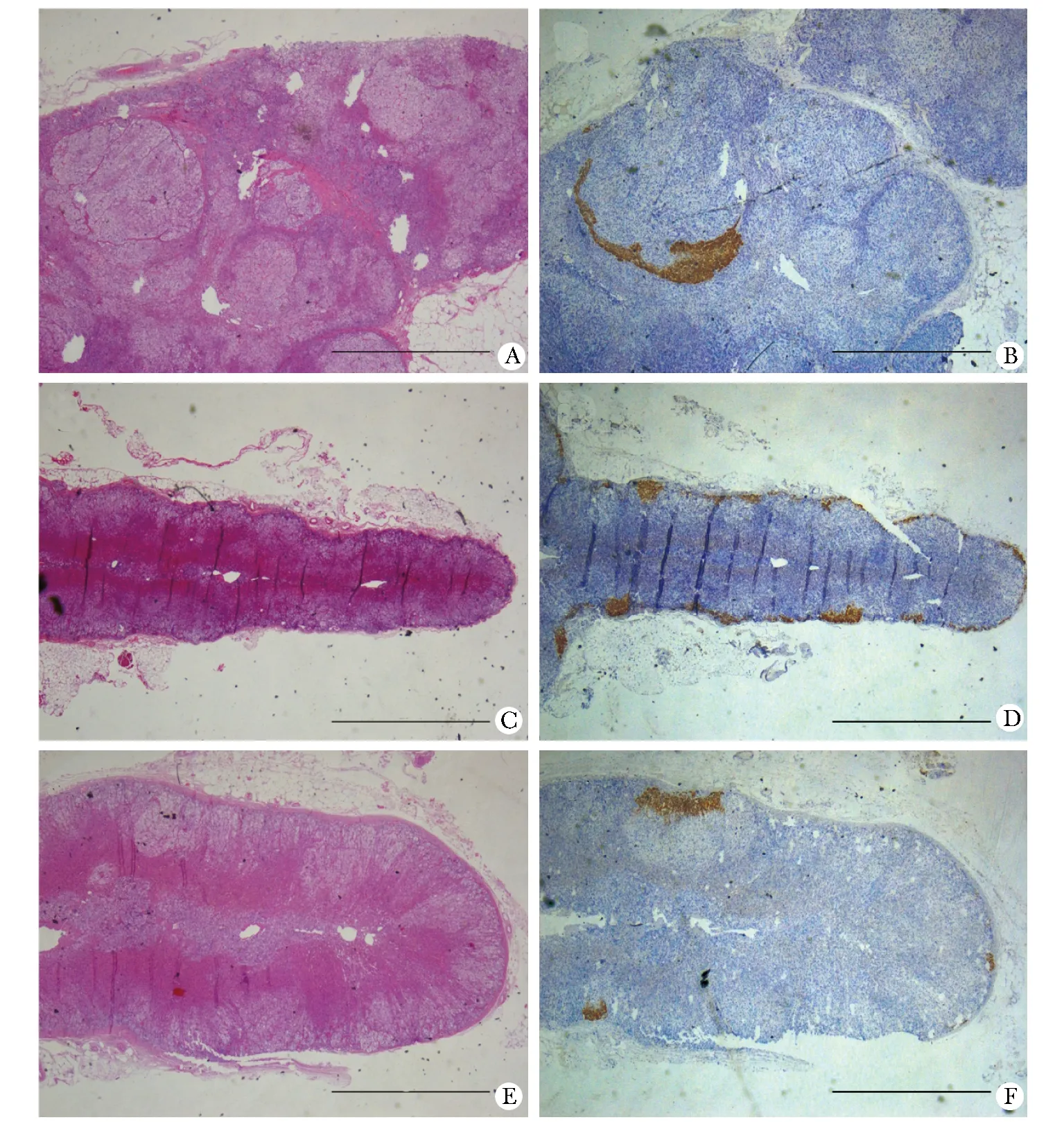
A,C,E.HE staining;B,D,F.immunostaining for CYP11B2;A,B.MAPN;C,D.MAPM+APDH;E,F.MAPM;scale bar=2 mm图1 HE染色及醛固酮合成酶(CYP11B2)的免疫组化染色结果Fig 1 HE staining and immunostaining of CYP11B2
2.3 比较手术治愈组和缓解组患者的临床特点差异
与缓解组相比,治愈组患者术前SBP和DBP更低。术后随访,治愈组患者停用降压药及补钾药,患者的血压和血钾均完全正常;缓解组患者术后94%的患者需要用降压药控制血压,仍有19%的患者存在低血钾(表2)。
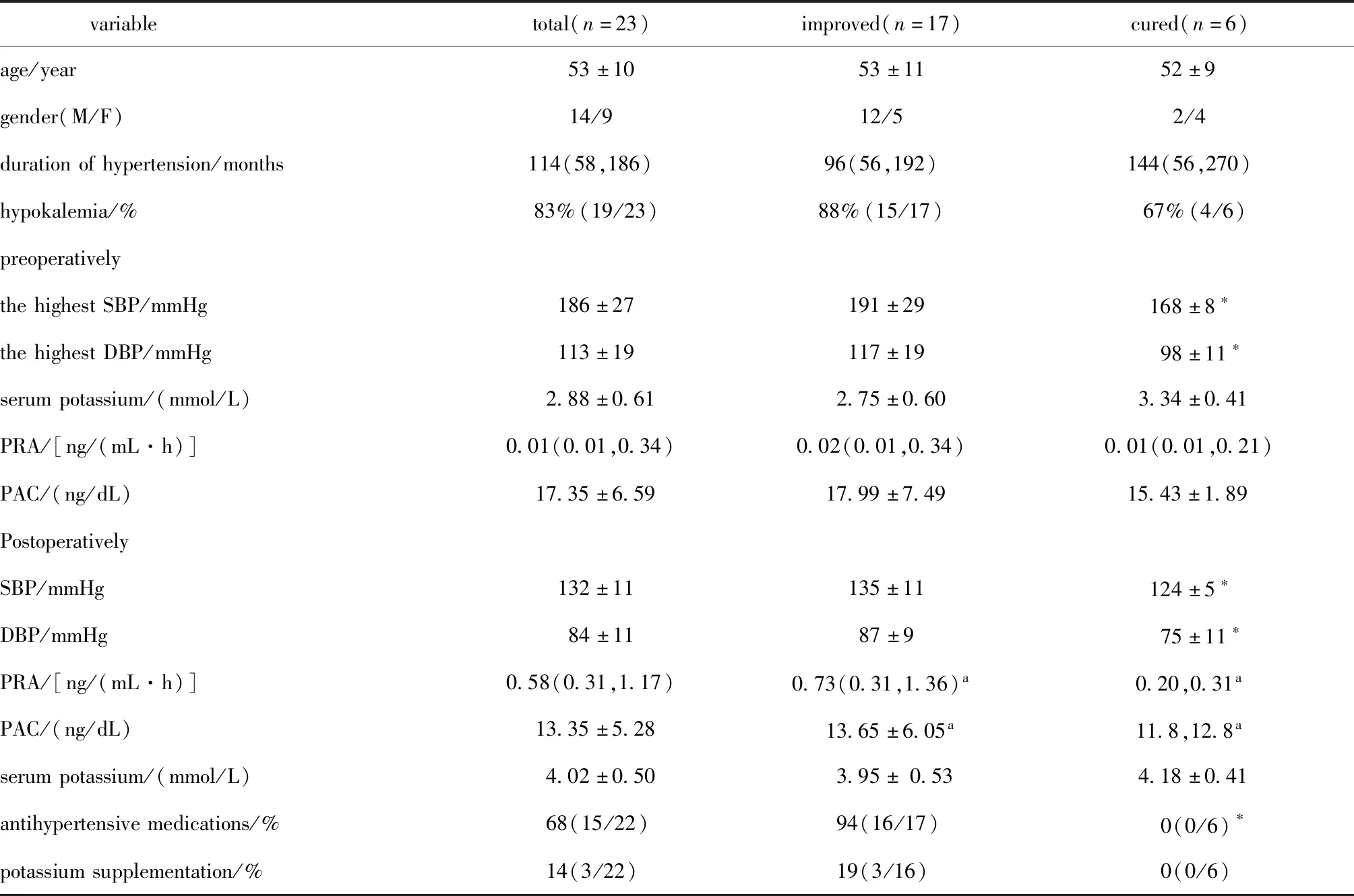
表2 特醛症患者术后治愈组和术后缓解组间的临床特点的比较Table 2 Comparison of clinical characteristics between IHA patients with and without surgical cure
2.4 3例行AVS患者的临床特点和术后转归
3例行AVS患者的临床资料(表3)。3例患者AVS侧别指数2.36~5.37,术后血钾均正常,血压均较术前下降,但未恢复正常,需要服用降压药治疗。
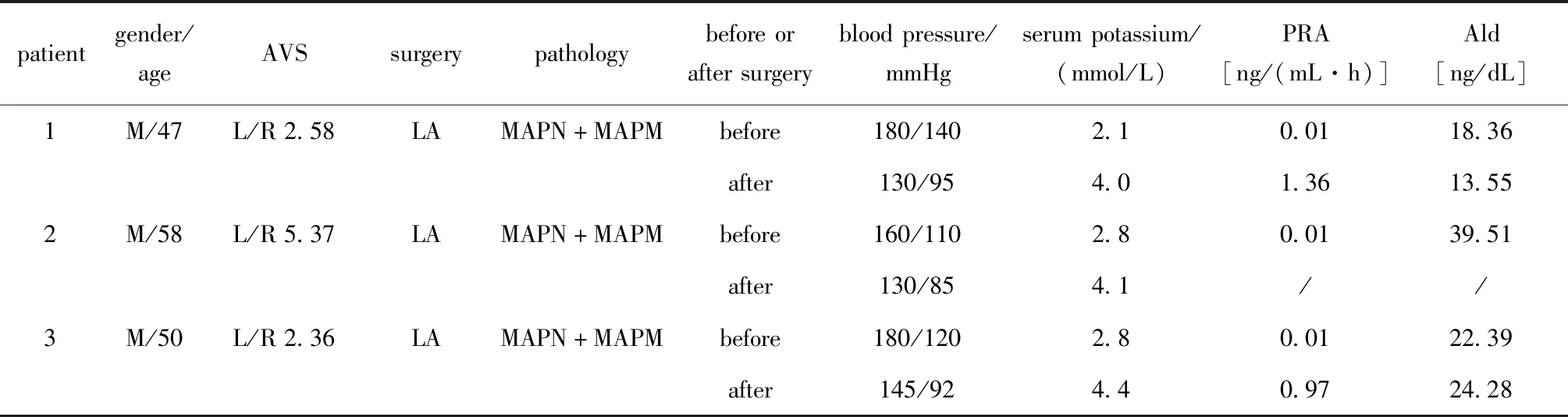
表3 3例行AVS患者的临床特点和术后转归Table 3 Clinical features and postoperative outcomes of three patients with AVS
3 讨论
目前对特醛症患者病理方面的研究甚少,特醛症的肾上腺皮质中存在分泌醛固酮的结节、微结节或弥漫性球状带增生[3,7-8]。本研究在23例特醛症肾上腺中,发现以多发性功能结节和微结节为主,仅1例患者存在弥漫性球状带增生。这些功能结节及微结节周围的增生肾上腺组织无醛固酮分泌功能。本研究提示,尽管特醛症患者在影像学上常表现为肾上腺增粗,但醛固酮分泌增多常常并非来自这些增粗的肾上腺,而来自于功能性结节和微结节,部分结节在影像学检查中由于体积太小而无法被发现。
本研究中,由于切除的肾上腺中均存在分泌醛固酮的功能结节或微结节,手术后所有患者的高血压得到了一定程度的缓解,其中有26%的患者术后完全治愈,提示手术切除的肾上腺病变是其主要的责任病灶。部分患者术后血压未恢复正常,可能原因:1)对侧肾上腺可能存在分泌醛固酮的病变,2)血管病变较重,术后即使醛固酮下降,患者的血压仍不能恢复正常。
特醛症常用醛固酮受体拮抗剂治疗,但该药物无法完全阻断醛固酮对心、肾等靶器官的损害,而手术切除肾上腺后部分减轻高醛固酮血症,减少对靶器官的损害。对于病情较重的患者可经AVS评估后手术切除优势侧肾上腺[9-10]。本研究中有3例行AVS,手术切除优势侧后血压均下降但仍未恢复正常。本研究其他病例未做AVS直接行单侧肾上腺切除,患者也能有不同程度的临床获益。这提示,对临床症状较重的特醛症患者可行手术治疗,如能在AVS指导下进行单侧肾上腺切除,术后缓解率和治愈率可能会更高。
本研究不足:1)样本量较少;2)术后仅部分患者进行了PRA和PAC测定,需要进一步对患者的生化缓解情况进行研究。
综上,特醛症肾上腺病理以多发性功能结节和微结节为主。单侧肾上腺切除后所有患者的高血压不同程度缓解,其中26%的患者血压正常,提示手术可能给特醛症患者带来一定的临床获益。
