分子伴侣Rer1参与人胚胎肾上皮细胞系HEK293T中hERG钾通道蛋白转运
2021-10-15陈邦盛余小玲毛飞燕廉姜芳俞徐云
陈邦盛,余小玲,毛飞燕,廉姜芳,俞徐云*
(1.宁波市鄞州第二医院 急救医学中心,浙江 宁波 315192;2.中国科学院大学宁波华美医院(宁波市第二医院)普外科,浙江 宁波 315010;3.宁波市医疗中心李惠利医院兴宁院区 心血管内科,浙江 宁波 315040)
遗传性长QT综合征(hereditary long QT syndrome,hLQTS)是一组编码心肌复极化离子通道HERG(human ether-à-go-go related gene,hERG)基因突变而导致的一种遗传性离子通道病,临床上以QT间期延长、尖端扭转型室速、晕厥甚至猝死为主要表现[1-2]。研究表明,hLQTS的发病机制是由于内质网质量控制系统使错误折叠的hERG变异体滞留在内质网致细胞膜成熟hERG钾通道蛋白减少[3]。在多肽链折叠转运过程中,分子伴侣常识别并结合于折叠中间产物的疏水端,防止多肽链异常聚集,直至其折叠成为正确或相对正确结构才与之分离[4],目前对于分子伴侣辅助新生蛋白折叠转运的研究多集中在内质网区域,近期研究表明,内质网后质量控制系统在相关的构象疾病中发挥重要作用[5],但对疾病的潜在影响尚不清楚,Rer1是位于内质网高尔基中间体(ER-Golgi intermediate compartment,ERGIC)的分子伴侣[6],其在蛋白质转运过程中发挥一定作用,但对hERG钾通道的转运机制仍不明确。本研究利用免疫荧光、免疫印迹及膜片钳等方法,探究Rer1在hERG钾通道蛋白转运过程中的作用,从而为hLQTS发病机制的研究提供一个新的方向。
1 材料与方法
1.1 材料
人胚胎肾上皮细胞系(HEK293T)和质粒pcDNA3-hERG、pcDNA3-hERG-A561V(宁波市医疗中心李惠利医院中心实验室);DMEM培养基(Hyclone公司);胎牛血清、胰蛋白酶(Hyclone公司);Rer1(山羊来源)一抗(Novusbio公司);HERG(兔来源)一抗(Alomone公司);Lipofectamine 2000(Invitrogen公司);Baf A1(Abcam公司);siRNA-Rer1质粒(上海吉凯基因公司合成);质粒中提试剂盒(Omega公司)。
1.2 方法
1.2.1 质粒的制备及细胞的培养:扩增并提取质粒,测DNA浓度和纯度。复苏HEK293T细胞后,按比例接种于60 mm的培养皿中,加入高糖DMEM 4 mL,置于37 ℃、5%CO2的培养箱中孵育。
1.2.2 细胞模型的分组构建及处理:将HEK293T细胞按2×105个/mL的浓度接种在有盖玻片的60 mm培养皿中,待汇合至90%左右,分别转染pcDNA3-WT-HERG、pcDNA3-A561V-HERG、pcDNA3-WT/A56lV-HERG各2.5 μg构建野生、突变及混合转染细胞模型。
1.2.3 Western blot检测各组hERG及Rer1蛋白的表达:培养各组细胞48 h后提取蛋白并BCA法测浓度,配制12% SDS-PAGE分离胶,电泳1.5 h后转膜,随后用5%的脱脂奶粉封闭1 h并用TBST洗4次,分别加一抗(HERG 1∶400;Rer1 1∶200)后4 ℃冰箱过夜。次日吸出一抗,TBST清洗后加用二抗(tubulin 1∶1 000)孵育1 h后进行曝光,实验数据采用image J软件定量分析。
1.2.4 免疫荧光检测各组hERG蛋白的表达:采用4%的多聚甲醛固定细胞,PBS浸洗后用0.5% Triton X-100室温通透20 min,再次浸洗后滴加5% BSA,37 ℃封闭30 min,弃封闭液,培养皿中滴加足量的一抗HERG(1∶25),4 ℃孵育过夜;次日吸干液体后滴加荧光二抗Cy3(1∶200),37 ℃孵育30 min后滴加DAPI避光孵育5 min,用20%甘油封闭培养皿,荧光显微镜观察采集图像。
1.2.5 Western blot检测Rer1敲低后hERG蛋白的表达:在构建的各组细胞中分别加入siRNA-Rer1及scramble质粒共9组,继续培养各组细胞48 h后提取蛋白并采用Western blot检测蛋白质表达水平(步骤同1.2.3)。
1.2.6 Western blot检测Baf A1孵育后hERG蛋白的表达:培养细胞构建各细胞模型,采用Baf A1以1 mmol/L的浓度进行孵育6 h,Western blot检测hERG的表达(步骤同1.2.3)。
1.2.7 膜片钳技术记录Baf A1孵育前后混转细胞的电流:消化各组细胞并待细胞贴壁稳定后选取荧光度强、细胞表面光滑、状态佳的细胞,通过显微操纵仪使电极尖端与细胞膜形成巨阻抗封接,待阻抗达1 GΩ以上,撤除负压后给予破膜,并使破膜后电阻亦维持在1 GΩ以上,记录各细胞电容。维持钳制电压-80 mV,测试电压从-60 mV开始,以10 mV为阶跃,刺激至+60 mV,然后复极化到-40 mV,持续4 s,继之回到-80 mV,尾电流在-40 mV期间获得。
1.3 统计学分析

2 结果
2.1 hERG及Rer1在细胞内的表达
野生组hERG蛋白表达未成熟的135 ku及成熟的155 ku蛋白,A561V突变组表达135 ku蛋白及极少量155 ku蛋白,混转组则以表达未成熟的135 ku蛋白为主,并部分表达155 ku蛋白。与野生组相比,混转组未成熟hERG蛋白明显升高(P<0.01),突变组则明显减低(P<0.05);而成熟hERG蛋白在突变组显著下调(P<0.01)(图1A,B)。此外,Rer1是一种分子质量为23 ku高尔基体侧的分类受体,相对于野生组,Rer1的表达量在突变组及混转组中明显降低(P<0.01)(图1C,D)。
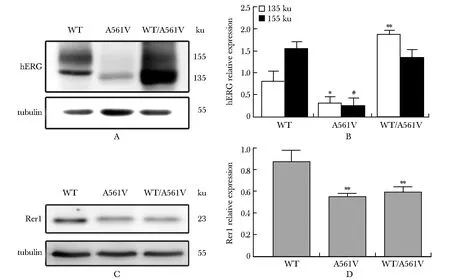
A.hERG expression detected by Western blot;B.relative expression of hERG;*P<0.05,**P<0.01 compared with WT group in 135 ku group;#P<0.01 compared with WT group in 155 ku group;C.Rer1 expression detected by Western blot;D.relative expression of Rer1,**P<0.01 compared with WT group
2.2 免疫荧光染色检测细胞内hERG的表达
A561V突变组与对照组及野生组相比细胞分布明显减少、细胞聚集成团,且突变组hERG蛋白在细胞质中明显聚集,而其余几组均有细胞膜及细胞质的定位,在融合图像中,混转组与野生组相比,hERG蛋白的膜表达有所减少(绿色荧光代表hERG,蓝色荧光代表核染色)(图2)。

图2 免疫荧光染色分析各组hERG蛋白的表达Fig 2 Analysis of hERG expression by immunofluorescence staining in each (×200,scale bar=100 μm)
2.3 Rer1参与hERG蛋白的细胞内转运并抑制其顺向转运
与空白对照组相比,采用小干扰RNA技术成功敲低Rer1表达水平后(图3A),各组细胞中未成熟hERG蛋白对于Rer1的下调并不十分敏感,此外,与scramble对照组相比,仅混转组出现未成熟hERG蛋白的减低,但无显著性差异(图3B);而相对于空白组,各组细胞中成熟hERG蛋白的表达均有一定水平的增加,在野生组中成熟hERG蛋白明显增加(P<0.05),同时,与scramble对照组相比,野生组成熟hERG蛋白表达亦明显增加(P<0.05)(图3C)。
2.4 Baf A1孵育促进hERG蛋白细胞内转运
与对照组相比,在采用Baf A1孵育后混转组未成熟hERG蛋白的表达水平明显上调(P<0.05)(图4A,B);此外,野生及突变组成熟hERG蛋白的表达在Baf A1孵育后显著高于对照组(P<0.05),而混转组成熟hERG蛋白并无显著差异(图4A,C)。
2.5 Baf A1孵育混转细胞后增强hERG尾电流
混转组细胞未进行Baf A1孵育时,尾电流较小,而采用Baf A1进行孵育后,电流密度得到明显增强,并且激活电压从-20 mV到60 mV,混转细胞中Baf A1孵育组细胞株尾电流相对电流密度明显高于混转对照组(P<0.05)(图5)。
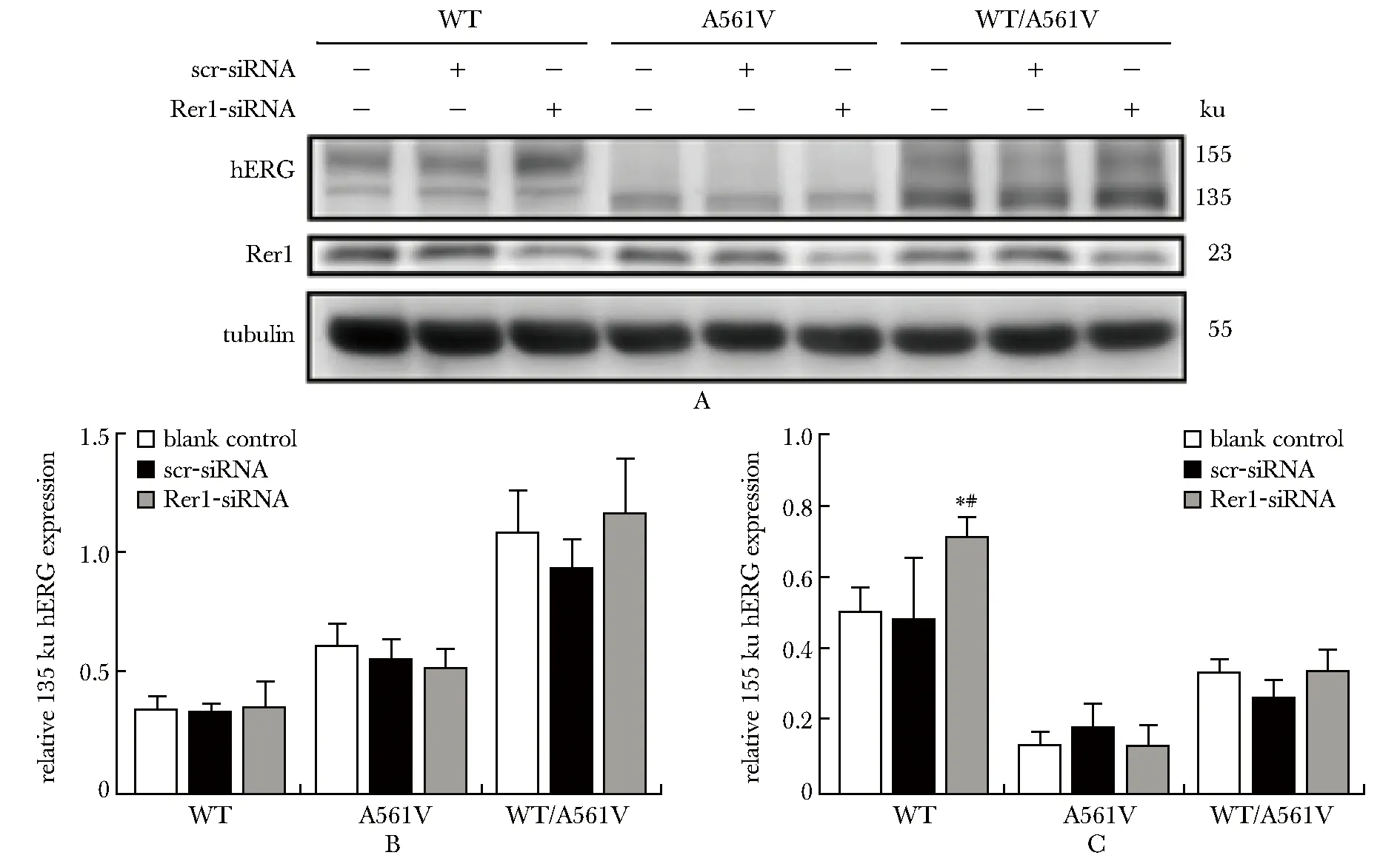
scr-siRNA.scramble-siRNA;A.knockdown of Rer1 on expression of hERG was detected by Western blot;B.relative expression of 135 ku hERG;C.relative expression of 155 ku hERG;*P<0.05 compared with blank control group;#P<0.05 compared with scramble control group
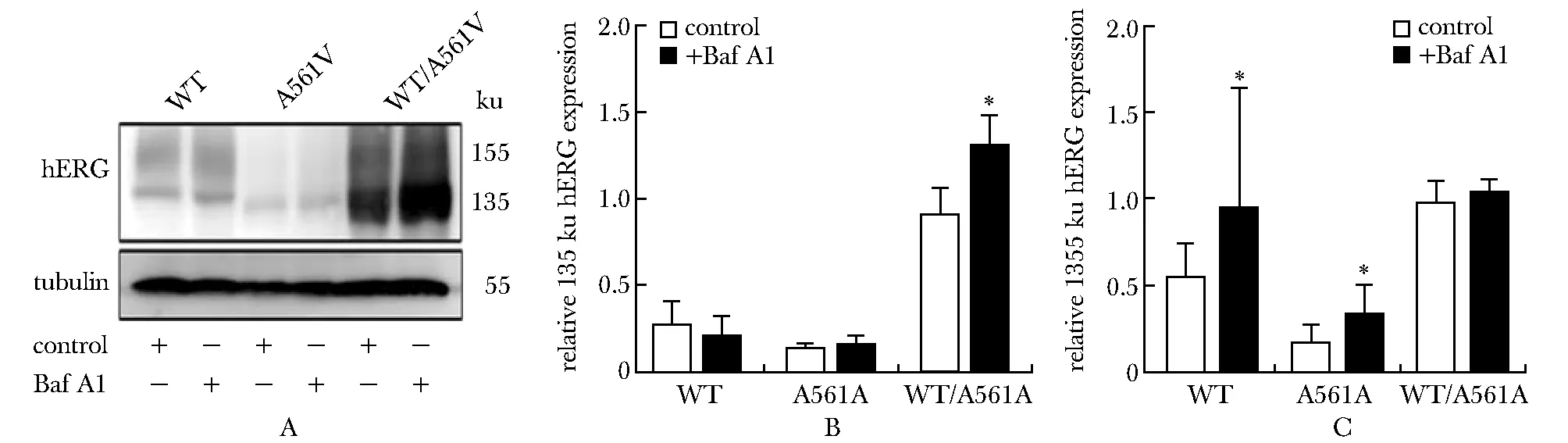
A.expression of hERG was detected by Western blot under treated with or without Baf A1;B.relative expression of 135 ku hERG;C.relative expression of 155 ku hERG;*P<0.05 compared with control
3 讨论
蛋白质转运异常致未成熟hERG蛋白滞留内质网是hLQTS的主要致病机制,异常蛋白的滞留引发内质网应激并触发未折叠蛋白形成[7-8],有研究表明内质网后区室的分子伴侣是蛋白质早期分泌途径的重要质量控制因子[9],因此,深入探讨内质网后区室分子伴侣与hLQTS的内在机制,对于hLQTS发病机制的研究具有重要意义。
Rer1是一个典型的内质网后区室分子伴侣,已证实Rer1参与γ-分泌酶的细胞内转运,下调Rer1可以削弱Notch信号并导致小鼠大脑皮层发育受损[10]。此外,Fet3p、Secl2p、Mns1p和Sec71p等多种蛋白也可在Rer1p的作用下被逆转运回内质网[11]。但是,Rer1在蛋白转运异常致hLQTS的研究尚无相关报道。本研究采用HEK293T细胞构建野生、突变、混转细胞模型,发现A561V突变可致hERG蛋白转运异常并使Rer1表达明显减低,而小干扰 RNA(siRNA)敲低Rer1表达可促进部分相对成熟hERG蛋白的顺向转运,表明Rer1参与了hERG通道蛋白的细胞内转运而且对于异常蛋白可能起较强的识别及逆转运作用,从而保证了分泌蛋白的正确构象。
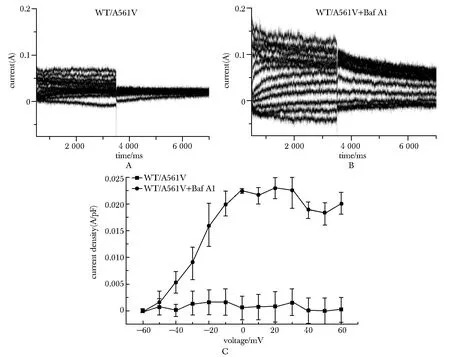
A,B.representative IhERG recordings respectively under Baf A1 treated and untreated conditions;C.mean normalized tail current data for each expression conditionare plotted following each command pulse
研究证实混转型通道蛋白并非功能完全丧失,错误折叠但部分功能蛋白的过早降解是导致LQTS和囊性纤维化等构象病的致病机制[5],若能正常转运至细胞膜仍能发挥一定的代偿功能[12]。既往研究表明,高浓度的Baf A1可以抑制蛋白从高尔基体向内质网的逆向转运[13],这与敲低Rer1表达有类似作用。在本研究中,采用Baf A1孵育可使野生及突变组成熟hERG蛋白明显增加,而混转组则仅仅表现为未成熟hERG蛋白显著上调,为此,进一步通过膜片钳对有潜在功能的混转细胞检测膜电流,发现Baf A1孵育后尾电流密度明显强于对照组,这表明Baf A1虽然不能使混转组成熟hERG蛋白的表达增加,但仍可增强混转组细胞膜上的尾电流,出现这种结果的可能原因是Baf A1抑制了核内体的内吞从而导致混转组未成熟hERG蛋白的显著增加,但Baf A1同时也增强了混转组hERG钾离子通道蛋白的质膜循环从而导致膜电流增加。
综上所述,分子伴侣Rer1主要通过介导蛋白的逆向转运参与hERG钾通道蛋白转运,而敲低Rer1可以促进蛋白的顺向转运。此外,对于有潜在功能的混转型细胞Baf A1可以恢复hERG钾通道的膜电流,这也为hLQTS发病机制的研究提供了一种新的思路。
