EGFR基因19外显子del18bp突变检测技术平台的构建及优化
2021-10-15蒋艳芳向花花文小莎郭紫芬
蒋艳芳,谭 黎,向花花,文小莎,郭紫芬
(南华大学 药物药理研究所 湖南省分子靶标新药研究协同创新中心 湖南省肿瘤微环境响应药物研究重点实验室,湖南 衡阳 421001)
研究显示,在包括肺癌在内的各种肿瘤中都存在一定程度的表皮生长因子受体(epidermal growth factor receptor,EGFR)过表达,EGFR已成为相关肿瘤尤其是肺癌化疗研究的重要靶标[1-2]。多数非小细胞肺癌(non-small cell lung cancer,NSCLC)患者中均可检测到EGFR基因突变,肺癌经确诊后的5年生存率较低[3]。因此,早发现、早诊断和早治疗是提高肺癌生存率的关键。肺癌的基因突变一直是近年来的研究热点[4-5],现有证据表明,EGFR基因突变可能与EGFR靶向药物TKI的敏感性密切相关[6-8]。EGFR基因酪氨酸激酶区域存在的多种突变能够很好地预测TKI的治疗效果,如《科学》杂志[9]和《新英格兰医学杂志》[10]曾报道EGFR基因突变与吉非替尼疗效关系密切。本实验拟采用普通PCR及重叠PCR对肺癌EGFR基因19外显子的del18bp(Del L747-P753 ins突变)进行体外重组,即将D18MT基因片段插入pDM19-T质粒中构建突变型重组载体,以提供后续实验基础,旨在构建分子开关检测平台为肺癌早期诊断以及TKI的靶向用药提供实验依据。
1 材料与方法
1.1 材料
大肠埃希菌E.coliDH5α菌株(本实验室保存);引物(上海生工生物工程公司合成);pMD19-T质粒(TaKaRa公司);2×Taq PCR Master Mix,2×pfu PCR Master Mix,DNA提取试剂盒和质粒抽提试剂盒(北京天根生化科技有限公司)。本实验所用引物序列引自文献[1]。其中P1~P4用于构建EGFR基因野生型(WT)和D18MT突变重组质粒的引物,D18-S和Wide-AS用于检测EGFR基因D18MT型突变的分子开关引物。同时合成pMD19-T 载体的一对通用引物M13-47和RV-M,用于菌液PCR。具体引物序列见表1。

表1 所用引物序列Table 1 Sequence of primers used
1.2 实验方法
1.2.1 DNA的提取:取适量冻存的健康人血液及3例肺癌组织样本,按血液/组织DNA提取试剂盒说明书操作提取得健康人全血基因组及肺癌组织DNA,用MD2000D微量紫外分光光度计检测其浓度和纯度。
1.2.2EGFR基因19外显子del18bp位点片段的扩增:以上述提取的健康人全血基因组DNA为模板,据引物和高保真DNA聚合酶介导的PCR的不同搭配(表2),用特异性引物扩增得到WT、片段A和B。反应体系:基因组DNA模板 0.5 μL,10 μmol/L引物(P1/P4或P1/P2或P3/P4)各0.5 μL,2×Taq PCR Master Mix(WT)/2×pfu Master Mix(片段A或B)6.25 μL,补足ddH2O至12.5 μL。反应条件:94 ℃预变性3 min,94 ℃变性30 s,56 ℃/60 ℃/58 ℃退火30 s,72 ℃延伸40 s。重叠PCR得D18MT:以片段A和B作为模板,反应体系(2×Taq PCR Master Mix)、反应条件同上(94 ℃预变性5 min,退火温度为62 ℃),4 ℃保存。产物经2%琼脂糖凝胶电泳,用琼脂糖凝胶DNA回收试剂盒进行胶回收,经MD2000D微量紫外分光光度计测浓度(≥5 ng/L)或纯度(A260/280:1.7~1.9),-20 ℃保存。
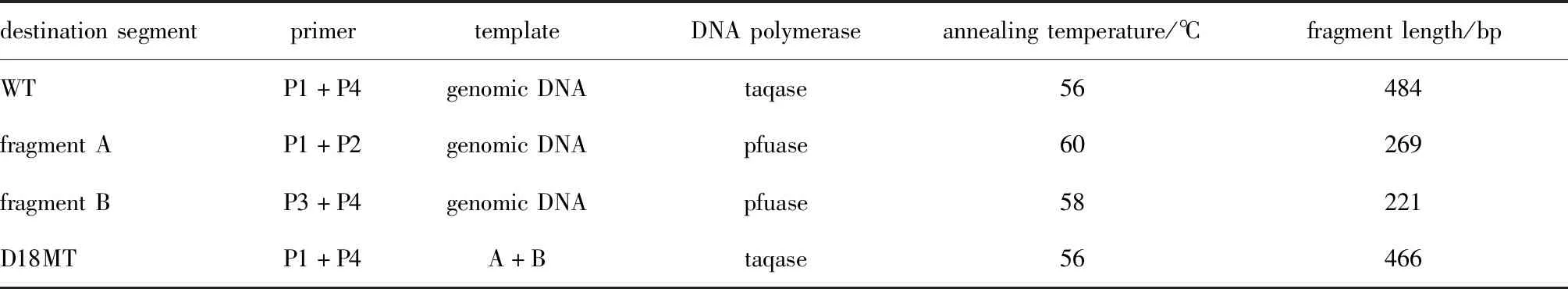
表2 EGFR基因19外显子del18bp扩增PCR反应Table 2 EGFR gene exon 19 del18bp amplification PCR reaction
1.2.3 野生型和突变型重组质粒的构建及鉴定:将WT片段和D18MT片段分别插入pMD19-T载体,再转化至大肠埃希菌DH5α感受态细胞中,涂抹至LB/Amp/IPTG/X-Gal平板上进行蓝白筛选,挑取单个白色菌落接种至含Amp的LB液体培养基,37 ℃过夜振荡培养,即得野生型质粒和突变型质粒。每组挑取单克隆菌液进行菌液PCR,产物经2%琼脂糖凝胶电泳。菌液PCR反应体系:单克隆菌液1.0 μL为模板,100 μmol/L的RV-m和M13-47引物各0.5 μL,2×Taq PCR Master Mix 5.5 μL,ddH2O补足至12.5 μL。反应条件:94 ℃预变性3 min;94 ℃变性30 s,45 ℃退火30 s,72 ℃延伸78 s;72 ℃终延伸5 min;4 ℃保存。并将阳性菌液送至上海生工生物工程公司进行DNA测序。
1.2.4 突变检测技术平台的构建及优化:采用正交设计优化突变检测技术平台。以PCR中的模板量、引物量、循环数、退火温度为正交设计的4个因素,每个因素设计3个水平。根据L9(34)正交设计表设计实验方案如表3所示。产物经3%琼脂糖凝胶电泳。
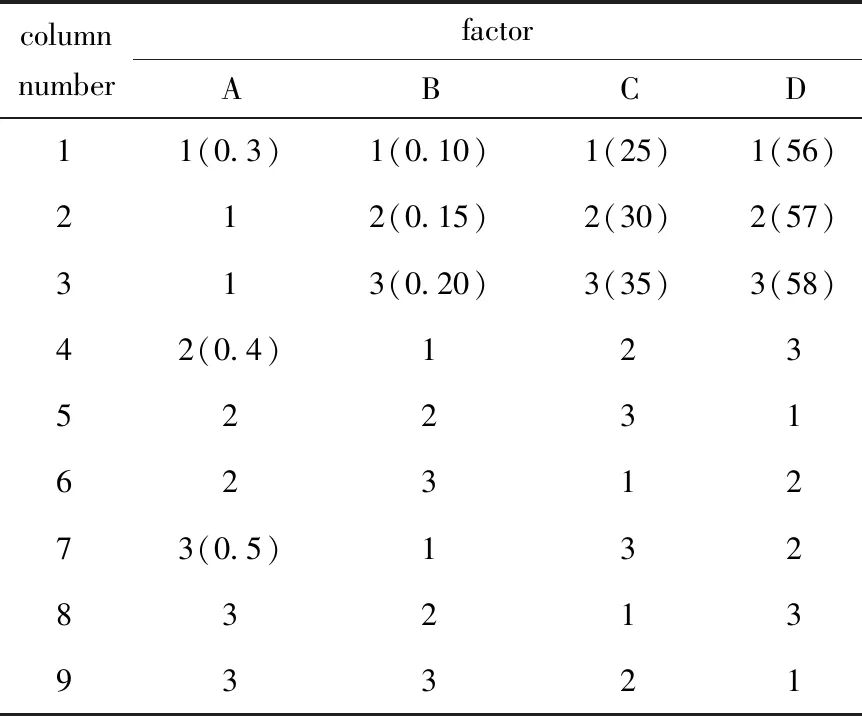
表3 正交设计方案L9(34)Table 3 Orthogonal design scheme L9 (34)
1.2.5 突变检测技术平台灵敏度的检测:将D18MT突变模板按102、101、10-1、10-2、10-3、10-4、10-5和10-6(copies/μL)稀释,其他条件按上述确定的最优检测条件进行PCR。产物经3%琼脂糖凝胶电泳。
1.2.6 肺癌组织样本的检测:以提取的3例肺癌样本组织DNA为模板,并以上述构建的D18MT为阳性对照,以WT为阴性对照,其他条件按确定的最优检测条件进行PCR。产物经2%琼脂糖凝胶电泳。
2 结果
2.1 扩增EGFR基因19外显子del18bp位点片段
单重PCR扩增产物WT片段约在484 bp处有清晰条带(图1A);重叠PCR扩增产物片段A和B大小分别在约269和211 bp处有清晰条带,D18MT在约466 bp处出现清晰条带,与预期片段大小基本一致(图1B)。
M:a 100 bp DNA Ladder marker;A:1,2 were WT products;B:D18MT overlapping PCR product,1.D18MT,2.fragment B,3.fragment A图1 EGFR基因19外显子del18bp位点片段扩增产物Fig 1 Amplification products of EGFR gene exon 19 del18bp fragment
2.2 野生型重组质粒、突变型重组质粒的构建及鉴定
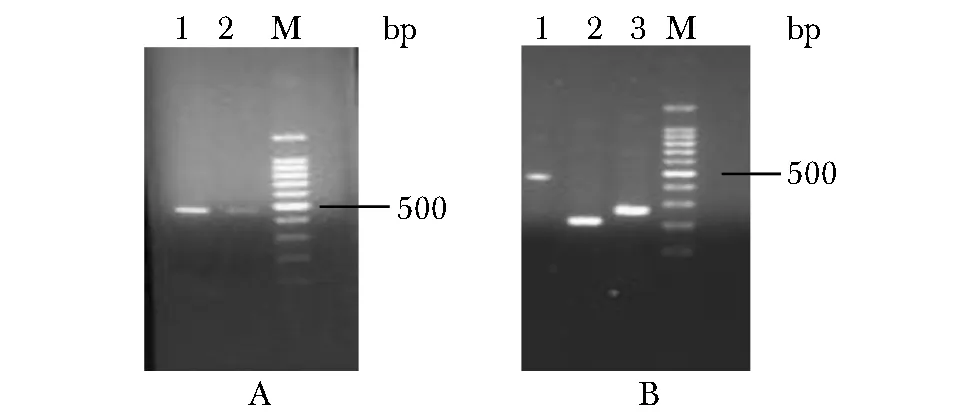
所挑选4组野生型质粒、3组突变型质粒菌液PCR扩增产物目的片段均与预期一致(图2)。
M.a 100 bp DNA Ladder marker;A.represents the PCR product of wild-type WT,1-4.wild-type plasmid;B.mutant D18MT plasmid bacterial solution identified by agarose gel electrophoresis,1-3.mutant-type plasmid图2 野生型和突变型重组质粒菌液PCR琼脂糖凝胶电泳的结果Fig 2 PCR agarose gel electrophoresis results of wild- type and mutant recombinant plasmid bacteria
2.3 测序结果
与EGFR基因序列做BLAST同源性分析,与预期结果一致(图3)。
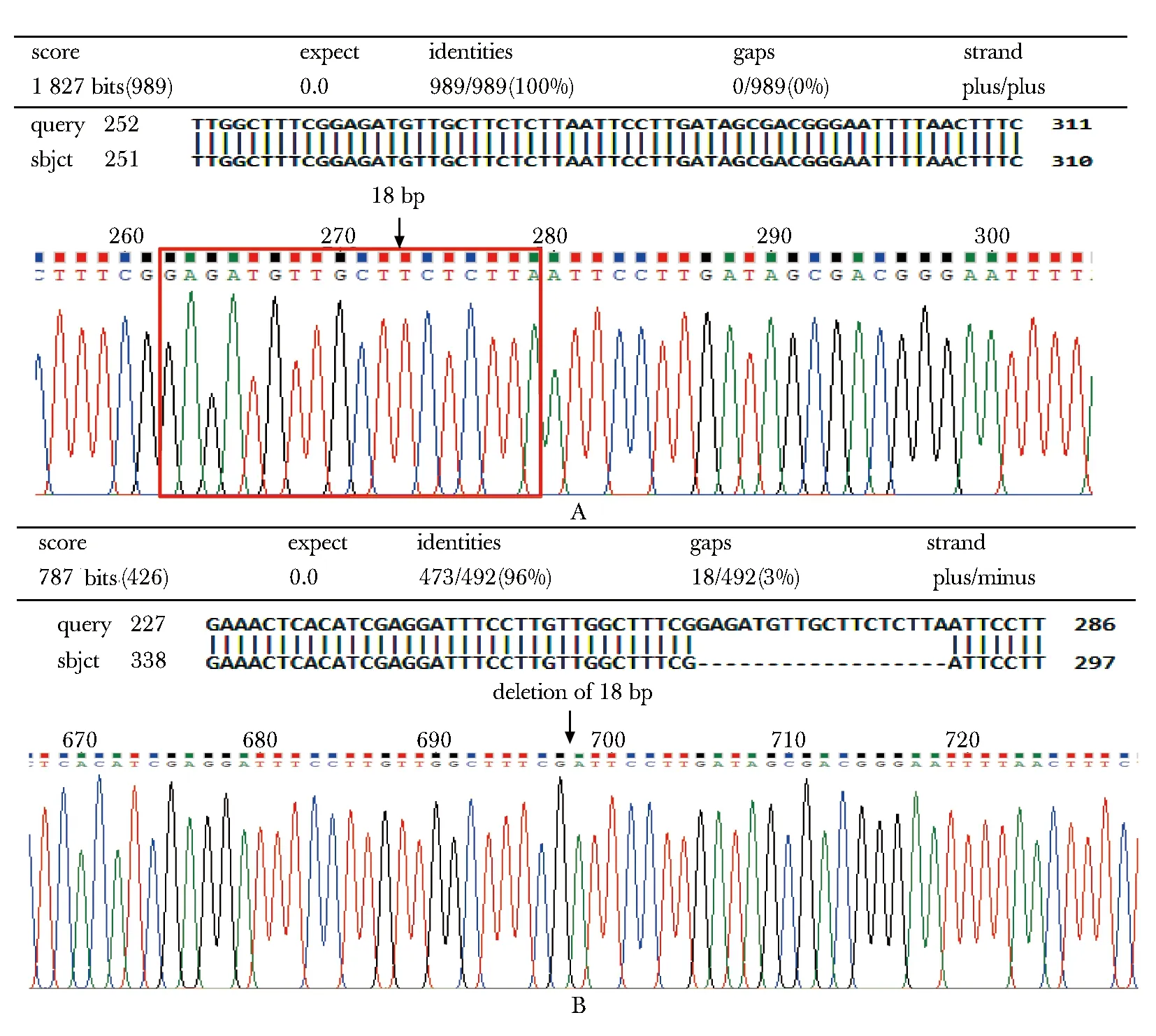
A.partial results of WT sequencing;B.partial results of D18MT sequencing图3 WT和D18MT测序部分结果Fig 3 Partial results of WT and D18MT sequencing
2.4 突变检测技术平台的构建及优化
突变型重组质粒与引物配对,出现分子“开”现象,野生型质粒与引物不配对,出现分子“关”现象,其中4号泳道的检测条件分子开关现象最明显,即EGFR基因19外显子del18bp位点突变检测技术的最佳条件:模板量0.4 μL,终浓度1.48×10-2μmol/L,引物量0.20 μL,终浓度0.16 μmol/L,57 ℃退火温度,循环数25(图4)。
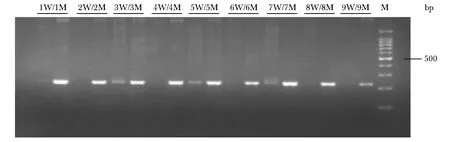
M.a 100 bp DNA Ladder marker;W.a wild-type recombinant plasmid;M.a mutant recombinant plasmid,and the 4W/4M group molecular switch phenomenon is the most obvious
2.5 检测灵敏度
片段大小在232 bp左右,与预期一致;当模板在102~10-3copies/μL时,目的条带清晰可见(图5),构建的分子开关平台可检测出低至10-3copies/μL的突变模板。
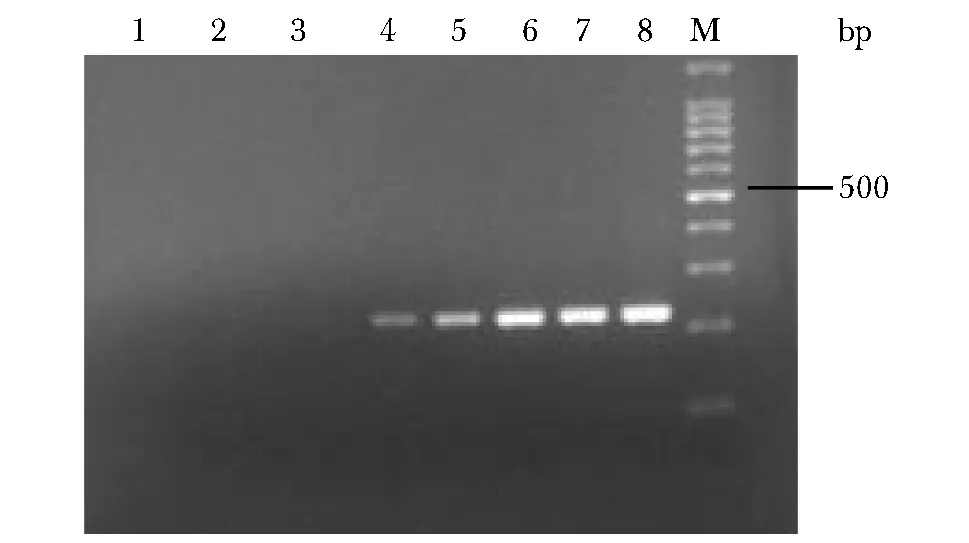
M.a 100 bp DNA Ladder marker,1,2,3,4,5,6,7,8 were D18MT template 10-6,10-5,10-4,10-3,10-2,10-1,101,102;the PCR amplification products diluted with concentrations of 101 and 102 (copies/μL)图5 灵敏度检测琼脂糖电泳结果Fig 5 Sensitivity detection agarose gel electro- phoresis results
2.6 高保真酶介导的分子开关在非小细胞癌患者癌变肺组织DNA模板的检测
2、3号泳道有特异性扩增产物,与4号泳道(D18MT)片段大小基本一致;1号泳道无特异性扩增产物(图6)。提示del18bp 缺失突变检测分子开关可对临床样本进行特异性检测。
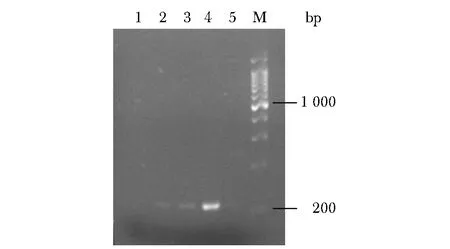
M.a 200 bp DNA Ladder marker;1-3.lung cancer tissue sample 1(0.40 mg/mL),2(0.36 mg/mL),3(0.50 mg/mL),lane 4,5 were D18MT,WT图6 分子开关在3例肺癌组织模板上的电泳检测结果Fig 6 Electrophoretic detection of molecular switch on 3 lung cancer tissue templates
3 讨论
非小细胞肺癌以其较高的发病率和病死率在医学界备受关注,基因检测技术在肿瘤的早期诊断中有重要价值,但其花费较高、耗时长、难以在临床普及,更不能及时或较早发现耐药突变的出现。癌细胞的特定体细胞突变的早期诊断有赖于更为敏感检测技术的出现[1]。因此,高敏感性检测EGFR基因突变方法在肺癌等肿瘤的早期筛查中和具有临床意义。
本实验主要针对肺癌EGFR基因D18MT突变位点,利用PCR及重叠PCR技术和琼脂糖凝胶电泳和基因测序检测,并在PubMed中进行BLAST同源性分析,结果显示EGFR基因19外显子的18碱基缺失位点突变成功,且无其他突变。再通过特异性引物扩增和正交设计构建分子开关检测平台,为肺癌早发现和早诊断提供基础实验依据。
首先,本实验利用重叠PCR成功构建了突变型重组质粒,在实验的第一步PCR反应后对其产物,即对目的片段进行回收,排除了其他因素的干扰,反应高效且成本较低;其次,本实验通过设计正交实验方案,对引物量、模板量、循环数及退火温度进行了优化,成功找出了最优检测条件。同时,对其模板浓度进行灵敏度检测,以排除在高浓度时的假阳性,降低在低浓度时假阴性的发生率。当模板在103copies/μL即可检出PCR扩增产物。将前期确定的条件应用于非小细胞肺癌组织样本,结果提示该平台可用于临床样本检测。以此法代替直接测序法等其他方法,可使快速检测血中游离DNA D18MT缺失突变更为灵敏可靠。然而,本次实验有一定的局限性,并没有对引物浓度进行条件优化,加之,本次实验还只停留在分子水平,仅仅是对于D18MT单突变位点的检测,后续实验可结合与肺癌EGFR基因相关的其他基因突变如L858R等位点进行检测,并可将此项技术运用到临床肺癌EGFR基因的普遍筛查,用于与肺癌发生发展相关的研究。
