干扰长链编码RNA FOXCUT 能抑制鼻咽癌细胞上皮间质转化及诱导线粒体损伤
2021-10-14高莉莉窦思雨岳小丁杨捷玲
高莉莉,张 雄,窦思雨,岳小丁,杨捷玲
1西京学院医学院,陕西 西安 710000;2陕西中医药大学附属医院耳鼻喉科,陕西 咸阳712000
鼻咽癌(NPC)是源于鼻咽黏膜的恶性肿瘤,其发病机制与爱泼斯坦-巴尔病毒(EBV)感染、环境诱导、遗传易感性等有关[1]。患者早期无特异性症状,鼻塞、耳鸣、涕中带血、头痛等症状易被忽视或误诊,约70%的患者错过最佳治疗时期,确诊时已处于中晚期[2]。鼻咽癌具有侵袭性高、转移快、预后差、并发症复杂等特点,目前鼻咽癌的传统治疗包括手术治疗、放疗及化疗,但由于解剖部位深、解剖结构复杂限制了手术疗效,此外,放、化疗常引起免疫降低、继发性肿瘤等的发生[3,4]。因此,寻找延长患者无病生存期,提高预后生命质量,有效减少并发症等的治疗方法具有重要意义。
长链非编码RNA(lncRNA)是一类长度大于200个核苷酸的RNA分子,缺乏蛋白质编码能力,可以调控很多基因的表达,LncRNAs在鼻咽癌的发生发展起重要作用[5-7]。FOXCUT 其位于促肿瘤生长叉头框基因FOXC1基因启动子的上游,可与STAT3相互作用增强鼻咽癌侵袭能力[8]。有研究显示LncRNA FOXCUT通过靶向FOXC1促进鼻咽癌细胞增殖和迁移[9],但关于FOXCUT对鼻咽癌细胞作用及调控机制还未见报道。因此,本研究通过干扰长链编码RNA FOXCUT表达,研究其对鼻咽癌细胞上皮间质转化及线粒体功能的影响,以期为LncRNA FOXCUT在鼻咽癌的靶向治疗中提供实验参考。
1 材料和方法
1.1 细胞
鼻咽上皮细胞NP69 细胞株及人鼻咽癌细胞CNE1、CNE2、SUNE2、HER2和5-8F细胞株(中国典型培养物保藏中心)。50例鼻咽癌及癌旁组织来源于本院(2019年10月~2020年10月),所有入选患者术前均未接受过放疗、化疗或生物治疗等干预措施,所有涉及研究的标本取材均征得患者及家属同意,并经过本院伦理委员会批准。
1.2 主要试剂
RPMI 1640培养基和Opti培养基(Cellgro);10%胎牛血清和1%青-链霉素双抗(武汉普诺赛生物科技有限公司);Trizol试剂、RIPA裂解液(上海联迈生物工程有限公司);shRNA FOXCUT载体、shRNA-NC由上海生工生物工程股份有限公司设计合成;磷酸盐缓冲液(PBS)和聚丙烯酰胺凝胶(北京六一生物科技有限公司);CCK-8试剂盒和BCA试剂盒(武汉艾迪抗生物科技有限公司);E-cad、N-cad和Vimentin相关抗体(北京百奥莱博科技有限公司);SOD、MDA 和LDH 试剂盒(上海江莱生物科技公司);线粒体膜电位检测试剂盒(北京雷根生物技术有限公司);Bax、Bcl-2、caspase3和c-Myc相关抗体(上海碧云天生物技术有限公司);脂质体LipofectamineTM2000转染试剂(Thermo Scientific)。
1.3 主要仪器
MR-96T 酶标仪(南京贝登医疗股份有限公司);CellStream 流式细胞仪(Merck);BT-50L CO2恒温箱(上海本亭仪器有限公司);X960荧光定量PCR仪(上海力康生物医疗科技有限公司);XD倒置显微镜(香港舜宇光学科技有限公司);Allegra X-15R台式冷冻离心机(贝克曼库尔特);BSC-A2超净工作台(江苏迅迪仪器科技有限公司)。
1.4 细胞培养
将冻存的CNE1 细胞用水浴锅融化后,转移至RPMI 1640培养基(含10%胎牛血清、1%青-链霉素双抗),置于37 ℃、5%CO2恒温箱中孵育。使用0.25%胰蛋白酶消化细胞,进行传代培养及后续实验。
1.5 细胞转染
取对数生长期CNE1细胞,PBS重悬后调整细胞密度为1×106/mL,接种于24孔板,设置3个复孔,待细胞生长至40%~60%时,分为5组;空白组(Control)、空载组(shRNA-NC)、干扰组1(FOXCUT-shRNA1)、干扰组2(FOXCUT-shRNA2)、干扰组3(FOXCUT-shRNA3);弃原培养液,采用无血清Opti培养基对细胞进行饥饿培养,2 h后,采用LipofectamineTM2000脂质体转染法进行细胞转染,当感染复数为10时,在孔内添加5 μg/mL的Polybrene,混匀培养12 h后更换细胞培养液,继续培养3 d 后用嘌呤霉素筛选10 d,筛选稳定感染的细胞株。其中空白组不进行转染处理,空载组采用空转质粒转染,各干扰组分别转染不同干扰序列质粒,培养48 h后收集细胞,进行后续实验。
1.6 RT-PCR检测RNA FOXCUT的表达
取1.5转染后的各组细胞,分别加入Trizol试剂提取细胞样品中的总RNA,进行反转录获取cDNA,加入相应引物,使用荧光定量PCR仪扩增处理,用2-△△Ct法计算FOXCUT mRNA 的相对表达水平。引物序列:FOXCUT-shRNA1 的上游引物为5'-GAAUGGAGAA CUAAGACAAUUAUCT-3',下游引物为5'-AGAUAA UUGUCUUAGUUCUCCAUUCGG-3';FOXCUT-shRNA2的上游引物为5'-CAGCCUCCCUCCUGUGUGU GCAGAG-3',下游引物为CUCUGCACACACAGGA GGGAGGCUGCA-3';FOXCUT-shRNA3 的上游引物为5'-TCCGATCATCTATCCCTTTACGA-3',下游引物为5'-CCCGGCTTCAAAAGACTCA-3';GAPDH 的上游引物为5'-TCGCTCTCTGCTCCTCCTGTTC-3',下游引物为5'-CGCCCAATACGACCAAATCC-3'。
1.7 CCK8检测细胞增殖倍数
由方法1.6结果,选取FOXCUT-shRNA3为后续实验干扰序列,将细胞随机分为3组:Control组、shRNANC 组和FOXCUT-shRNA3 组,Control 组不作转染处理,shRNA-NC 组采用空转质粒转染,FOXCUTshRNA3组转染FOXCUT-shRNA3质粒。各组细胞稀释后调整细胞密度为1×106/mL接种于24孔板中,设置3个复孔,培养至24、48、72 h,加入CCK-8溶液,培养2 h后弃上层培养液,采用酶标仪测定光密度值A450nm。
1.8 克隆形成实验检测细胞克隆形成率
将CNE1细胞接种至6孔板,约500细胞/孔,按方法1.7 进行分组,培养10 d 后弃掉培养基,乙醇固定30 min,0.5%结晶紫染色,去离子水漂洗晾干,显微镜下观察克隆形成数目,计算克隆形成率。细胞克隆形成率(%)=细胞克隆总数/接种细胞数×100%。
1.9 显微镜观察细胞形态
取Control 组、shRNA-NC 组、FOXCUT-shRNA3组细胞,重悬稀释至以5×106/mL,接种于6 孔板中,2.0 mL/孔,48 h后在400倍倒置显微镜下观察各组细胞的形态并拍照,实验重复3次。
1.10 免疫荧光检测Vimentin+含量
将各组待测细胞接种于细胞爬片上,PBS 浸洗3次;多聚甲醛固定15 min后PBS浸洗。0.5%Triton X-100室温通透20 min,PBS浸洗,吸水纸吸干后玻片上滴加正常山羊血清,室温下封闭30 min,吸掉封闭液,加入一抗,孵育过夜,PBS浸洗,避光加入荧光二抗孵育1 h,PBS浸洗,滴加DAPI避光孵育5 min,用含荧光淬灭剂的封片液封片,于荧光显微镜下观察并拍照。
1.11 Western blot检测细胞EMT相关蛋白表达
取Control 组、shRNA-NC 组、FOXCUT-shRNA3组细胞,加入含有蛋白酶抑制剂的RIPA裂解液,于冰上静置15 min,低温离心5 min(4 ℃,12 000 r/min),收集上清液,用BCA试剂盒进行蛋白质含量测定,加入适量缓冲溶液煮沸。取样后进行聚丙烯酰胺凝胶电泳,经转膜、封闭后,加入E-cad、N-cad、Vimentin相关抗体处理,再加入显色剂进行检测,应用Image 6.0软件进行灰度值分析。
1.12 试剂盒检测氧化应激标记物的水平
取Control 组、shRNA-NC 组、FOXCUT-shRNA3组细胞,PBS重悬,将细胞浓度稀释至1×107/mL,裂解后离心收集上清液。按照试剂盒说明书分别采用WST-1法、微板法、比色法检测SOD、MDA、LDH水平。
1.13 流式检测线粒体膜电位的变化
取Control 组、shRNA-NC 组、FOXCUT-shRNA3组细胞,PBS重悬,将细胞浓度稀释,根据线粒体膜电位检测试剂盒说明进行操作,加入JC-1荧光探针染液培养20 min,将染色液洗去后,用流式细胞仪进行检测。
1.14 Western blot检测线粒体损伤标记物蛋白的表达
具体操作方法同1.11,选用Bax、Bcl-2、caspase3、c-Myc相关抗体进行实验。
1.15 统计学方法
数据采用SPSS21.0进行数据分析,定量资料用均数±标准差表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 鼻咽癌组织及不同鼻咽癌细胞系中FOXCUT表达
与癌旁组织相比,鼻咽癌组织中FOXCUT表达水平均升高(t=13.65,P<0.001,图1);与NP69细胞相比,CNE1、CNE2、SUNE2、HER2和5-8F细胞FOXCUT表达水平均升高(F=55.81,P<0.001,图1)
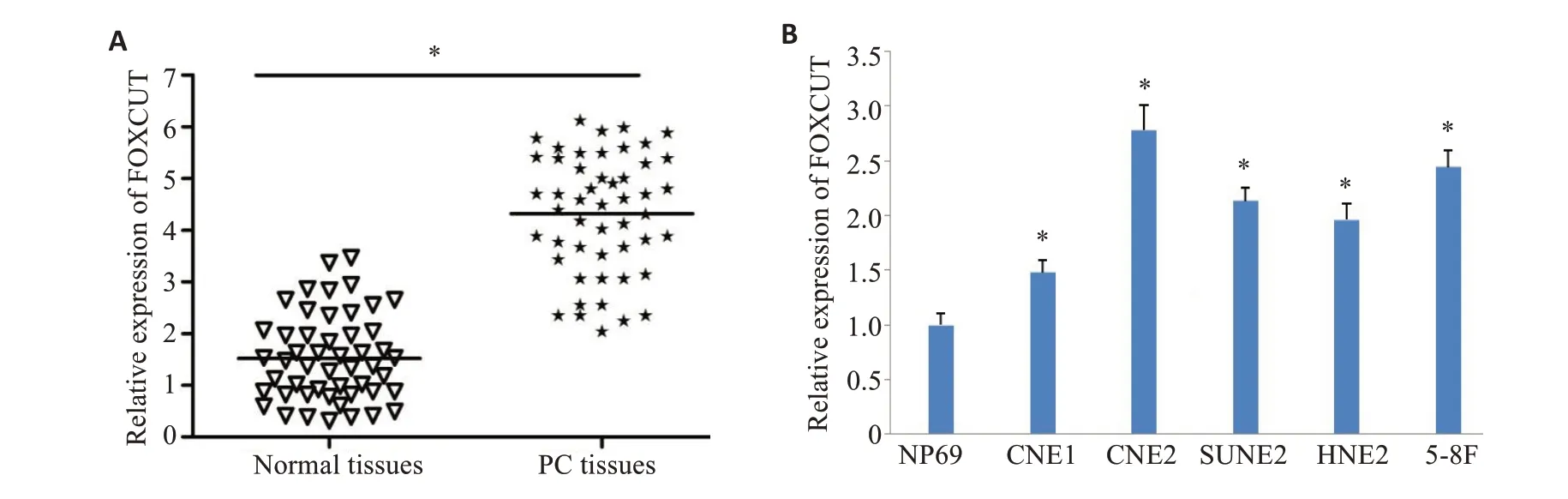
图1 鼻咽癌组织及不同鼻咽癌细胞系中FOXCUT表达Fig.1 FOXCUT expression in nasopharyngeal carcinoma(NPC)tissues and different NPC cell lines.A:FOXCUT expression in NPC and adjacent tissues.B:FOXCUT expression in Np69,CNE1,CNE2,SUNE2,HER2 and 5-8F cell lines.*P<0.001 vs Normal tissues,NP69 cells
2.2 不同shRNA 序列干扰LncRNA FOXCUT 表达的影响
与Control 组相比,shRNA-NC 组RNA FOXCUT表达水平差异无统计学意义,3个干扰组RNA FOXCUT表达水平均降低(F=117.15,P<0.001,图2),其中FOXCUT-shRNA3组干扰最为显著,因此选择此组为后续实验干扰组。
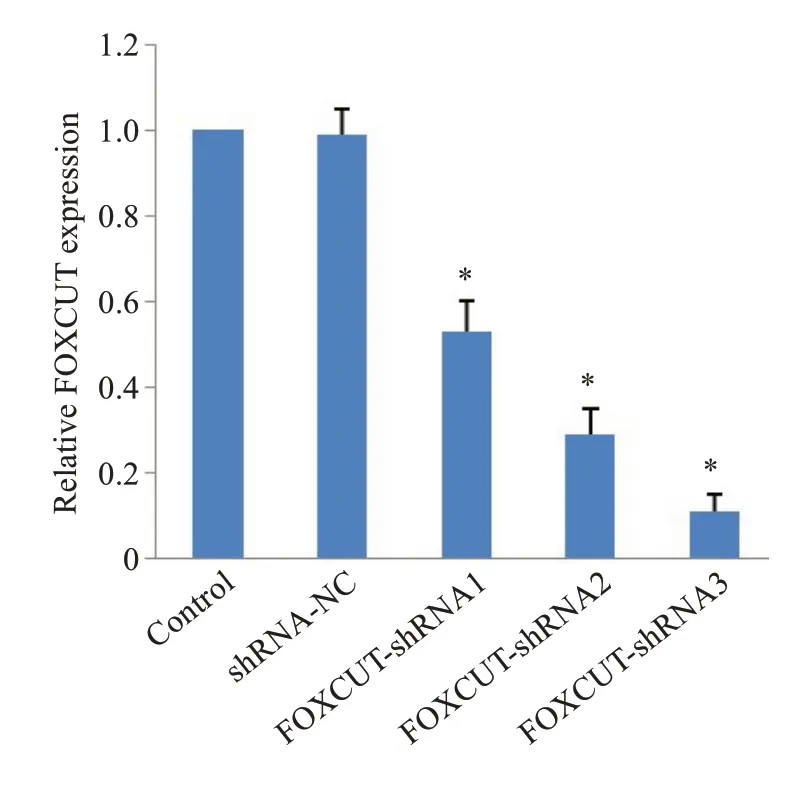
图2 不同shRNA序列干扰LncRNA FOXCUT表达的影响Fig.2 Effects of different shRNA sequences on expression of LncRNA FOXCUT.*P<0.001 vs control group.
2.3 干扰LncRNA FOXCUT对鼻咽癌细胞增殖的影响
与Control组相比,shRNA-NC组细胞增殖倍数及克隆形成率差异无统计学意义,FOXCUT-shRNA3干扰组细胞增殖倍数及克隆形成率降低(F=86.26、85.28,均P<0.001,图3)。

图3 干扰LncRNA FOXCUT对鼻咽癌细胞增殖的影响Fig.3 Effect of FOXCUT interference on proliferation of NPC cells.A:CCK8 assay for detecting cell proliferation.B:Clone formation assay for assessing clone formation(Original magnification:×200).C:Histogram of cell clone formation rate.*P<0.001 vs control group.
2.4 干扰LncRNA FOXCUT对鼻咽癌细胞形态的影响
Control组细胞形态呈长梭形,细胞间连接少、间隙大,shRNA-NC组细胞形态与Control组相似;FOXCUTshRNA3干扰组细胞形态呈短梭形、扁平型或圆形,细胞间的连接较为紧密,具有铺路石样特征(图4)。

图4 干扰LncRNA FOXCUT对鼻咽癌细胞形态的影响Fig.4 Effect of FOXCUT interference on morphology of NPC cells(×400).
2.5 干扰LncRNA FOXCUT 对鼻咽癌细胞EMT 相关蛋白表达的影响
与Control 组相比,shRNA-NC 组E-cad、N-cad、Vimentin 的表达水平差异无统计学意义,FOXCUTshRNA3 干扰组N-cad、Vimentin 的表达水平降低,Ecad的表达水平升高(E-cad:F=22.50,P=0.002;N-cad:F=43.66,P<0.001;Vimentin:F=8.42,P=0.018,图5)。

图5 干扰LncRNA FOXCUT对鼻咽癌细胞EMT相关蛋白表达的影响Fig.5 Effect of FOXCUT interference on expressions of EMT-related proteins in NPC cells.A:Western blotting for detecting expression levels of E-cad,N-cad and vimentin.B:Histogram of expression levels of E-cad,N-cad and vimentin.*P<0.05 vs control group.
2.6 干扰LncRNA FOXCUT 对鼻咽癌细胞Vimentin+含量的影响
与Control 组相比,shRNA-NC 组Vimentin+含量差异无统计学意义,FOXCUT-shRNA3干扰组Vimentin+含量降低(F=124.8,P<0.001,图6)。

图6 干扰LncRNA FOXCUT对鼻咽癌细胞Vimentin+含量的影响Fig.6 Effect of FOXCUT interference on percentage of vimentin-positive cells in NPC cells.A:Vimentin-positive cells detected by immunofluorescence assay(×200).B:Histogram of percentage of vimentin-positive cells.*P<0.001 vs control group.
2.7 干扰LncRNA FOXCUT对鼻咽癌细胞氧化应激标记物的影响
与Control 组相比,shRNA-NC 组SOD、MDA、LDH的水平差异无统计学意义,FOXCUT-shRNA3干扰组MDA、LDH的含量明显升高,SOD的活性明显降低(SOD:F=20.58,P=0.002;MDA:F=25.26,P=0.001;LDH:F=10.39,P=0.011;图7)。

图7 干扰LncRNA FOXCUT对鼻咽癌细胞氧化应激标记物的影响Fig.7 Effect of FOXCUT interference on oxidative stress markers in NPC cells.A:SOD level.B:MDA level.C:LDH.*P<0.05 vs control group.
2.8 干扰LncRNA FOXCUT对鼻咽癌细胞线粒体膜电位的影响
与Control组相比,shRNA-NC组线粒体膜电位变化及氧化应激标记物水平差异无统计学意义(P>0.05),FOXCUT-shRNA3干扰组红色荧光细胞向绿色荧光细胞转变较明显,绿色荧光细胞百分比增加(t=3.44,P=0.026,图8)。

图8 干扰LncRNA FOXCUT对鼻咽癌细胞线粒体膜电位的影响Fig.8 Effect of FOXCUT interference on mitochondrial membrane potential of NPC cells.A:Flow cytometric analysis of mitochondrial membrane potential.B:Histogram of mitochondrial membrane potential.*P<0.05 vs control group.
2.9 干扰LncRNA FOXCUT对鼻咽癌细胞线粒体损伤相关蛋白表达的影响
与Control组相比,shRNA-NC组线粒体膜损伤相关蛋白表达水平差异无统计学意义,FOXCUT-shRNA3干扰组Bax/Bcl-2、Cleaved cas3/cas3表达上升,c-Myc表达降低(Bax/Bcl-2:F=566.95,P<0.001;Cleaved cas3/cas3:F=38.21,P<0.001;c-Myc:F=73.98,P<0.001,图9)。

图9 干扰LncRNA FOXCUT对鼻咽癌细胞线粒体损伤相关蛋白表达的影响Fig.9 Effect of FOXCUT interference on expressions of mitochondrial damage-related proteins in NPC cells.A:Expression levels of Bax,Bcl-2,caspase-3 and c-Myc detected by Western blotting.B-D:Histogram of the protein expressions.*P<0.05 vs control group.
3 讨论
长链非编码RNA在肿瘤的发生、发展、早期诊断、治疗抵抗和预后等方面具有重要作用[10-12],其中lncRNA FOXCUT不仅是前列腺癌早期诊断的生物标志物[13];还能通过激活FOXC1/PI3K/AKT途径促进大肠癌的增殖和侵袭[14];以及促进食管鳞状细胞癌的进展并预测不良预后[15],表明lncRNA FOXCUT是癌症潜在的诊断标志物、治疗靶点和预后监测分子。近年来LncRNA、EMT与肿瘤的相互作用关系已得到广泛研究[16,17]。LncRNA可通过调控肿瘤细胞的增殖影响肿瘤的发生发展[18]。通过E-cad、N-cad和Vimentin等变化评估EMT的激活状态[19,20]。研究发现沉默lncRNA FOXCUT基因可能通过靶向FOXC1调控下游EMT相关基因的表达,从而在肿瘤细胞增殖及迁移过程中发挥重要作用[21]。RNA干扰FOXCUT可抑制乳腺癌MCF-7细胞的增殖活性[22]。本研究结果显示,干扰FOXCUT-shRNA后细胞增殖率减少;细胞形态呈短梭形、扁平型或圆形,细胞间的连接较为紧密;N-cad、Vimentin的表达水平降低,E-cad的表达水平升高。这提示干扰FOXCUT-shRNA能够抑制肿瘤细胞增殖及上皮间质转化,缓解鼻咽癌的发展。
与正常细胞相比,由于高代谢率和线粒体功能障碍,癌细胞的ROS水平增加,导致癌细胞比正常细胞更快地达到其氧化应激阈值,致使癌细胞凋亡[23,24]。细胞凋亡是一种受基因调控的细胞主动死亡过程,诱导肿瘤细胞凋亡是癌症治疗的新途径[25]。线粒体是凋亡的重要调控中心,当接收到凋亡信号时,抑凋亡蛋白Bcl-2和促凋亡蛋白Bax相互作用,促进膜电位的耗散,增加膜的通透性,线粒体表面形成孔道,使促凋亡因子和细胞色素C 释放入细胞质,Caspase 级联反应启动,激活caspase3 等相关表达,从而通过线粒体途径促进细胞凋亡[26,27]。c-Myc是最常见的致癌基因之一,可调控包括细胞生长周期、核糖体生物合成和代谢在内的生理过程,其蛋白表达增加与多种原发性癌症相关[28]。研究指出线粒体膜电位丧失能诱导癌细胞凋亡,发挥抗肿瘤作用[29]。FOXCUT靶向MMP-2、MMP-9诱导黑色素瘤细胞凋亡[30]。本研究结果显示干扰FOXCUT-shRNA后细胞MDA、LDH的含量明显升高,SOD的活性明显降低;红色荧光细胞向绿色荧光细胞转变较明显,绿色荧光细胞百分比增加,线粒体膜电位下降;Bax/Bcl2、Cleaved cas3/cas3 表达显著上升,c-Myc 表达显著降低。这提示,干扰FOXCUT-shRNA能够增强鼻咽癌细胞氧化应激反应,降低膜电位,诱导线粒体功能损伤,促进凋亡。
综上所述,干扰长链非编码RNA FOXCUT能够抑制鼻咽癌细胞增殖,减少上皮间质转化,增强氧化应激,降低膜电位,诱导CNE1细胞线粒体功能损伤,促进凋亡;干扰长链非编码RNA FOXCUT对CNE1细胞抑制效果显著,具有靶向治疗鼻咽癌的潜力。
