微小RNA-362通过调控组蛋白去乙酰化酶6抑制大鼠骨癌痛
2021-10-14郭池华郭玉芳王文涛
郭池华,王 湘,刘 焕,赵 妍,郭玉芳,王 爽,王文涛
(1.西安医学院基础医学部,陕西西安 710021;2.西安红会医院脊柱外科,陕西西安 710054)
骨癌痛(bone cancer pain,BCP)严重影响着肿瘤患者的身心健康。由于临床治疗手段的局限,大量患者的病情无法得到妥善治疗[1]。因此,研究其发生发展机制,寻找潜在治疗靶点以提高患者生活质量是亟待解决的关键临床问题[2]。微小RNA(microRNA,miRNA)是一种调控型非编码RNA,因其特殊的生物学效应已引起广泛关注。其主要作用是通过互补结合靶mRNA 3’非编码区(untranslated region,UTR)端,调控靶mRNA降解或抑制翻译,而最终在转录后水平产生负调控效应[3-4]。
组蛋白去乙酰化酶6(histone deacetylase 6,HDAC6)是组蛋白去乙酰化酶家族中最为特殊的一员,可影响细胞质中非组蛋白的功能[5]。目前研究发现,其在神经系统疾病尤其在痛觉产生、维持以及神经免疫炎症方面发挥着关键调节作用[6-7]。文献报道,在化疗引起的神经损伤小鼠模型中出现痛行为学反应,且采用HDAC6特异性阻断剂ACY-1215进行干预后,痛行为反应明显改善[8]。
已有多项研究证实了miR-362的负向调控作用,且均来自肿瘤相关研究[9-10]。据此推测,在BCP大鼠模型中miR-362也应有一定的镇痛效应,并且可能是通过靶向调控HDAC6而实现。因此,本研究观察miR-362对BCP大鼠的镇痛效应并探讨其作用机制,为临床镇痛靶点的选择提供新的思路和方法。
1 材料与方法
1.1 实验动物、细胞及主要试剂雌性Sprague-Dawley(SD)大鼠由成都达硕实验动物有限公司提供,体质量180~200 g大鼠用于造模,体质量80~100 g大鼠用于腹腔培养Walker 256乳腺癌细胞。实验动物均饲养于标准透明塑料饲养笼中,室温(22~25)℃,自由摄食饮水,保证12 h/12 h正常昼夜节律。所有动物实验均严格遵守西安医学院动物伦理委员会的要求,尽可能减少动物使用数量和所遭受痛苦。
HEK-293T细胞和Walker 256细胞均在含有100 mL/L胎牛血清(美国Gibco公司)和10 mL/L青霉素/链霉素(美国Gibco公司)的DMEM培养基(美国Gibco公司)中于37℃50 mL/L CO2条件下培养。培养HEK-293 T细胞(美国ATCC公司)用于验证miR-362和HDAC6的上下游关系。
Trizol试剂及逆转录、实时荧光定量PCR(quantita⁃tive real-time PCR,qRT-PCR)试 剂 盒 以 及Lipo⁃fectamine 2000试剂盒购自日本TaKaRa公司。miR-362引物、模拟物(mimic miR-362)和无义序列(mimic miR-NC)、野生型HDAC6 3’UTR(HDAC6 3’UTRWT)及突变型HDAC6 3’UTR(HDAC6 3’UTRMUT)荧光报告质粒购自广州赛诚生物有限公司。HDAC6引物以及HDAC6 siRNA由武汉博士德生物公司提供。兔抗大鼠HDAC6抗体购于英国Abcam公司,兔抗大鼠核因子κB(nuclear factor kappa-B,NF-κB)p65抗体购于美国CST公司,小鼠抗大鼠β-actin抗体购于美国Sigma公司。
1.2 BCP大鼠模型的建立将培养的Walker 256细胞先注射于体质量为80~100 g大鼠腹腔中进行预适应,随后待大鼠腹部隆起后,吸取腹水并调节细胞密度为2×106个/mL用于造模。大鼠麻醉后仰卧位固定于手术台[11]。在右胫骨中上1/3处备皮并消毒皮肤,于胫骨结节周围做5 mm切口,暴露胫骨。用1 mL注射器针头在胫骨平坦面打孔,出现落空感后拔出针头,可见骨髓流出。用20 μL微量注射器向骨髓 腔 内 注 射10 μL的2×106个/mL的Walker 256细胞悬液,制作BCP模型。最后退出针头,骨蜡封针孔,待大鼠苏醒后放回鼠笼。
1.3 鞘内置管BCP大鼠麻醉并俯卧位固定于手术台。在胸腰段正中位置做2 cm切口。分离脊柱两旁肌肉暴露棘突,保持过屈体位在棘突下插入PE-10导管,导管突破硬膜时鼠尾轻微摆动,注意不要损伤脊髓。插入深度为T8至L3位置。导管的另一端通过皮下隧道于两耳中间穿出用于鞘内给药。置管完成后检查大鼠后肢活动情况以证明脊髓是否完好,如有异常证明置管失败。
1.4 实验分组及给药动物实验:60只大鼠均分为6组,分别为Sham组(骨髓腔仅注射生理盐水)、BCP组(骨髓腔仅植入肿瘤细胞)、BCP+LV-NC组(BCP大鼠鞘内注射LV-NC)、BCP+LV-miR-362组(BCP大鼠鞘内注射LV-miR-362)、BCP+LV-miR-362+LV-HDAC6组(BCP大鼠鞘内注射LV-miR-362和HDAC6过表达质粒)和BCP+LV-HDAC6 siRNA组(BCP大鼠鞘内注射HDAC6 siRNA)。大鼠出现甩尾表明注射成功。实验具体过程如图1所示。依据本课题组之前实验[11],BCP大鼠痛行为变化于肿瘤细胞植入术后14 d达到高峰,故建模后14 d确定为干预时间起点。第1~第3天连续鞘内注射相应干预剂,并于第1~第7天每天检测行为学变化,第7天处死大鼠进行qRT-PCR、Western blotting和ELISA检测。

图1实验流程图Fig.1 Experimental procedures
细胞实验:HEK-293 T细胞分为4组,mimic miR-362+HDAC6 3’UTRMUT组共转染mimic miR-362质 粒 和HDAC6 3’UTRMUT质 粒,mimic miR-362+HDAC6 3’UTRWT组 共 转 染mimic miR-362质 粒 和HDAC6 3’UTRWT质 粒,mimic miR-NC+HDAC6 3’UTRMUT组 共转染mimic miR-NC质 粒 和HDAC6 3’UTRMUT质 粒,mimic miR-NC+HDAC6 3’UTRWT组 共 转 染mimic miR-NC质 粒 和HDAC6 3’UTRWT质粒。48 h后双荧光素酶报告系统测定各组荧光素酶活性。
1.5 行为学测定使用Van Frey纤维丝检测大鼠的机械痛敏。大鼠放入底部镂空的透明有机玻璃盒后,使用一系列Van Frey纤维丝(美国Stoelting公司,规格为1、2、4、6、8、10、15、26 g)。刺激大鼠右后肢足底中部的皮肤,用机械缩足阈值(paw withdraw⁃al threshold,PWT)表示机械痛敏。
使用热痛刺激仪检测大鼠热痛敏。热痛刺激仪刺激大鼠右后肢足底中部皮肤,若大鼠抬脚回避,则停止刺激记录时间,为热缩组潜伏期(paw withdraw⁃al latcncy,PWL),以表示热痛敏。设置热量强度使正常大鼠PWL为16 s。为了防止大鼠被烫伤,热痛刺激仪切断时间设置为20 s。其判定方法和记录方法参照本课题组文献报道的方式进行[11]。
1.6 qRT-PCR检测在Sham组、BCP组、BCP+LV-NC组和BCP+LV-miR-362组中分别取3只大鼠处死,取脊髓腰膨大部分组织放入RNAse-free离心管中加入Trizol充分匀浆后按照说明提取总RNA。在检测miR-362表达时,采用组织miRNA提取试剂盒分离出miR-362,采用加尾法将RNA反转录成cDNA,以U6为内参,用2-ΔΔCt法计算miR-362的相对表达量;在检测HDAC6 mRNA时,以GAPDH为内参,同法计算HDAC6 mRNA的相对表达量。qRT-PCR引物见表1。

表1 qRT-PCR中各基因引物序列Tab.1 Primers for RT-PCR
1.7 Western blotting检测在sham组、BCP组、BCP+LV-NC组、BCP+LV-miR-362组 和BCP+LV-HDAC6 siRNA组中各取3只大鼠处死,取出脊髓腰膨大处组织,然后加入1 mL混有蛋白酶和磷酸酶抑制剂的RIPA裂解液,匀浆裂解离心取上清。依照BCA蛋白定量试剂盒说明书进行蛋白定量。制备SDS-PAGE凝胶对蛋白样品进行电泳,然后用PVDF膜将凝胶进行转膜后,用50 mL/L脱脂牛奶粉封闭,在4℃将PVDF膜于稀释的一抗(HDAC6、NF-κB p65为1∶1 000,β-actin为1∶5 000)中反应过夜,经TBST洗膜3次后,加入1∶10 000稀释的辣根过氧化物酶二抗于37℃孵育1 h。最后滴加ECL化学发光液,进行曝光成像,以β-actin为内参,对条带进行灰度定量分析,计算目的蛋白的相对表达情况。
1.8 ELISA检测在sham组、BCP组 和BCP+LV-HDAC6 siRNA组中各取3只大鼠处死,取出脊髓腰膨大处组织,利用ELISA试剂盒(美国R&D公司)检测各组脊髓的白细胞介素(interleukin)-1β、IL-6和TNF-α水平。具体步骤按照实验说明书进行操作。
1.9 miR-362靶点预测和荧光素酶活性测定利用Target Scan筛选并确定HDAC6可能为miR-362的潜在调控靶点。扩增野生型或突变型HDAC6 3’UTR并克隆到荧光素酶质粒。将生长汇合至80%的HEK-293T细胞以适当密度接种至6孔板中,随后用Lipofectamine 2000(美国Invirogen公司)分别将含有HDAC6 3’UTRWT质粒、HDAC6 3’UTRMUT质粒、mimic miR-362和mimic miR-NC共转染至HEK-293 T细胞。48 h后用双荧光素酶报告系统测定荧光素酶活性。
1.10 质粒转染在BCP+LV-miR-362组、BCP+LV-miR-362+LV-HDAC6组、BCP+LV-HDAC6 siRNA组 和BCP+LV-NC组中,利用Lipofectamine 2000分 别 将 含 有miR-362、miR-362+HDAC6、HDAC6 siRNA的质粒以及空质粒通过鞘内注射的方式转染入BCP大鼠脊髓。转染试剂的制备按脂质体(μL)∶DNA(μg)1∶2进行。
1.11 统计学分析正态分布的计量资料以均数±标准差(±s)表示,所有数据统计分析及作图采用GraphPad Prism 8.4.0和SPSS 20.0软件处理。多组间均数比较采用重复测量设计的单因素方差分析(One-way ANOVA),方差齐时组间两两比较采用LSD法,方差不齐时组间两两比较采用Tamhane’s法。P<0.05为差异有统计学意义。
2 结 果
2.1 miR-362过表达抑制大鼠BCP的进展行为学测定结果显示,与Sham组相比,BCP组的PWT和PWL显著降低(P<0.05),而鞘内注射miR-362后,BCP+LV-miR-362组较BCP组各时间点PWT和PWL均显著升高(P<0.05),但低于sham组(P<0.05);BCP+LV-NC组与BCP组的PWT和PWL差异无统计学意义(P>0.05,图2)。表明miR-362可部分缓解BCP。
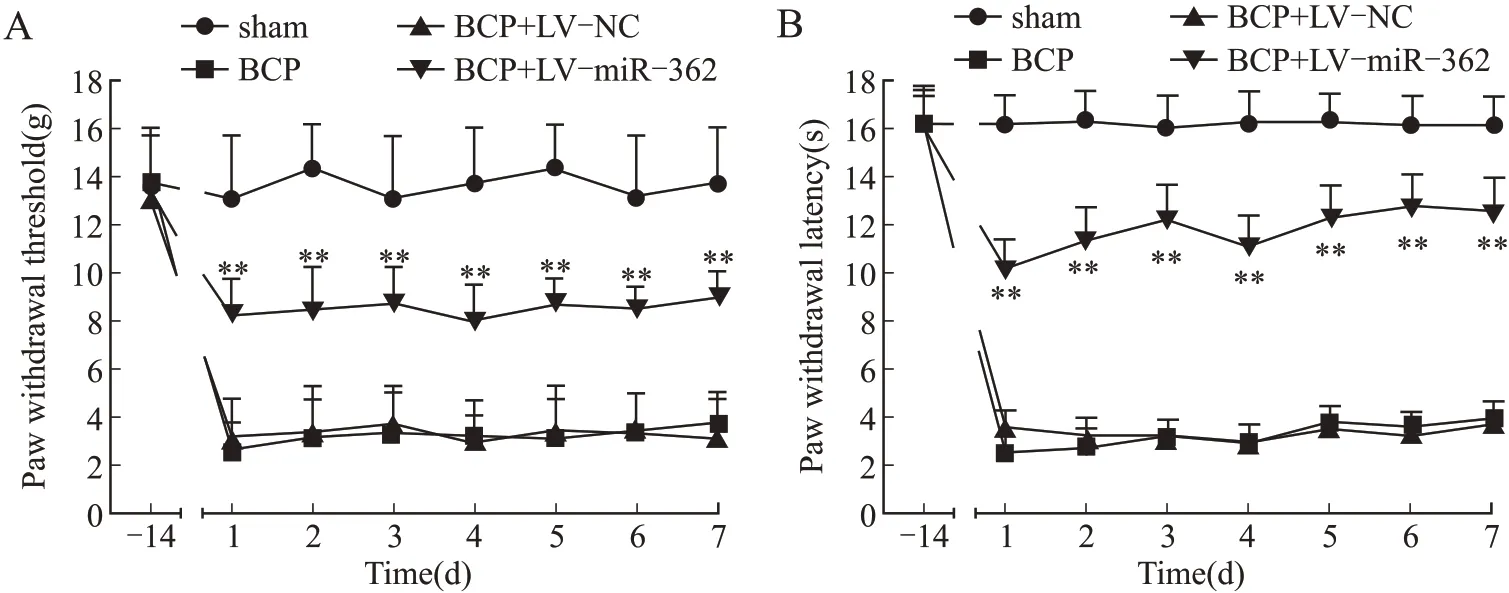
图2 miR-362过表达抑制大鼠BCP进展Fig.2 Overexpression of miR-362 inhibited bone cancer pain process in rats
2.2 miR-362抑制HDAC6的表达BCP组和BCP+LV-NC组较sham组的miR-362表达显著下调(P<0.05),BCP+LV-miR-362转染组miR-362表达与BCP组相比有明显恢复(P<0.05)。HDAC6 mRNA的表达变化则与miR-362相反,相较于sham组,BCP组 和BCP+LV-NC组HDAC6 mRNA表 达显著上调(P<0.05),miR-362转染后与BCP组相比,HDAC6 mRNA的表达显著抑制(P<0.05)。此外,HDAC6蛋白的表达变化同HDAC6 mRNA变化类似,BCP组显著上调,而miR-362则表达抑制(P<0.05,图3)。这 表 明,在BCP大 鼠 模 型 中miR-362与HDAC6表达呈负相关,miR-362对HDAC6表达具有抑制作用。
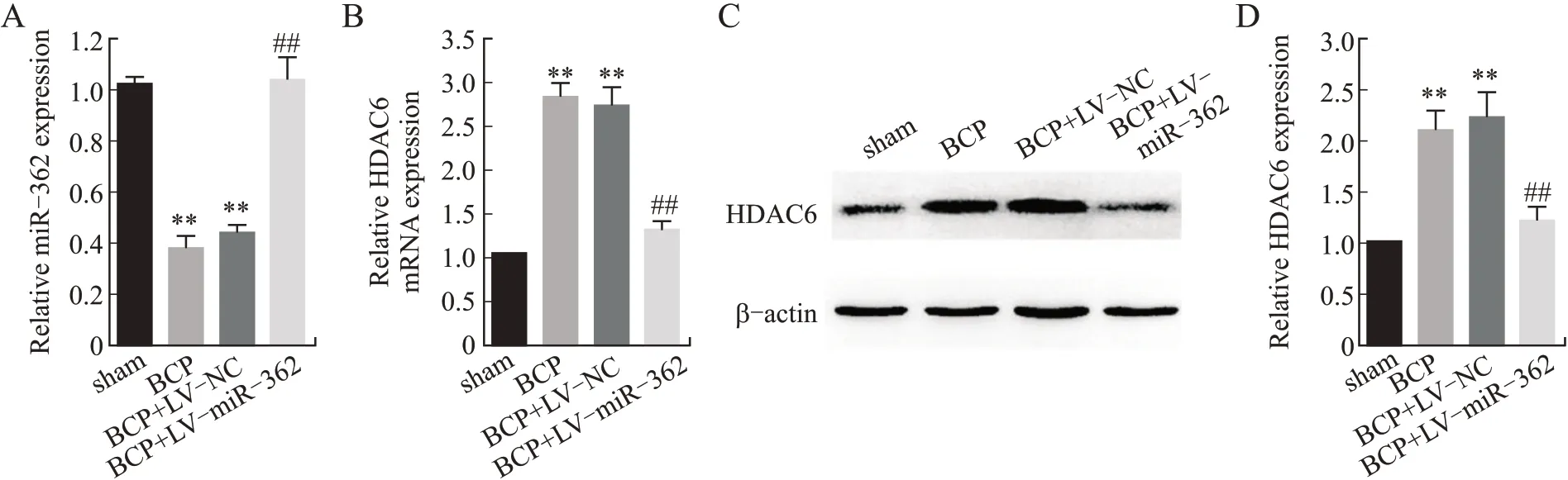
图3 miR-362抑制HDAC6的 表达Fig.3 miR-362 modulated HDAC6 expression negatively in BCP rats
2.3 HDAC6过表达逆转miR-362对BCP进展的抑制作用BCP+LV-miR-362组各时间点PWT和PWL较BCP+LV-NC组 显 著 提 升(P<0.05),当LV-miR-362+LV-HDAC6共 转 染 后,BCP+LVmiR-362+LV-HDAC6组各时间点与BCP组相比,PWT和PWL显著下降(P<0.05),miR-362的镇痛效应被逆转(P<0.05,图4)。这表明miR-362可通过抑制HDAC6减轻BCP进展。

图4 HDAC6过表达逆转miR-362对大鼠BCP进展的抑制作用Fig.4 Overexpression of HDAC6 reverted the repressive impact of miR-362 in BCP rats
2.4 HDAC6 siRNA对脊髓miR-362、HDAC6和NF-κB p65表达的影响与sham组相比,BCP组中miRNA-362的表达显著降低(P<0.05),但BCP组和BCP+LV-HDAC6 siRNA组相比,miRNA-362的表达差异无统计学意义(P>0.05)。BCP组中HDAC6和NF-κB p65的表达较sham组显著升高(P<0.05),BCP+LV-HDAC6 siRNA组中两者的表达较BCP组显著下降(P<0.05,图5)。这表明,BCP大鼠中HDAC6和NF-κB p65的表达增高可被HDAC6 siRNA抑制,但不影响miR-362的表达变化。
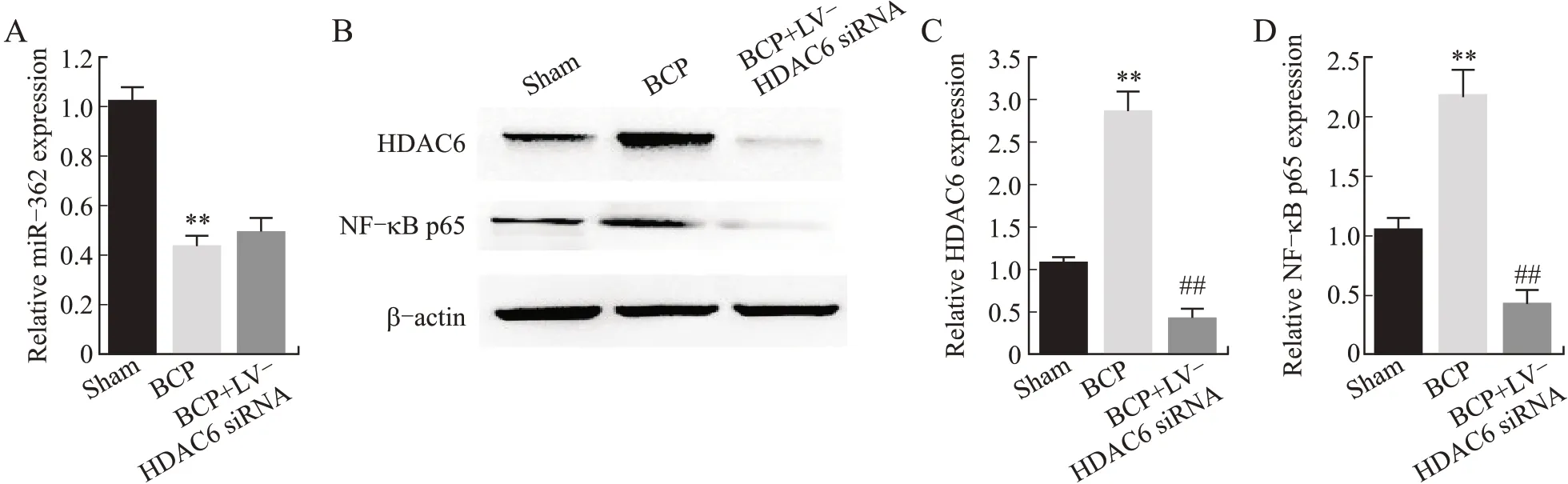
图5 下调HDAC6后miR-362、HDAC6和NF-κB p65表达变化Fig.5 Expression changes of miR-362,HDAC6 and NF-κB p65 after HDAC6 downregulation in BCP rats
2.5 HDAC6 siRNA干预后脊髓背角IL-1β、IL-6和TNF-α的水平变化与sham组相比,BCP组大鼠脊髓IL-1β、IL-6和TNF-α的水平均显著升高(P<0.05),BCP+LV-HDAC6 siRNA组中表达均显著下降(P<0.05,表2)。这表明,BCP大鼠表达增高的促炎因子IL-1β、IL-6和TNF-α在HDAC6沉默后可被广泛抑制。

表2 下调HDAC6后脊髓IL-1、IL-6和TNF-α的水平变化Tab.2 Expression changes of IL-1,IL-6 and TNF-α after HDAC6 downregulation in BCP rats (ng/g)
2.6 HDAC6为miR-362的靶基因双荧光素酶实验结果显示,与mimic miR-NC+HDAC6 3’UTRWT组相比,mimic miR-362+HDAC6 3’UTRWT组荧光素酶活性明显降低(P<0.05);与mimic miR-NC+HDAC6 3’UTRMUT组相比,mimic miR-362+HDAC6 3’UTRMUT组荧光素酶活性差异无统计学意义(P>0.05,图6)。这表明HDAC6是miR-362的直接作用目标。

图6 HDAC6为miR-362的靶基因Fig.6 HDAC6 is a target gene of miR-362
3 讨 论
BCP是严重影响癌症患者身心健康的临床难题,给家庭和社会带来沉重负担。因此,寻找新型高效的镇痛方法,提高患者的生活质量有重大意义。miRNA是一种调控型非编码RNA,它参与转录后的调控过程。目前已有研究表明,miRNA与疼痛的调控具有相关性,极有可能成为今后治疗BCP的潜在靶点[4]。因此,积极寻找参与BCP发生发展的相关miRNA,是BCP的基础研究和临床治疗的热点。miR-362位于人染色体Xp11.23,现已被证实与肺癌、卵巢癌、脑胶质瘤等肿瘤的发生发展密切相关[9-10,12]。但目前尚无报道其在神经系统中的作用。本研究制作BCP大鼠模型,并探索miR-362的镇痛作用以及下游镇痛相关机制。
目前,HDAC6在各种疼痛中的作用受到广泛关注。SAKLOTH等[13]在小鼠炎性痛和神经病理性痛模型中发现,HDAC6的特异性阻断剂ACY-738或ACY-257均能显著减轻模型小鼠痛行为学反应,由此推断HDAC6是治疗炎性痛和神经病理性痛的潜在靶点。在顺铂诱导的周围神经病变所引起的疼痛模型中,KRUKOWSKI等[14]发现,使用HDAC6的特异性阻断剂ACY-1215,可通过恢复背根神经节和神经元的线粒体功能,完全逆转顺铂诱导的周围神经病变所引起的痛觉过敏。但是,目前以HDAC6为靶点的干预方式均以阻断剂为主,尚未见其上游miRNA的相关研究报道。本研究发现,miR-362为HDAC6的上游基因,并且miR-362与HDAC6呈负相关关系。BCP大鼠脊髓miR-362的表达下降伴随着HDAC6表达的升高;当上调miR-362时,脊髓HDAC6表达显著下降,并且其痛行为学反应明显改善。当通过转染技术转染HDAC6质粒时,miR-362的镇痛效应被逆转,据此推测miR-362在体内是通过抑制HDAC6减轻大鼠BCP的进展。
目前认为,HDAC6是炎性相关疾病发生发展的重要调节因子。ZHANG等[15]研究表明,HDAC6特异性阻断剂ACY-1215可显著抑制脂多糖(lipopoly⁃saccharide,LPS)诱导的RAW264.7巨噬细胞活性氧(reactive oxygen,ROS)的过度分泌,同时也可抑制促炎因子TNF-α、IL-1β和IL-6等的表达;其进一步研究发现,炎症相关被激活的toll样受体4(toll like receptor 4,TLR4)、核 因子E2相 关 因子2(nuclear factor E2-related factor 2,Nrf2)、血红素氧合酶1(heme oxygenase 1,HO-1)的蛋白表达以及丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和NF-κB p65信号通路被显著抑制。另外,在一项氧化应激-炎症的相关研究中发现,Cay作为一种HDAC6特异性阻断剂,可通过调节NF-κB和NOD样 受 体 家 族3(nucleotide binding oligomeriza⁃tion domain-like receptors,NLRP3)炎症小体途径抑制高血糖诱导的ARPE-19视网膜色素上皮细胞氧化应激、炎症和凋亡,提示Cay可能是治疗糖尿病视网膜病变的一种潜在药物[16]。本研究发现,BCP大鼠脊髓HDAC6的表达显著提高,当用HDAC6 siRNA抑制HDAC6的表达后,miR-362的表达水平无明显变化,表明HDAC6的下调并不影响miR-362的表达,但BCP大鼠炎症相关NF-κB p65信号通路出现显著抑制,其下游IL-1、IL-6和TNF-α表达水平显著降低。以上均表明,miR-362可能是通过靶向调控HDAC6-NF-κB p65通路完成对BCP大鼠痛觉的调控。
综上,miR-362在BCP大鼠模型中低表达,上调其表达可通过抑制HDAC6-NF-κB p65信号通路改善痛行为学反应。这为BCP的分子治疗提供了新的靶点及理论基础。
