miRNAs在小鼠糖尿病肝病模型中的作用及其机制
2021-10-14江波涛舒立荣卢舒琪许海云
江波涛,舒立荣,王 筠,卢舒琪,董 蕾,陈 程,许海云
(1.深圳大学生命与海洋科学学院,广东深圳 518055;2.西安交通大学第二附属医院,陕西西安 710004;3.汕头大学医学院,广东汕头 515041)
糖尿病是由于机体糖代谢紊乱所致机体持续性高血糖,多伴有脂肪和蛋白质代谢紊乱,使机体多系统出现功能障碍,乃至危及患者生命的慢性内分泌代谢性疾病[1]。根据国际糖尿病联盟官网发布的最新数据显示,2019年我国成年人糖尿病患者已经高达
1.164亿,在所有疾病中,其发病率和致死率均居第3位。这已严重威胁全人类,特别是我国人民的健康和社会的发展[2-3]。Ⅰ型和Ⅱ型是临床上最常见的两大糖尿病亚型[4-5]。
大量的基础研究与临床实践已揭示,糖尿病早期病变并不明显,危害轻微。但是,长期的高血糖状态可以引发机体多种器官的并发症,例如高血压等心脑血管疾病、视网膜病变、糖尿病足、肾脏病变以及神经病变等[6-9]。作为机体重要的能量代谢器官之一,肝脏也常被慢性糖尿病所累及。而糖尿病肝病是对一系列由糖尿病导致肝脏组织细胞损伤的统称,在临床上有较高的发病率[6-8]。肝脏病理生理改变有微血管病变、糖原沉积、细胞水肿、嗜酸性变性、血色素沉积和肝炎、肝纤维化、肝硬化、脂肪肝以及胰岛素抵抗加剧等[9-11]。虽然已有研究表明,胰岛功能、糖和脂代谢紊乱在糖尿病肝脏损害的病变中可能发挥重要作用[12-16],但有关糖尿病肝病发生发展的具体分子调控机制仍尚无定论。
近年来,microRNA(miRNA)作为生命体内广泛存在的内源性非编码单链小分子(20~24碱基),相关研究已不断探索其生理与病理重要功能。科学家们发现它们可以通过靶向识别,结合特异性基因,抑制其转录与翻译;或通过促进自身降解来调控下游效应基因的表达水平[17]。同一种miRNAs可以互补结合多个不同的靶基因,而同一个靶基因也可以结合不同种的miRNAs,由此,它们通过独特反应轴或互作关联网络在疾病的发病过程中发挥着复杂的分子调控作用[18]。早期多个研究已发现,miRNA在糖尿病和并发症中也发挥着一定的关键作用[19-21]。但是,对于这些miRNAs对糖尿病肝病病变的具体作用机制,仍有待于深入研究。本研究以构建链脲佐菌素(STZ)诱导糖尿病小鼠模型的病变肝组织为研究对象,利用生物信息学、分子生物学和病理学手段,探究与糖尿病肝病相关的miRNAs及其潜在的分子调控机制,为糖尿病肝病的早期诊治打开新的思路。
1 材料与方法
1.1 小鼠糖尿病模型的构建及取材从汕头大学医学院实验动物中心获得SPF级的8~10周龄雄性昆明小鼠,随机分为STZ组(n=20)和正常对照组(n=10),重复实验2次。禁食12 h分别进行腹腔注射,STZ组第一天每只小鼠腹腔注射10 g/L无菌STZ 100 mg/kg(STZ溶液用柠檬酸盐缓冲液配制),对照组每只小鼠注射等体积柠檬酸盐缓冲液。STZ组小鼠的血糖水平需≥16.7 mmol/L,注射后第三天,血糖未超过阈值的,再次注射50 mg STZ,待STZ组全部小鼠血糖超过阈值后,即认定建模成功。每周测定各组小鼠体质量、血糖、饮食、饮水量。STZ组小鼠高血糖阈值>22 mmol/L,高血糖持续维持6~8周,分别采取两组小鼠的肝脏组织样本,立即分别置于10%甲醛溶液常温过夜,再用缓冲液置换后,低温保存;或置于RNA保存液4℃过夜,再转入-80℃冰箱长期保存备用。
1.2 HE染色取各组已固定肝脏组织标本,制作6 μm厚度的石蜡切片,HE染色。染色后置于玻片自动扫描仪下观察肝脏组织结构并拍照、记录。
1.3 数据库相关生物信息挖掘及比对分析利用GEO(Gene Expression Omnibus)检索数据库,依据质控挑选出GSE39752和GSE13840两个表达谱子数据集,从中获取STZ组与正常对照组小鼠肝组织中mRNAs的 数 据 和miRNAs的 数 据[19-20]。用NCBI数据库中内置的GEO2R分析软件,对获取到的数据进行差异比对,并对获取的表达数据设定以下阈值,进行初步筛选。
miRNAs差异表达阈值是以2为底的对数差异倍数(log2FC)和呈显著性差异而筛选的,即|log2FC|>1,P<0.05,表示基因表达差异显著。由于从GEO数据库子数据集中取得的相关miRNAs的FC值均普遍偏小,故符合阈值的结果较少。因此,为满足增加可选择的候选miRNAs,以免漏筛有意义的miRNA。本研究进行了筛选标准的微调,并对结果的可靠性增加了后期的验证实验。于是,miRNAs的差异筛选阈值为|log2FC|>0.6,P<0.05;mRNAs的差异筛选阈值为|log2FC|>1,P<0.05。分别使用软件GraphPad和TBtools绘制差异表达mRNA的火山图与热图。
作为Cytoscape的一个在线插件工具,Metascape(http://metascape.org)整合了多个权威性大数据库和分析软件。本研究依据表达差异阈值,将前期筛选出的一批与糖尿病-肝病相关的miRNAs和mRNAs导入Metascape,可对输入的基因进行GO和KEGG等富集分析,还可将分析的结果可视化[21]。
1.4 与糖尿病病变相关的差异miRNAs的效应mRNAs的预测TargetScan、miRBD和miRTarBase是较常应用且置信度较高的miRNA靶基因预测工具数据库,分别预测筛选出miRNAs的靶基因。先取数据库TargetScan和miRBD的交集,然后将交集数据再与数据库miRTarBase的结果取并集,由此得到了miRNA靶标的预测结果。继而,将miRNAs预测到的靶基因与从GEO数据库中获取的差异表达的mRNAs取交集,得到初步筛选的miRNAs靶基因。最后,再从中挑取出与miRNA表达具有相反表达趋势的靶基因,并以此为依据,筛选出可信度较高的候选靶基因。
1.5 qRT-PCR检测按照RNA提取试剂盒(聚合美生物科技有限公司,北京)说明书步骤,从STZ组和对照组小鼠肝脏标本中提取包括miRNAs和mRNAs的组织总RNAs,再将miRNAs和mRNAs反转录为cDNAs,其中使用Mir-X™miRNA第一链合成试剂盒(TaKaRa,日本)反转录miRNAs,使用赛默飞世尔™反转录第一链cDNA合成试剂盒(Thermo Scientific,美国)反转录mRNAs。
针对筛选出的miRNA和mRNA序列片段设计引物,其中miRNA片段扩增的引物序列是按逆转录加尾法合成线性特异性基因序列。正向引物需依据特异性miRNA序列碱基设计合成,反向引物可统一使用通用下游引物mRQ 3’。mRNA片段扩增的引物序列是按常规原则设计上下游引物,再在Blast中检验其独特性,引物合成后,再在小样本上测试其扩增的准确性。所有引物均委托上海生工生物工程有限公司合成(表1,表2)。

表1定量检测miRNAs的引物信息Tab.1 List of miRNA primers for quantitative Real-time PCR reaction

表2 定量检测mRNAs的引物列表Tab.2 List of paired mRNA primers for quantitative Realtime PCR reaction
运用经miRNA或mRNAs反转录的cDNAs为模板,在Hieff®qPCR SYBR Green Master Mix(Low Rox Plus)(YESEN)和SYBR®Premix ExTaqⅡ(Tli RNaseH Plus)(TaKaRa))扩增反应试剂中,通过qRT-PCR法对各组小鼠肝组织的候选miRNAs和mRNAs进行扩增验证。每个样本重复实验3次,且对动物模型执行了2次生物学重复。
1.6 数据的计算处理数据使用SPSS18.0软件进行数据分析,运用2-△△Ct法分析qRT-PCR检测miRNA和mRNA的定量表达情况。利用Student’st-test对2组的表达差异进行比较分析。P<0.05为差异有统计学意义。使用GraphPad Prism 9.0软件对生物信息分析结果进行可视化展示。
2 结 果
2.1 肝脏组织形态学改变HE染色显示,正常组小鼠肝组织结构清晰,细胞大小正常,胞核明显;而STZ组小鼠肝细胞肿大变形,肝索排列紊乱(图1)。

图1 正常组(A)与STZ组(B)小鼠肝组织的HE染色结果Fig.1 HE staining of liver for NC(A)and STZ groups(×200)
2.2 筛选与糖尿病肝病相关的差异表达miRNAs基于GEO数据库数据集GSE13840数据和筛选阈值,共筛选出4条符合筛选条件的、与糖尿病可能相关的差异表达显著的miRNAs(mmu-miR-34a-5p、mmu-miR-200a-3p、mmu-miR-200b-3p和mmumiR-222-3p),再加上课题组之前在Ⅰ型糖尿病小鼠肝脏研究中预测到的2个miRNA(mmu-miR-6998-5p和mmu-miR-22-5p),共计6个miRNAs(表3)。

表3 STZ诱导糖尿病相关的差异表达miRNAsTab.3 A list of STZ-induced diabetes related miRNAs
2.3 从数据库筛选的与糖尿病病变相关的差异表达mRNAs基于GEO数据库数据集GSE139752的数据和筛选阈值,获得了与糖尿病可能相关的差异表达显著的173个mRNAs,其中包括过表达基因96个,表达受抑制基因77个。分别用软件GraphPad和TB⁃tools绘制火山图(图2)与热图(图3)。基因表达热图展示了差异基因在正常对照组和STZ组小鼠肝组织中的表达情况,筛选出的基因在正常对照小鼠和糖尿病小鼠肝组织中有明显差异,其中,颜色偏向红色则表示基因呈高表达,而偏向蓝色则代表该基因呈低表达,颜色越深则代表差异倍数越大(图3)。这一结果为后续的靶基因预测提供了初步的线索。
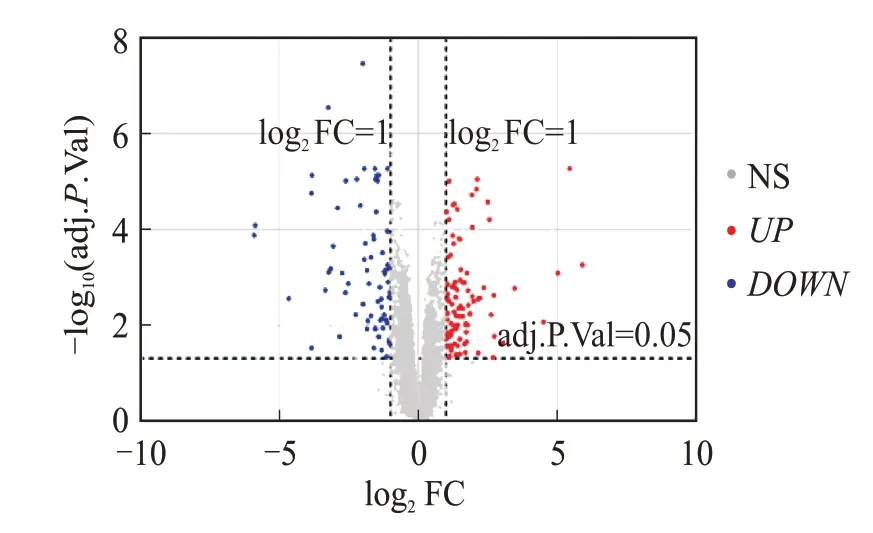
图2 STZ诱导糖尿病的相关差异表达mRNAs的火山图Fig.2 STZ-induced differential expression of mRNAs re⁃lated to diabetes
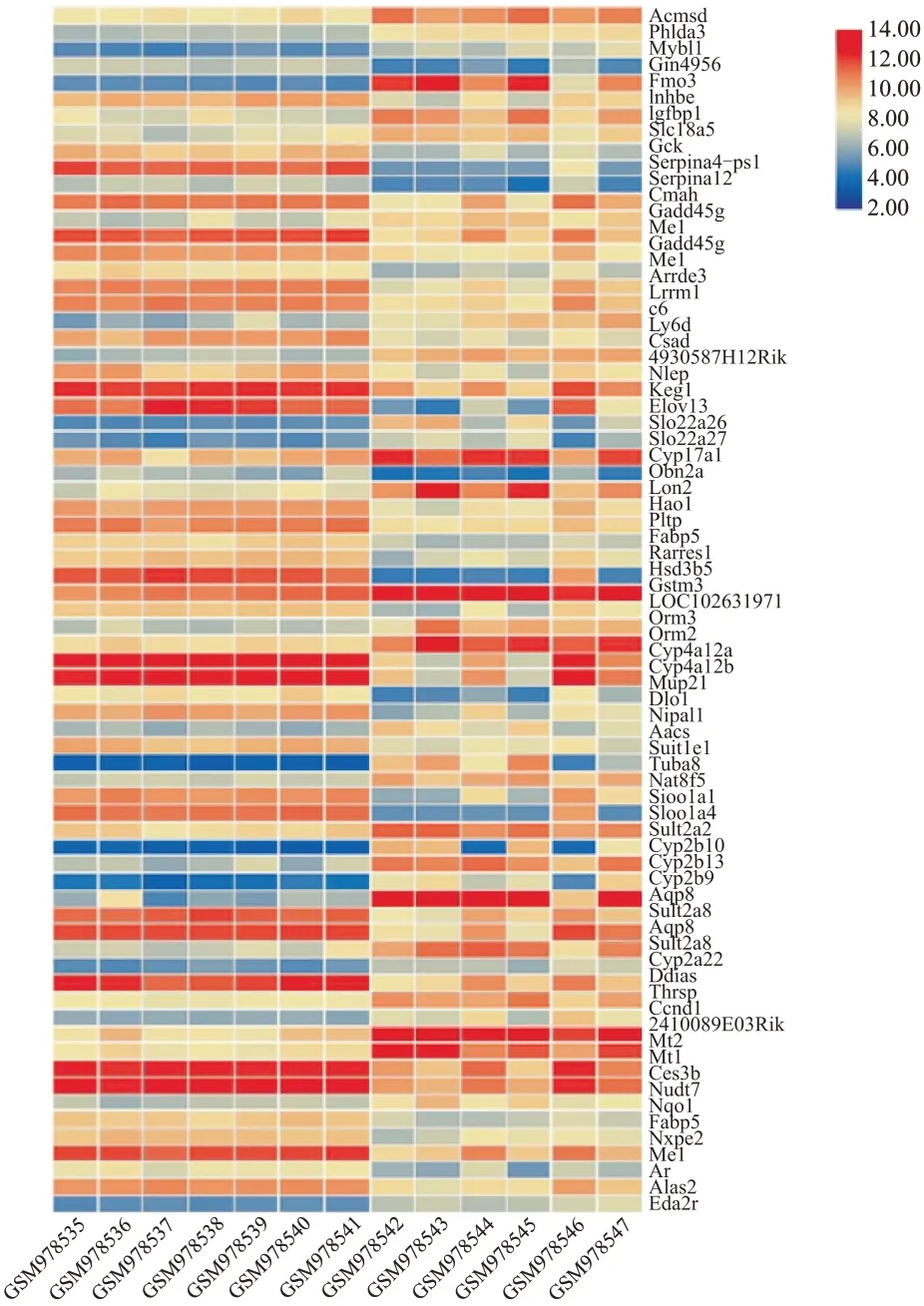
图3 STZ诱导糖尿病的相关差异表达基因的热图Fig.3 STZ-induced differential expression of mRNAs related to diabetes
基因表达的火山图和热图均显示,STZ组小鼠肝组织与正常小鼠相比,存在着明显的基因表达差异,提示这些差异表达基因极有可能影响糖尿病发生发展的调控机制。
2.4 小鼠糖尿病模型差异表达mRNAs的功能富集分析将按初步筛选标准挑选出的基因导入分析网站Metascape,进行富集分析以明确其功能。其中GO功能富集分析结果显示,差异mRNAs主要参与了一元羧酸代谢过程、异源代谢过程、脂质分解代谢过程等生物途径;KEGG分析的结果显示,这些mRNAs主要参与了类固醇激素的合成和PPAR信号通路;反应组基因集分析结果显示,差异mRNAs主要参与了脂质代谢、三酰甘油代谢和脂肪酰基辅酶A的生物合成(图4)。

图4糖尿病相关差异表达基因的富集数目列表Fig.4 A list of the number of differential gene enrichment related to STZ-induced diabetes
2.5 糖尿病小鼠肝病候选miRNAs靶向mRNAs的预测结果首先使用数据库TargetScan、miRBD和miR⁃TarBase对 筛 选 出 的miRNAs(mmu-miR-34a-5p、mmu-miR-200a-3p、mmu-miR-200b-3p、mmu-miR-222-3p、mmu-miR-6998-5p和mmu-miR-22-5p)分别进行靶基因预测分析,再与糖尿病差异表达基因取交集,该交集中与差异miRNAs具有相反表达趋势的mRNAs则极有可能为miRNA的靶基因(图5)。最终,筛选出进一步进行实验的潜在靶基因(表4、图6)。
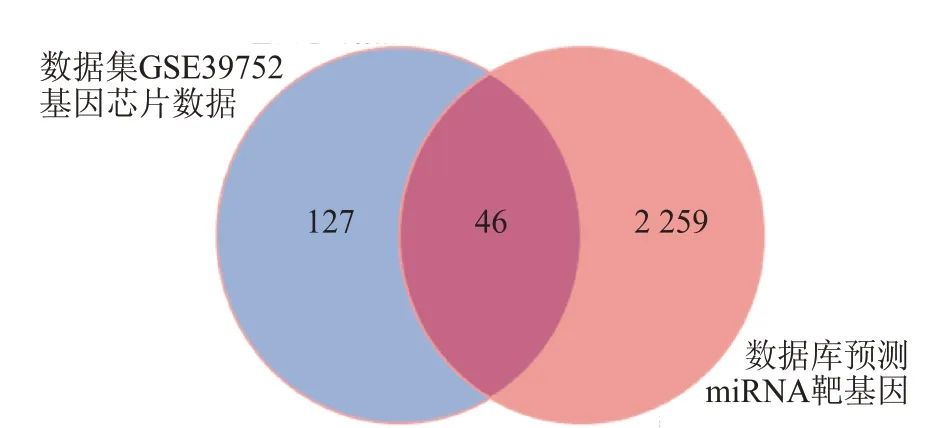
图5 与STZ诱导糖尿病肝病相关的miRNA靶基因的筛选图Fig.5 Target genes of miRNAs related to STZ induceddiabetic hepatopathy were screened

图6 与STZ诱导糖尿病肝病可能相关的miRNA与mRNA的互作图Fig.6 Interaction networks of miRNAs and mRNAs in STZ-induced diabetic hepatopathy
2.6 候选miRNAs在糖尿病肝病的表达及其潜在调控基因qRT-PCR结果显示,与正常对照组相比,STZ组 小 鼠 肝组 织 中 的3个miRNAs(miR-34a-5p、miR-22-5p和miR-6998-5p)显 著 上 调,而 另 外3个miRNAs(miR-200a-3p、miR-200b-3p和miR-222-3p)显著下调(图7);对所发现的与糖尿病肝病相关的miRNAs进行预测并进行qRT-PCR验证,获得可能与下游信号通路相关的潜在调控基因:Bcl6、Cers6、Acss2、Slco1a4、Mybl1、Plk2、Scd2和Slc10a2。其中,表达显著上调的mRNA有5个(Cers6、Mybl1、Scd2、Slco1a4和Plk2),而表达显著下调的mRNA有Acss2、Bcl6和Slc10a2(图8)。这些靶基因大多已被证实与糖尿病肝脏的糖代谢或脂代谢相关,并极有可能在糖尿病的发生发展中发挥重要作用。但目前尚未有报道其与糖尿病肝损伤的直接关联性。
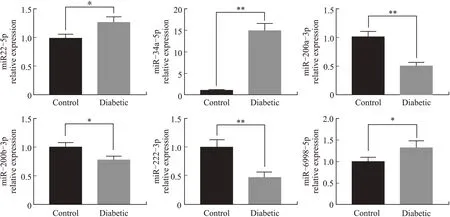
图7 STZ诱导糖尿病组小鼠肝组织差异表达miRNAs的相对定量比较Fig.7 Differential expression of miRNAs in mouse livers in STZ-induce diabetics and normal controls
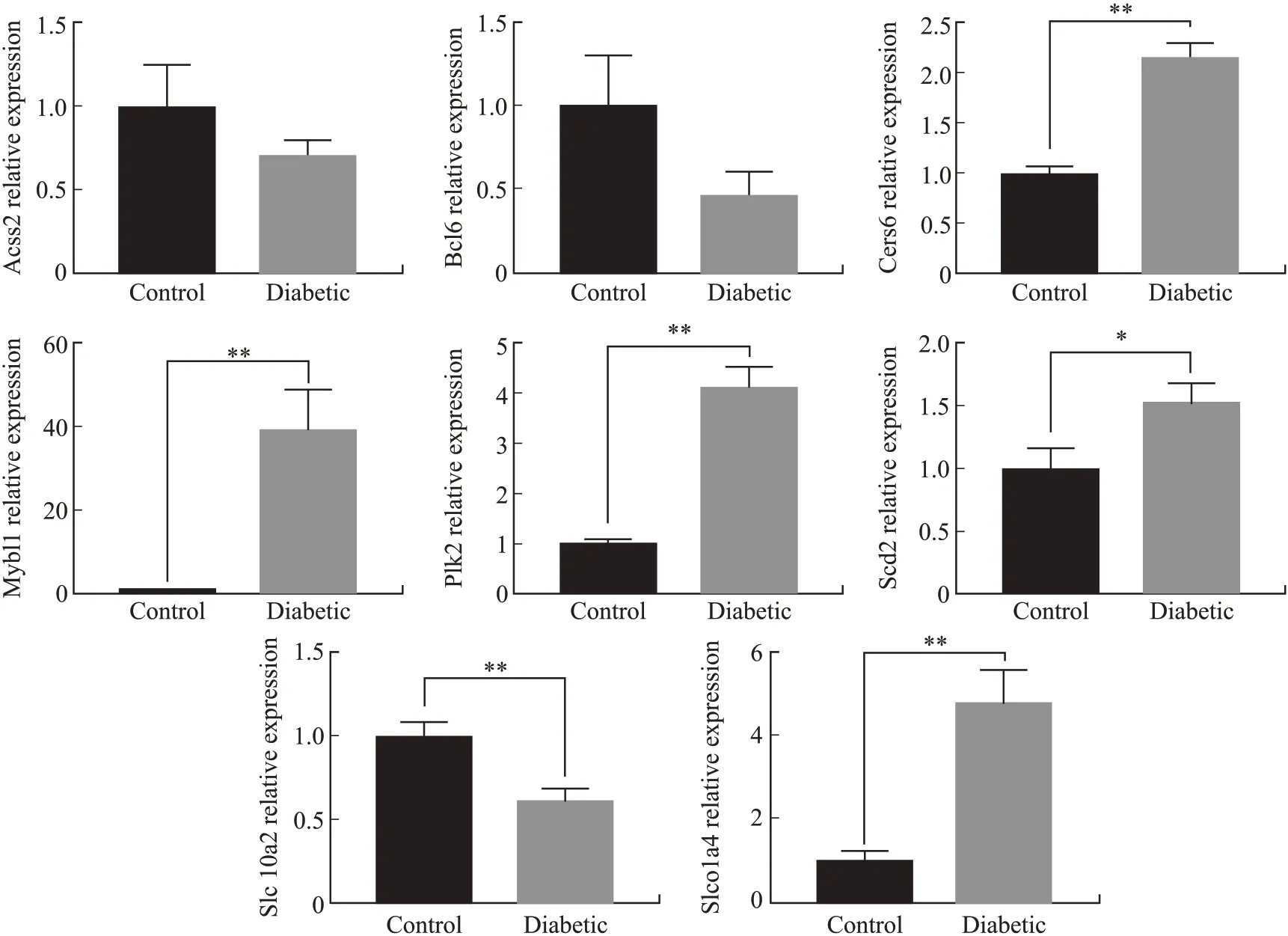
图8 STZ诱导糖尿病组小鼠肝组织差异表达mRNAs的相对定量比较Fig.8 Differential expression mRNAs in mouse livers in STZ-induce diabetics and normal controls
3 讨 论
近年来随着高通量基因组学检测技术的快速发展和对糖尿病病理生理机制的深入研究,筛选糖尿病异常表达的miRNAs,以寻求作为精准诊疗的潜在生物标志物已是研究热点。有研究表明,肝脏中miR-29a和miR-29c都是通过磷脂酰肌醇3-激酶(PI3K)调节胰岛素信号转导的重要负调节剂,可以增强胰岛素抵抗,提示miR-29家族对糖尿病有强大的调节功能[22-23]。本研究通过成功构建糖尿病小鼠模型,经比对分析6~8周时STZ诱导糖尿病小鼠和健康小鼠肝脏组织内的miRNA和mRNA,发现有多个差异表达miRNAs与mRNAs,并证实在糖尿病小鼠肝脏组织中,miR-34a-5p、miR-22-5p、miR-6998-5p的表达明显上调,miR-200a-3p、miR-222-3p和miR-200b-3p的表达显著下调,差异均具有统计学意义。这表明差异表达miRNAs很有可能参与调控了糖尿病病变的发生发展。其中,miR-34a-5p在STZ-Ⅰ型糖尿病小鼠肝脏组织中表达倍数高达近20倍,是上调幅度最大的miRNA,而其余表达差异显著的miR-222-3p、miR-200a-3p、miR-200b-3p等均已被报道在糖尿病肝能量代谢中可表现出功能调控的潜能[24-26],而尚未发现前者与糖尿病肝损伤相关的报道。而本课题组前期实验结果预测到的miR-22-5p和miR-6998-5p差异表达miRNAs在糖尿病模型中是首次发现。本研究虽初步进行了生物信息学的预测分析并对其差异表达进行实验验证,但对其在糖尿病病变中作用于何种靶基因,通过哪种信号通路,仍需进一步研究进行证实。
本研究还发现,这些候选miRNAs可调控的下游通 路 的 效 应 基 因 包括Bcl6、Cers6、Acss2、Slco1a4、Mybl1、Plk2、Scd2和Slc10a2。其中,多数基因已被证实可能与糖尿病的生理生化调节过程相关,如Bcl6可作为氧化代谢的负调节剂,参与调控脂质代谢、氧化代谢和PPAR途径[27-29],是体内脂肪分布的关键调节剂,具有直接抑制脂肪细胞中脂肪酸生物合成的作用[30-31];Slc10a2在糖尿病小鼠模型中的药理抑制作用可改善三酰甘油的代谢,并使小鼠血浆葡萄糖和胰岛素水平升高等[32]。但是,这些与糖尿病相关的关键基因对糖尿病的发生发展所起到的作用,仍有待于在细胞和动物模型中进行深入系统的研究。
miRNA与β细胞数量和功能及免疫系统稳态的调控密切相关,并且可直接或间接参与胰岛细胞的发育、糖代谢及糖尿病及其并发症的发生,是糖尿病发病机制的主要参与者,检测特定组织或体液的特定miRNA水平可能会用于预测糖尿病的危险因素。随着生物技术的不断进步,学者们正逐步探索miRNAs在糖尿病中的作用。本研究以STZ诱导糖尿病昆明小鼠为实验对象,以大数据库数据和生物信息学分析手段为基础,预测了一组与糖尿病肝病相关的miRNA及其潜在的效应功能基因;还用qRT-PCR法验证了这些miRNAs和mRNAs在糖尿病肝病中的表达变化,为糖尿病中miRNA的分子病理学和发病机制研究提供了新的视野与途径。未来更有可能将miRNA作为治疗靶点,通过改善关键miRNA的表达以治疗糖尿病。
