HBx蛋白抑制滋养细胞凋亡的作用及机制
2021-10-14潘怡霞林亚云郭凡凡张文涛白桂芹
潘怡霞,林亚云,刘 妍,郭凡凡,张文涛,白桂芹
(1.西安交通大学第一附属医院妇产科,陕西西安 710061;2.昆明医科大学第一附属医院生殖遗传科,云南昆明 650032;3.解放军总医院第五医学中心,临床研究管理中心,北京 100039;4.西安市第三医院妇产科,陕西西安 710016)
中国是乙肝病毒(hepatitis B virus,HBV)感染的高发地带,人群HBV携带率为9.9%,HBV感染与慢性肝炎、肝硬化和肝癌密切相关[1-3]。HBV母婴传播包括宫内感染、分娩过程中的感染和分娩后的感染[4]。从母亲到婴儿的后两种传播途径可通过在婴儿出生后立即使用HBV疫苗和HBV免疫球蛋白(hepatitis B immunoglobulin,HBIG)治疗而阻断[5]。但仍然有5%~10%的婴儿未能阻断HBV感染,这主要是发生宫内感染所致[6-9]。本课题组前期的研究发现HBV可通过母体血液接触胎盘并感染胎盘滋养细胞,产生乙肝X蛋白(hepatitis B X protein,HBx),与胞内磷脂酰肌醇激酶(phosphoinositide 3-kinase,PI3K)、丝氨酸/苏氨酸特异性蛋白激酶(protein ki⁃nase B,Akt)抑制滋养细胞凋亡的信号通路有关[10-11]。本研究将进一步明确HBx蛋白通过内皮生长因子受体(epidermal growth factor receptor,EGFR)/PI3K/Akt信号通路抑制胎盘滋养细胞凋亡的具体机制。
1 材料与方法
1.1 材料人绒毛膜癌细胞株JEG-3(中科院上海生命科学研究院细胞库),人滋养细胞HTR-8(第四军医大学唐都医院妇产科实验室),DMEM高糖培养、RPMI-1640培养基(美国Gibco公司);优质胎牛血清(美国Gibco公司),胰蛋白酶(Amresco公司)。EGFR过表达慢病毒颗粒(复能基因),EGFR shRNA(维真生物),pGL3-EGFR启动子荧光素酶表达质粒(上海宇玫博生物),pGL3-basic、pGL3-control、pRLTK质粒(Promega公司),pGFP-HBx表达质粒(Add⁃gene);质粒提取试剂盒、胶回收试剂盒(上海生工生物工程有限公司、德国QIAGEN公司);0.22 μm滤器(Millpore公司);转染试剂X-tremeGENE HD(德国Roche公司)。兔抗人HBx多克隆抗体、兔抗人EGFR多克隆抗体(Abcam公司),兔抗人PI3K单克隆抗体、兔抗人p-Akt单克隆抗体、兔抗人Akt单克隆抗体(Cell Signaling公司);化学发光底物(Thermo公司);辣根过氧化物酶结合的山羊抗鼠IgG、辣根过氧化物酶结合的山羊抗兔IgG、兔抗β-actin多克隆抗体、鼠抗β-actin多克隆抗体(北京康为世纪生物公司);羊抗兔IgG-Cy3(康维世纪)。8孔腔室载玻片(ibidi),细胞凋亡试剂盒(凯基生物)。pGFP-HBx质粒、野生型pTriEx-1.1 HBV质粒和HBx缺失突变型pTriEx-1.1 HBV质粒为本课题组前期构建提取储存。
1.2 细胞培养将JEG-3及HTR-8细胞从液氮中取出复苏后,JEG-3细胞培养于含100 mL/L胎牛血清的DMEM高糖培养基中,HTR-8细胞培养于含100 mL/L胎牛血清的RPMI-1640培养基中,置于含50 mL/L CO2、37℃恒温细胞培养箱中孵育。将复苏成功的细胞培养传2代后进行后续实验。
1.3 双荧光素酶检测HBx与EGFR启动子的关系分别将正常培养的JEG-3、HTR-8细胞以3×105/孔接 种 至24孔板,16~18 h时将pGL3-EGFR启动子荧光素酶表达载体与内参pRL-TK载体按30∶1的比例分别共转染2种细胞。每种细胞各分为3组。实验组(HBx+E组)共转染pGFP-HBx表达质粒和pGL3-EGFR启动子荧光素酶表达载体;空载体对照组(Control组)共转染pGFP空载体和pGL3-EGFR启动子荧光素酶表达载体;阴性对照组(NC组)共转染pGFP-HBx表达质粒和pGL3-Basic荧光素酶表达载体。设置pGL3-Basic荧光素酶报告载体为阴性对照,pGL3-Control荧光素酶报告载体为阳性对照。48 h时进行各组细胞荧光素酶活性检测,分析HBx对EGFR启动子活性的影响。
1.4 EGFR过表达或敲低的JEG-3、HTR-8细胞系的构建及实验分组通过慢病毒颗粒感染细胞构建EGFR稳定表达细胞系:培养JEG-3、HTR-8细胞至对数生长期,每孔9.5×104个细胞于500 μL相应细胞培养液至24孔板,过夜培养后更换完全培养液,分别加入相应的慢病毒颗粒液,即慢病毒量(mL)=接触慢病毒的细胞数×MOI/慢病毒滴度(TU/mL)。感染12~16 h后,吸弃含慢病毒颗粒的培养液,加完全培养液继续培养72~96 h,观察荧光表达。于感染72 h时加入嘌呤霉素2 μg/mL药物筛选。将稳定过表达EGFR的JEG-3、HTR-8细胞系定义为EGFR过表达组。
通过脂质体法转染细胞构建敲低EGFR表达细胞系:稳定过表达EGFR的JEG-3、HTR-8细胞培养至对数生长期,按每孔约1.0×106个细胞接种于6孔板中,培养至50%~60%汇合时采用脂质体转染法转染EGFR shRNA。将2 μg质粒 和4 μL转 染试剂X-tremeGENE HP混匀后室温孵育30 min,加入细胞培养孔,摇匀后继续培养72 h,显微镜下观察细胞形态。将干扰EGFR表达的JEG-3、HTR-8细胞系定义为EGFR敲低组。本研究另设空白对照组,细胞未进行处理。
1.5 Western blotting检测EGFR/PI3K/p-Akt的表达分别收集1.4项各组细胞,加入RIPA裂解液于冰上裂解30 min。4℃12 500 r/min离心25 min,离心后保留上清,用BCA法测定蛋白浓度,计算蛋白上样量。用SDS-PAGE电泳法进行蛋白电泳后通过转膜仪移至硝酸纤维素膜上;将膜置于含50 g/L脱脂奶粉的TBST中进行抗体封闭2 h,随后分别于一抗(兔抗人EGFR多克隆抗体1∶1 000,兔抗人PI3K单克隆抗体、兔抗人p-Akt单克隆抗体1∶500,兔抗人Akt单克隆抗体1∶800,鼠抗β-actin多克隆抗体1∶1 000)及HRP标记的二抗(辣根过氧化物酶结合的山羊抗鼠IgG、辣根过氧化物酶结合的山羊抗兔IgG均为1∶2 000)孵育后,ECL发光液显色,压片保存。
1.6 激光共聚焦成像分析EGFR/PI3K/p-Akt蛋白定位表达分别收集1.4项各组细胞,按每孔4.5×104个细胞接种到8孔腔室载玻片。48 h后细胞生长至约90%,弃上清,用1×PBS清洗细胞,40 g/L多聚甲醛 固 定,1 mL/L Triton X-100破 膜,30 g/L BSA室温封闭2 h。一抗(兔抗人EGFR多克隆抗体1∶500,兔抗人PI3K单克隆抗体、兔抗人p-Akt单克隆抗体1∶250)4℃孵育过夜,二抗(羊抗兔IgG-Cy3 1∶500)37℃避光孵育40 min,加细胞核染液DAPI染核10 min,PBS再次清洗 后,在Olympus FV1000共聚焦显微镜下观察并分析结果。
1.7 Western blotting检测HBx、PI3K/p-Akt的表达在6孔板内培养JEG-3、HTR-8细胞,每种细胞分为4组,分别转染pGFP-HBx质粒、野生型pTriEx-1.1 HBV质 粒、HBx缺 失 突 变 型pTriEx-1.1 HBV质粒和pGFP空载体。培养72 h,收集各组细胞进行Western blotting检测,具体步骤同1.6项(兔抗人HBx多克隆抗体1∶500)。
1.8 流式细胞仪检测细胞凋亡收集1.4项各组细胞接种于12孔板培养72 h,分别用不含EDTA的胰酶消化,PBS洗涤细胞2次(2 000 r/min离心5 min)收集(1~5)×105细胞;加入500 μL的Binding Buffer悬浮 细 胞;加 入5 μL Annexin V-FITC混 匀 后,加 入5 μL PI(propidium iodide),混匀;室温、避光反应5~15 min;在1 h内使用流式细胞仪检测。将1.7项中的各组转染细胞培养48 h,分别用不含EDTA的胰酶消化收集,用流式细胞仪检测细胞凋亡。
1.9 统计学处理采用SPSS 18.0统计软件对资料进行统计学分析;实验数据以“均数±标准差”表示,2组样本比较采用独立样本t检验,多组样本比较采用单因素或双因素方差分析,组间多重比较采用Bonferroni多重比较法分析。P<0.05为差异有统计学意义。
2 结 果
2.1 双荧光素酶报告基因检测HBx与EGFR启动子的关系结果显示,同时转染HBx质粒和pGL3-EGFR启动子荧光素酶表达载体的实验组(HBx+E组)JEG-3和HTR-8细胞中,pGL3-EGFR启动子荧光素酶表达较空载体对照组(Control)及阴性对照组(NC组)均显著增高(均为P<0.01,图1)。
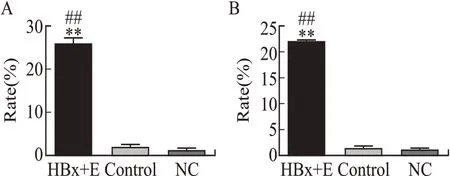
图1双荧光素酶报告基因检测HBx与EGFR启动子的关系Fig.1 Relationship between HBx and EGFR promoters de⁃tected by luciferase reporter assay
2.2 EGFR过表达时EGFR/PI3K/p-Akt蛋白的表达情况
2.2.1各组EGFR/PI3K/p-Akt蛋白的表达West⁃ern blotting结果显示,EGFR过表达组的2种细胞中EGFR蛋白表达高于空白对照组(JEG-3细胞,HTR-8细胞,均为P<0.05);EGFR敲低组的2种细胞内EGFR表达显著低于EGFR过表达组(均为P<0.01),说明EGFR过表达组及EGFR敲低组细胞构建成功。EGFR过表达组的2种细胞内PI3K及p-Akt的蛋白表达显著高于空白对照组和EGFR敲低组(均为P<0.01);各组之间Akt表达差异无统计学意义(图2)。
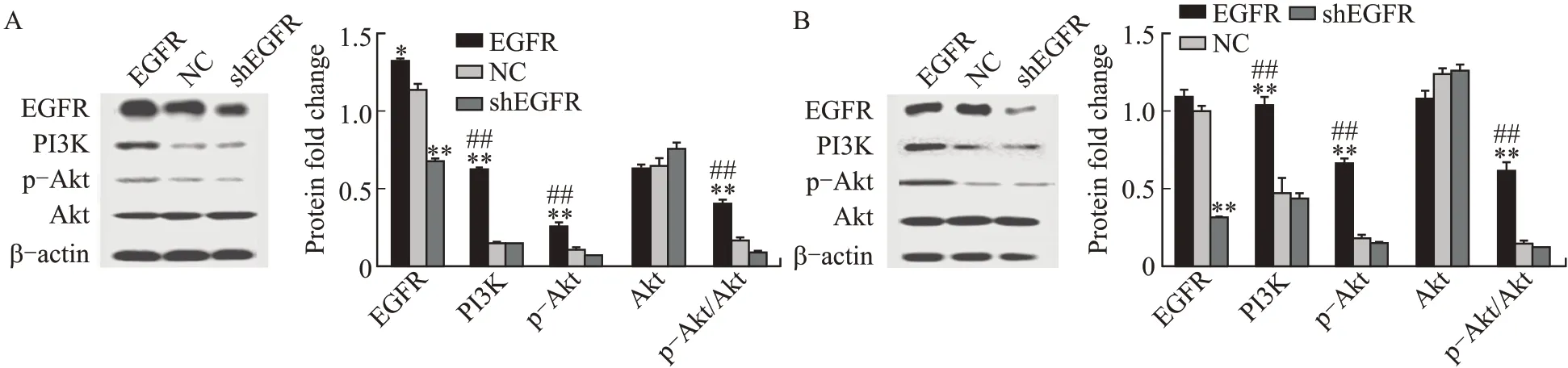
图2 Western blotting检测细胞内EGFR/PI3K/p-Akt蛋白表达Fig.2 Expression of EGFR/PI3K/p-Akt protein detected by Western blotting
2.2.2各组细胞内EGFR/PI3K/p-Akt蛋白表达定位激光共聚焦成像结果显示(图3):EGFR过表达组的EGFR蛋白表达高于空白对照组与EGFR敲低组(均为P<0.05);当EGFR过表达组细胞转染shRNA而敲低表达后,EGFR敲低组的两组细胞内EGFR表达较EGFR过表达组降低(均为P<0.05)。当EGFR过表达时,两组细胞内PI3K/p-Akt表达高于空白对照组和EGFR敲低组(均为P<0.05),表达变化与Western blotting结果一致。

图3激光共聚焦成像分析EGFR/PI3K/p-Akt蛋白表达定位Fig.3 Localization and expression of EGFR/PI3K/P-Akt protein by laser confocal imaging(×400)
2.3 EGFR/PI3K/p-Akt信号通路抑制细胞凋亡流式细胞术结果显示:EGFR过表达组2种细胞的凋亡比例较空白对照组显著降低(JEG-3P<0.05;HTR-8P<0.01);EGFR敲低组2种细胞的凋亡比例显著高于EGFR过表达组(JEG-3P<0.05;HTR-8P<0.01,图4)。这说明胎盘滋养细胞凋亡比例与EGFR/PI3K/p-Akt表达呈负相关。
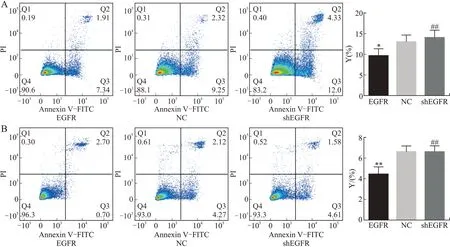
图4 流式细胞术检测EGFR/PI3K/p-Akt信号通路抑制细胞凋亡Fig.4 The inhibitory effect of EGFR/PI3K/p-Akt signaling pathway on apoptosis detected by flow cytometry
2.4 HBx蛋白促进PI3K/p-Akt信号通路蛋白表达当JEG-3、HTR-8两种细胞转染pGFP-HBx质粒及pTriEx-1.1 HBV野生型质粒时,可检测到HBx蛋白表达;转染HBx缺失突变型pTriEx-1.1 HBV质粒组和空载体对照组无HBx蛋白表达;当存在HBx蛋白表达时,即转染pGFP-HBx质粒组和转染pTriEx-1.1 HBV野生型质粒组中PI3K及p-Akt蛋白表达显著高于HBx缺失组和空载体对照组(均为P<0.05);各组之间Akt表达差异无统计学意义(图5)。

图5 Western blotting检测HBx及PI3K/p-Akt蛋白表达情况Fig.5 Expressions of HBx and PI3K/p-Akt protein detected by Western blotting
2.5 HBx蛋白抑制细胞凋亡流式细胞术结果显示,JEG-3和HTR-8两种细胞转 染pGFP-HBx组 及转染pTriEx-1.1 HBV组细胞凋亡率均较转染HBx缺失突变pTriEx-1.1 HBV组及空载体对照组显著降低(均为P<0.05,图6)。这提示绒毛膜癌滋养细胞凋亡比例与HBx/PI3K/p-Akt表达呈负相关。
3 讨 论
HBx可整合入EGFR等调控细胞生长基因,影响细胞内信号转导[12]。研究表明,HBx可影响EGFR和EGFR家族其他成员的激活[13-14],将不同的信号刺激传入细胞内,从而启动了信号转导级联而产生多种生化反应。而HBx激活EGFR的作用位点及机制还有待进一步研究。
本研究通过双荧光素酶活性检测,发现HBx质粒与EGFR启动子质粒共转染时,EGFR启动子表达显著高于空载体对照组及阴性对照组(P<0.01)。本研究首次发现并证实HBx蛋白可作用于EGFR启动子区域,激活EGFR启动子表达。
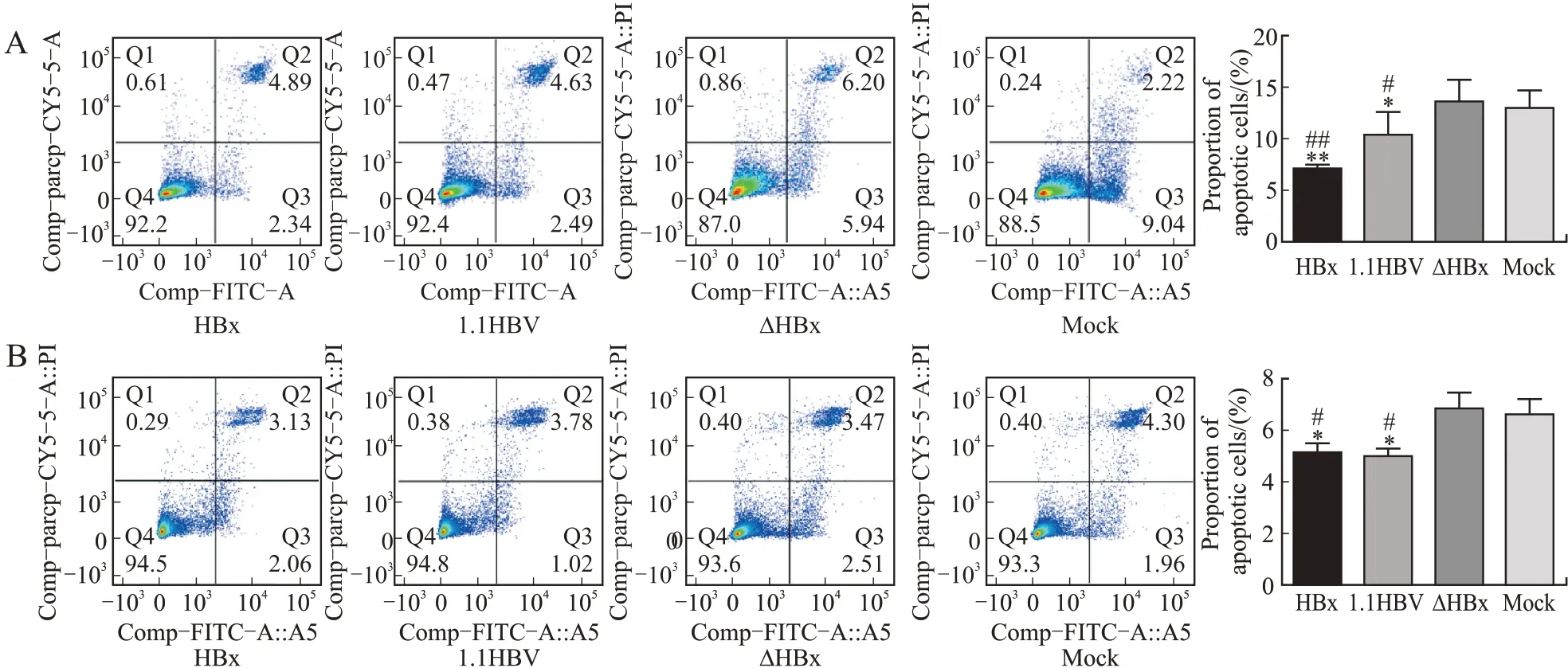
图6流式细胞术检测HBx蛋白对细胞凋亡的抑制作用Fig.6 The inhibition of HBx protein on apoptosis detected by flow cytometry
EGFR在哺乳动物细胞表面广泛分布,作为膜表面受体,具有酪氨酸激酶活性,可将不同的信号刺激传入细胞内,激活多种下游信号途径如PI3K/p-Akt/Bad、Ras/Raf/MEK/ERK等多种信号转导途径,与刺激细胞增殖、细胞移动性增强及器官的修复有密切关系[15]。EGFR/PI3K/p-Akt在许多类型细胞的增殖调控和凋亡抑制中发挥关键作用[16-17]。
为探讨在胎盘滋养细胞内EGFR/PI3K/p-Akt信号通路的调控机制与HBV宫内感染之间存在的内在关系,本研究构建了EGFR过表达滋养细胞,使用shRNA敲低过表达组EGFR表达,通过Western blotting及激光共聚焦检测EGFR/PI3K/p-Akt表达及定位。EGFR/PI3K/p-Akt均位于细胞质中,当EGFR过表达时PI3K/p-Akt表达显著升高(P<0.01),Akt表达无统计学差异,细胞凋亡比例显著降低(JEG-3P<0.05;HTR-8P<0.01)。EGFR过表达组被敲低后,PI3K/p-Akt表达显著降低(P<0.01),Akt表达无统计学差异,细胞凋亡比例显著增加(JEG-3P<0.05;HTR-8P<0.01)。胎盘滋养细胞内EGFR过表达时可以激活其下游信号通路PI3K/p-Akt,并通过PI3K/p-Akt信号通路抑制胎盘滋养细胞凋亡,证实EGFR激活PI3K/p-Akt从而抑制胎盘滋养细胞凋亡,使感染HBV的滋养细胞寿命延长,逃避机体免疫系统的清除。HBV DNA得以大量复制合成,增加HBV宫内感染的危险性。
有研究表明,体外和体内的高复制状态下(HBV DNA>1×103copies/mL),尤其是HBV DNA>1×107copies/mL,滋养细胞内有HBxAg的表达,滋养细胞凋亡明显受到抑制,同时细胞内PI3K及p-Akt的表达上调。在妊娠过程中,孕妇血液内的HBV感染胎盘滋养细胞后,在其中复制繁殖,抑制滋养细胞凋亡,可能与产生的HBx蛋白及胞内PI3K/p-Akt信号通路有关[10-11]。WANG等[18]的研究发现,pEGFR蛋白在HBx感染的人胎盘组织和滋养细胞中明显上调,HBx通过激活EGFR/Akt通路,减少细胞凋亡,促进胎盘滋养细胞分泌胎盘激素。本研究发现,当胎盘滋养细胞内存在HBx蛋白表达时,PI3K/p-Akt表达显著升高(P<0.05),细胞凋亡率则显著降低(P<0.05)。这证实了HBx蛋白通过促进EGFR/PI3K/p-Akt信号通路,抑制胎盘滋养细胞凋亡,与已有研究报道的结果一致[19-20]。
综上所述,在胎盘滋养细胞内HBx蛋白作用于EGFR启动子区域,通过调控EGFR启动子区激活EGFR及其下游信号通路PI3K/p-Akt,抑制细胞凋亡,受HBV感染的胎盘滋养细胞生存期延长,有益于HBV DNA的复制,为病毒提供了潜伏场所,实现免疫逃逸。因此,探讨HBx蛋白在HBV宫内感染中的作用及机制是未来研究的重点。
