蛛网膜下腔出血后外泌体源性miR-630对微血管内皮细胞功能的影响
2021-10-14孙雷涛杜德勇李泽福张文生
孙雷涛,杜德勇,李 勐,李泽福,张文生
(滨州医学院附属医院神经外科,山东滨州 256603)
早期准确评估脑微血管内皮细胞(brain micro⁃vascular endothelial cells,BMECs)的损伤程度对研究蛛网膜下腔出血后早期脑损伤机制至关重要[1]。外泌体是细胞外膜囊泡,大小为40~100 nm,可由多种细胞类型分泌,如T淋巴细胞、神经元和BMECs[2-3]。外泌体中包含多种遗传相关分子及蛋白,影响细胞增殖、凋亡和功能。外泌体同样存在于脑脊液(cerebro⁃spinal fluid,CSF)循环中。由于CSF布满中枢神经系统并与受损组织广泛接触,被认为是研究与中枢神经系统损伤相关的miRNAs的重要途径[4]。
1 材料与方法
1.1 细胞培养人BMECs购自美国Kirkland公司。BMECs培养于DMEM培养基,并置于37℃50 mL/L CO2培养箱中。
1.2 建立BMECs损伤模型根据FINDLAY等[5]的方法制作人工血性脑脊液(BCSF)。在无菌条件下将正常血液与人工脑脊液按1∶1混合。于37℃水浴箱孵育7 d后取样离心(10 000 g,20 min)。收集BMECs并储存于4℃。将BMECs加入培养板或培养瓶培养24 h后加入无血清培养基同步,随机分为正常对照组和BCSF刺激组(BCSF 1、3、7、12 d组)。正常对照组加入正常脑脊液,BCSF各刺激组加入BCSF,共培养3 d后将这两组细胞分别接种于96孔板(细胞密度为1×104/孔)。将空孔设置为空白对照;仅加相应脑脊液而无细胞孔为阴性对照。均设3个复孔。
1.3 MTT法测定BCSF对BMECs增殖的影响各组完成相应干预培养后,加入5 mg/mL MTT(20 μL/孔)。于37℃孵育4 h,加150 μL DMSO孵育15 min。于490 nm酶标仪(Bio-Rad Laboratories,Inc)测定吸光度后,绘制细胞存活曲线。
1.4 细胞周期分析将密度为5×104/孔的BMECs于2 mL DMEM接种于6孔板,24 h达到70%融合,在无血清培养基中同步24 h,分为正常对照组和BCSF刺激组。孵育48 h,用细胞周期试剂盒(KeyGen Biotech Co,Ltd)检测各组1×104个细胞的DNA含量。用ModFit LT 3.2软件分析细胞周期分布,用BD FACS Calibur(BD Bioscience USA)对样品进行分析。
1.5 BCSF对BMECs中NO的影响采用还 原 烟酰胺腺嘌呤二核苷酸磷酸(NADPH)依赖性硝酸还原酶结合酸性无色试剂检测NOx、亚硝酸和硝酸的稳定代谢产物。50 μL血清样本/亚硝酸钠标准加入各组(正常对照组和BCSF刺激组)96孔微量滴定板中,于40 μL转换缓冲与硝酸还原酶及10 μL NADPH摇匀,室温孵育45 min,使硝酸盐转化为亚硝酸盐。样品中总亚硝酸盐由Griess分析测定。于540 nm测定吸光度,并从亚硝酸盐标准曲线计算样品中亚硝酸盐的总浓度[6]。
1.6 qRT-PCR及免疫荧光检测BMECs功能蛋白表达正常对照组和BCSF刺激组细胞培养24 h。按试剂盒说明书进行qRT-PCR,引物序列由SangonBiotech Co.Ltd设计并提 供:ZO-1(forward:5’-AGTGCC⁃GCCTCCTGAGTTTG-3’,reverse:5’-CCATCCT⁃CATCTTCATCATCTTCTACAG-3’),VCAM-1(forward:5’-GAGGATGGAAGATTCTGGAATT⁃TACG-3’,reverse:5’-ATCACTAGAGCAGGT⁃CATGTTCAC-3’),ICAM-1(forward:5’-GCCAC⁃TAACAATCACGCATAATG-3’,reverse:5’-TG⁃CTCACTGTAGTCCCTTCTG-3’),β-actin(forward:5’-CCTGGCACCCAGCACAAT-3’,reverse:5’-GGGCCGGACTCGTCATAC-3’)。
用免疫荧光法分析各功能蛋白的细胞内表达和定位。正常对照组和BCSF刺激组孵育72 h,用DMEM培养基换洗后,40 g/L多聚甲醛室温固定20 min,PBS洗涤;30 mL/L牛血清白蛋白孵育30 min,滴加一抗ICAM-1(1∶250)、VCAM-1(1∶100)和ZO-1(1∶400),4℃过夜后,加二抗Alexa 488(1∶400,2 mg/mL;Proteintech Group,CHI,USA)孵育。荧光显微镜下观察并捕捉图像。
1.7 各组外泌体检测及鉴定根据Total Exosome Isolation Kit分 离 试 剂 盒(Life Technologies,Carls⁃bad,CA)从正常对照组和BCSF刺激组的培养液中分离外泌体。将FBS液在80 000 r/min于4℃超速离心16 h,取上清液经0.22 μm滤网无菌过滤。加入相应各组,待细胞生长汇合至70%,收获外泌体。将各组培养基于2 000 g离心20 min去除细胞/碎片,收集上清液,加入0.2倍上清液体积的分离试剂,将混合液于4℃孵化30 min,4 000 r/min离心10 min后,PBS洗。用透射电镜对外泌体进行阴性染色分析。取10 μL上清液加在铜网格上1 min,65℃烘干,在加速电压80 kV的HT7700透射电子显微镜(HITA⁃CHI,Japan)下观察。图片使用了Gatan CCD(Gatan,Inc,US)软件分析。在稀释10倍后,用纳米-zs90分析仪(Malvern,Worcestershire,UK)检测到尺寸分布。
1.8 qRT-PCR检测各组外泌体中miR-630的表达用SeraMir™外泌体RNA试剂盒(System Biosci⁃ences)从正常对照组和BCSF刺激组细胞培养液中分离总micoRNA。用Taqman MicroRNA反转录试剂盒(Thermo Fisher Scientific)合成cDNA后,用Taq⁃Man Fast Advanced Master Mix进 行qRT-PCR检测。实验重复3次。应用生物系统SDS软件(Applied Biosystems,Waltham,MA)对结果分析,以2-ΔΔCt为相对表达。U6为内参。
1.9 miR-630 mimics体外干预对BMECs功能的影响使用Exo-Fect™外泌体转染试剂盒(Cat#EXFT20A-1;System Biosciences,Inc.SBI,Mountain View,CA,USA)。转染的外泌体重悬于300 μL PBS,应用ECIS系统(75 μL加入细胞密度约为5×105/孔的12孔培养板,生长于exosome-depleted的FBS),达到满意的外泌体浓度条件[7]。miR-630 mimics购自Life Technologies公司(Grand Island,NY,USA)。qRT-PCR检测转染干预后miR-630的表达。
应用Western blotting检测转染干预后各组ZO-1、ICAM-1、VCAM-1的表达。BMECs生长至50%时,暴露于转染的外泌体中,应用Mem-PER™Eukaryotic Membrane Protein Extraction Reagent(Thermo Fisher Scientific)共孵育12 h后,滴加一抗ICAM-1、VCAM-1、ZO-1(1∶2 000)和内参β-actin(1∶5 000)(Proteintech Group,CHI,USA),4℃过夜孵育进行检测。应用ECL增强系统(Millipore,America)进行成像显示。
1.10 统计学分析所有计量数据以均数±标准差表示。对服从正态分布的多重比较采用Student’st检验和nonparametric Mann-Whitney U检验。所有其他数据分析都采用统计软件GraphPad Prism,ver⁃sion 7(GraphPad,LaJolla,CA)。P<0.05为差异有统计学意义。
2 结 果
2.1 BCSF对BMECs生存能力的影响MTT实验表明,随着共孵育时间的延长BCSF使细胞活力显著降低,不同时间点与对照组差异均有统计学意义(P<0.01),而培养12 d的生长抑制率达到(78.34±9.22)%;流式细胞仪分析显示,BCSF诱导BMECs细胞周期阻滞于G0/G1期和G0/G1期的比例增加(14.32±4.28)%,G2/M期明显下降(P=0.026,图1)。
2.2 BCSF对BMECs功能的影响BCSF孵育24 h的BMECs中ICAM-1、VCAM-1和ZO-1的mRNA表达显 著 降 低(P=0.01,P=0.01,P=0.03,图2A)。免疫荧光染色结果显示,BCSF组紧密连接蛋白ZO-1和黏附分子ICAM-1、VCAM-1在细胞膜表面的表达弱(图2B)。放射免疫法检测显示,BCSF组BMECs产生NO从最初的(35.63±4.78)μmol/L到3 d时减低到(11.42±2.66)μmol/L;在3、7、12 d较对照组均显著下降(P=0.01,P=0.01,P=0.02,图2C)。
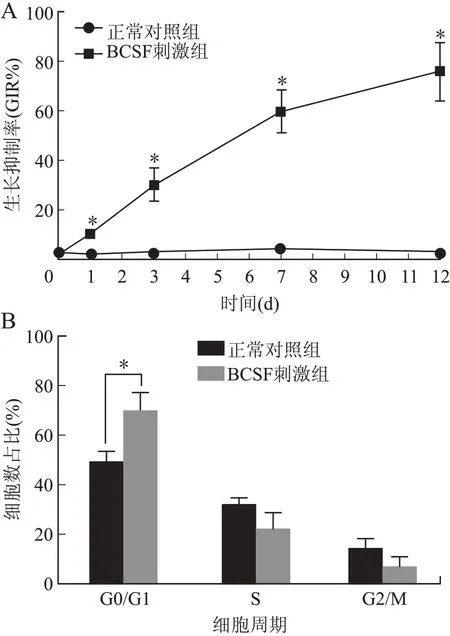
图1血性脑脊液对内皮细胞增殖的影响Fig.1 Effects of BCSF on the viability of BMECs
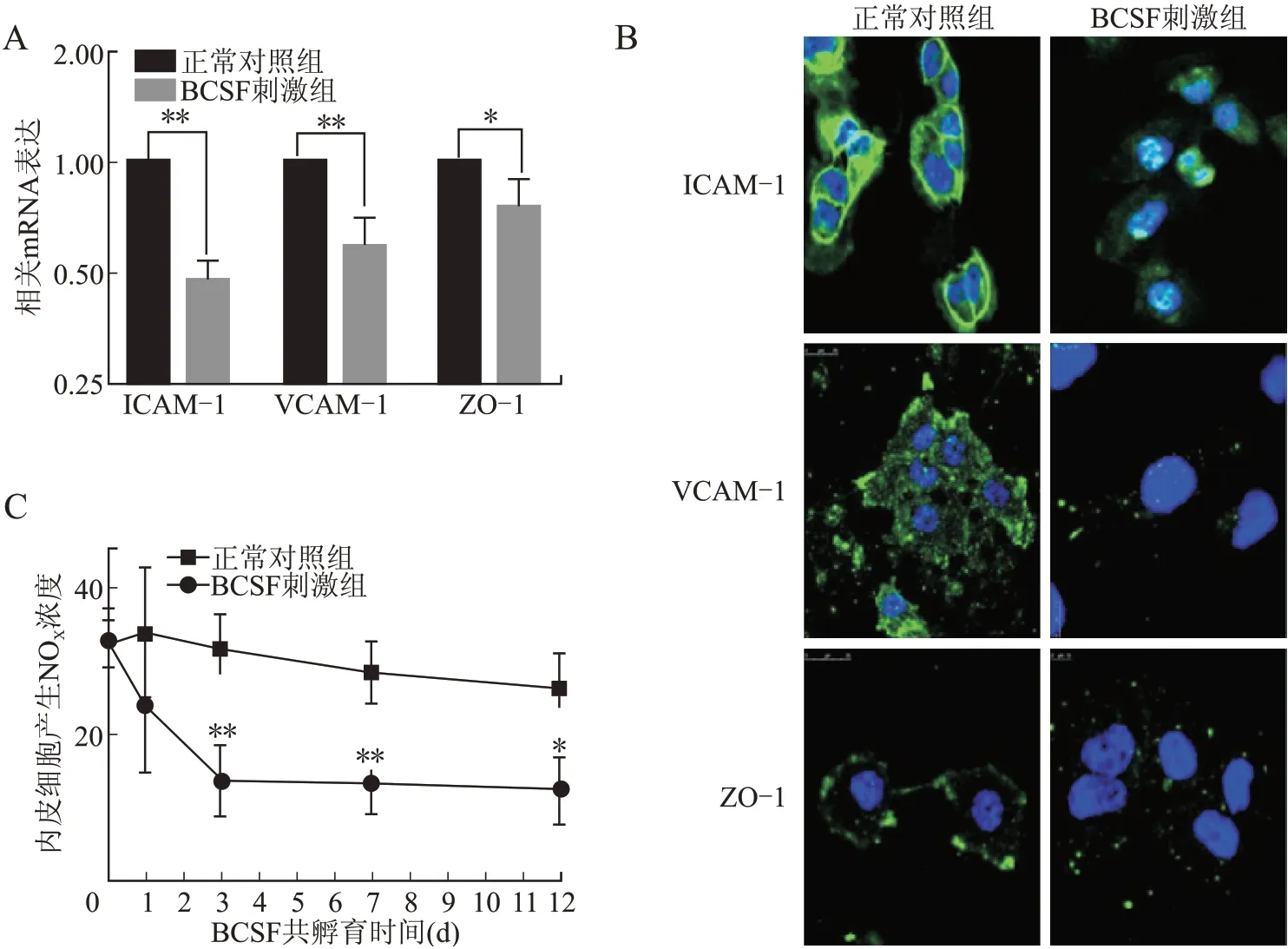
图2 BCSF对内皮细胞功能的影响Fig.2 The effect of BCSF on endothelial function
2.3 外泌体的形态学和生化特征改变透射电镜分析显示,从正常细胞培养基和BCSF处理的细胞培养基中分离出来的纳米囊泡形态均匀,呈不典型的圆形或杯状(图3A)。利用纳米zs90(Malvern)检测到nano-AE PBS水溶液的粒径分布显示,对照组与BCSF组差异无统计学意义(P=0.062),>85%所分离的外泌体粒径为20~120 nm(图3B)。
2.4 qRT-PCR检测外泌体miR-630的表达BCSF处理组外泌体miR-630表达显著降低,通过参数t检验P<0.05,经Bonferroni校正后差异有统计学意义(P=0.024,图4A)。
2.5 补充外源性miR-630 mimics对BMECs功能的影响转染的miR-630 mimics外泌体与BMECs共培养12 h,广泛清洗细胞去除细胞外泌体后,使用荧光显微镜评估其摄取情况。结果显示90%的BMECs含有绿色荧光外泌体,BMECs的胞内定位主要在细胞膜和细胞质中(图4B);与miR-630 mimics共培养的BMECs外泌体中miR-630表达显著升高(P=0.01,图4C)。Western blotting结果显示,与对照组相比,转染miR-630 mimics的BMECs共培养的趋化 因 子ICAM-1、VCAM-1和ZO-1的 表 达 增 加(图4D)。
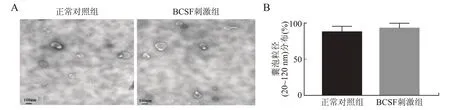
图3各组外泌体形态观察(A)及粒径比较(B)Fig.3 Morphological characterization(A)and analysis of particle size distribution(B)of the exosomes
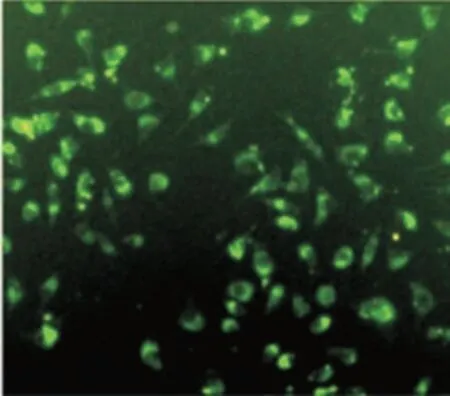
图4补充外源性miR-630 mimics对内皮功能的影响Fig.4 Effects of exosomal miR-630 mimics on the function of BMECs
3 讨 论
动脉瘤性蛛网膜下腔出血(aneurysmal subarach⁃noid hemorrhage,aSAH)是一种极具破坏性的脑卒中之一。血管痉挛被认为是迟发性脑缺血最重要的原因,但至今针对大血管的抗血管痉挛药物(如尼莫地平、ET-1拮抗剂等)仍未获得令人满意的治疗效果。近来研究认为,脑微循环破坏是严重的SAH继发事件,其潜在主要机制包括炎症、氧化应激损伤、血小板活化、长期血管收缩和内皮细胞凋亡[8]。神经血管单位在维持正常脑功能中有至关重要的作用。内皮细胞结构和功能的整体性维持着血脑屏障(blood-brain barrier,BBB)的功能,其随脑卒中进展而改变。受损的微血管内皮细胞引发一系列脑血管损伤,进而加重BMECs损伤。近期研究表明,蛛网膜下腔出血后出现了BMECs分泌舒张因子功能障碍、紧密连接发生降解、细胞因子分泌紊乱、电解质平衡紊乱等一系列病理变化[9]。而BMECs与早期脑损伤的确切关系尚不清楚。早期准确评估BMECs的损伤程度对研究蛛网膜下腔出血后早期脑损伤的机制至关重要。
外泌体是细胞外膜囊泡,为大小40~100 nm的小泡,可由多种类型细胞分泌,如T淋巴细胞、神经元和BMECs。外泌体中包含多种遗传相关分子及蛋白,影响细胞增殖、凋亡及功能。近年来研究表明,外泌体参与了多种神经系统疾病的发生发展,特别是神经功能疾病的病理机制。VIRGINTINO等[10]观察到人类脑血管系统发育过程中出现的一种奇妙现象,首次报道了脑内皮细胞外小泡(ECV)的研究结果,在免疫荧光和共聚焦显微镜下显示发芽微囊的尖端ECs与几个长而蛛丝状网(如丝状伪足)融合。2013年,一种脑内皮细胞外泌体的分离和表征方法对其特征有了更深入的了解[11]。研究认为,血脑屏障来源的ECV有不同生物信息功能,可能包含血脑屏障特异性生物标记,参与了神经血管单元内部或外部的信息交流[12]。由于脑脊液浸润中枢神经系统并与受损组织接触,脑脊液被认为是与中枢神经系统损伤相关的miRNAs表达变化的极好来源。有研究对原发性中枢神经系统淋巴瘤患者的脑脊液进行了miRNAs谱分析,发现miR-21、miR-7819b和miR-92a的下降有统计学意义[13]。有研究认为,miRNAs参与了不同类型中风的病理生理学机制[14];而有关miRNAs在出血性脑卒中发病中的作用却知之甚少。最近的一项研究表明,体外miR-630在潜在阻塞性睡眠呼吸暂停和/或肥胖儿童中是血管功能和心血管疾病风险的关键调节因子,并识别治疗靶点[15]。最近,有报道miR-630发挥多效作用,影响细胞增殖、转移和凋亡,从而在不同的细胞环境中充当癌基因或肿瘤抑制因子[16]。已被证实miR-630是一种抑制癌细胞增殖和转移的肿瘤抑制基因,在肺癌、乳腺癌和胰腺癌中诱导细胞凋亡和 死 亡[17],通 过 靶 向 癌 基 因LMO3、metadhesiin、CDC7激酶、IGF-1R发挥作用。
本研究采用FINDLAY等[5]的BCSF与微血管内皮细胞培养模型,此模型制作简单,易于成功。国内陈志等[18]也应用此方法成功建立实验性蛛网膜下腔出血后内皮细胞损伤模型。本研究选用内皮舒张因子NO的释放水平及反映血脑屏障作用的ZO-1、ICAM-1、VCAM-1为检测指标,结果显示,BCSF使BMECs中ZO-1、ICAM-1、VCAM-1表达明显降低,与以往研究相似;进而成功分离了细胞培养基的外泌体,BCSF处理组所分泌的外泌体中,miR-630表达较对照组明显降低;而应用miR-630 mimics时,BMECs的功能出现一定的恢复。这提示蛛网膜下腔出血后BMECs外泌体中miR-630的低表达可能与内皮功能下降有关。
近年来有对脑脊液的微小RNA的研究表明,出血组和正常组CSF中miR-1224-3-p和miR-1301表达明显差异,而在血管痉挛组与非血管痉挛组的miR-27a-3p、miR-516a-5-p、miR-566、miR-1197的表达明显差异[19]。而一项临床研究发现,动脉瘤破裂前后出现患者血清中miR-132-3p和324-3p的表达差异。但miRNA的具体功能尚不清楚,其细胞来源也无法确定。在SAH后的microRNA表达研究的许多实验结果有所不同[20]。研究发现,阻塞性睡眠呼吸暂停儿童循环血浆细胞外微泡miR-630与内皮功能障碍的关系。miR-630在血清外泌体中的表达可以直接反映内皮细胞在肺动脉中的功能[15]。我们前期对蛛网膜下腔出血患者CSF中miR-630的表达进行检测,发现miR-630在CSF中的表达没有明显的差异。但CSF外泌体中miR-630的表达差异具有统计学意义。推测SAH后miR-630的表达是多源的,而miR-630在中枢神经系统不同细胞中的表达是不同的。miR-630在CSF外泌体中的表达更能反映BMECs功能的调控。考虑到脑卒中过程极其复杂,治疗目标应侧重于预防保护BMECs结构和功能的完整性。虽然尚需要更多的研究明确BMECs在脑卒中发病机制中的作用,但血管内皮细胞功能的外泌体干预措施可能为脑卒中提供一种有希望的治疗方法。
本研究的不足之处:采取的BCSF与微血管内皮细胞共培养模型,在一定程度上反映了单个内皮细胞的血管舒张及细胞间连接功能,在整体血管内皮细胞功能上是有局限的;外泌体的分泌受外界影响因素较多,外泌体中miR-630的表达调节及下游调控靶点仍不清楚,仍需要临床大样本验证;研究中应用miR-630 mimics作为干预,miRNA mimics是针对miRNA的成熟体设计并合成的小片段双链miRNA,其作用与miRNA的成熟体相似。miRNA mimics通过增强内源miRNA的沉默作用,降低细胞内蛋白表达,进而调节细胞功能。但结构略有不同,所以并不等同于miRNA或 成 熟 体miRNA。SAH后CSF外 泌 体 中miR-630的表达下降是内皮细胞功能下降的结果还是原因仍需要进一步佐证。但可以肯定的是,CSF的外泌体将成为蛛网膜下腔出血病理生理机制研究的一个很有前景的方向。
