人参皂苷Rg1对幼龄大鼠缺氧缺血性脑损伤和神经元凋亡的保护作用
2021-10-14张明晓范俊利
张明晓,方 峰,杨 艳,范俊利,袁 鹏
(1.洛阳职业技术学院医学院解剖教研室,河南洛阳 471000;2.河南科技大学第一附属医院肿瘤科,河南洛阳 471000;3.天津医学高等专科学校解剖教研室,天津 300000)
缺氧缺血性脑损伤是全世界儿童神经障碍和死亡的主要病因之一,常见于足月儿和早产儿,若治疗不及时,可能会导致儿童发育迟缓、智力低下、癫痫甚至脑瘫等后遗症[1]。研究表明,缺氧缺血性脑损伤的发病机制是缺氧缺血引起脑组织谷氨酸大量释放并作用于突触后神经元谷氨酸受体,导致钙离子内流,引起细胞内钙过量产生,从而诱发脑组织损伤和神经元死亡[2]。人参皂苷Rg1是人参的主要活性成分,在心血管系统、免疫系统和神经系统中发挥重要的调控作用[3-4]。雷勋明[5]研究发现,人参皂苷Rg1能有效改善缺氧缺血性脑损伤小鼠学习能力和记忆能力。但人参皂苷Rg1在缺氧缺血性脑损伤和神经元凋亡中的作用机制研究鲜见报道。因此,本研究探索人参皂苷Rg1在缺氧缺血性脑损伤和神经元凋亡中的调控作用,初步了解人参皂苷Rg1的保护作用机制,为人参皂苷Rg1在缺氧缺血性脑损伤的临床应用提供参考。
1 材料与方法
1.1 试剂与仪器人参皂苷Rg1(纯度≥98%)购自四川维克奇生物科技有限公司(批号:wkq00470);苏木精-伊红(HE)染色试剂盒购自上海碧云天生物技术有限公司(批号:CO105S)、TUNEL染色试剂盒购自Thermo公司(批号:KHO1001)、酶联免疫吸附法(ELISA)试剂盒购自美国Sigma公司(批号:RAB0302、RAB0308、RAB0331);丙 二 醛(malondialdehyde,MDA)活性检测试剂盒(批号:GL2091)和超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(批号:BC0175)购自北京百奥莱博科技有限公司;尼氏染色液试剂盒购自北京索莱宝科技有限公司(批号:DK0022100),兔单克隆抗体Bax(EPR18283)、兔单克隆抗体Bcl-2(EPR17509)、兔抗鼠单克隆抗体cas-3(EPR18297)、兔单克隆抗体cas-9(EPR18868)以及对应的山羊抗小鼠IgG(HRP)二抗均购自美国Abcam公司。病理切片机(上海徕卡仪器有限公司,RM2016),组织摊片机(浙江金华市科迪仪器设备有限公司),光学显微镜(日本尼康,Eclipse E100),脱色摇床(Ser⁃vicebio,TSY-B),掌上离心机(Servicebio,MX-F),酶标仪(Rayto,RT-6100),移液枪(Dragon,KE0003087/KA0056573),台 式 高 速 离 心 机(DRAGONLAB,D3024R)。
1.2 实验方法
1.2.1实验分组与建模50只清洁级新生Wistar雄性大鼠(体质量10~15 g)由北京维通利华实验动物技术有限公司提供,动物生产许可证号:SCXK(京)2016-0006,使用许可证号:SYXK(京)2017-0033。实验动物使用严格遵守3R原则并经医学伦理委员会批准,伦理审批号IACUC:LYZYJSXYYXY-20190201。每只大鼠给予24 h昼夜灯光照射控制及严格、规范的卡片登记管理,24℃条件下封闭群养。将50只大鼠随机分为健康对照组、模型组(HIBD)、HIBD+10 mg/kg人参皂苷Rg1、HIBD+20 mg/kg人参皂苷Rg1、HIBD+40 mg/kg人参皂苷Rg1 5组,每组10只,参照文献[6-7]采用Rice-Vannucci法建立缺氧缺血性脑损伤模型,大鼠结扎左颈总动脉后置于80 mL/L O2、35℃封闭容器中2 h,本实验中大鼠成模率为90%。造模成功后,模型加药组参照文献[8-9]分别腹腔注射10、20、40 mg/kg的人参皂苷Rg1,健康对照组和模型组同时腹腔注射等量的生理盐水,每天1次,持续2周。待跳台试验结束后,立即采用断头法处死大鼠并取脑组织,海马脑组织和大脑皮质用40 g/L多聚甲醛固定用于染色实验,中央前回脑组织部分置于−80℃冰箱中冻存用于后续分子实验。
1.2.2跳台试验检测学习和记忆能力记录各组大鼠首次由通电铜栅找到安全台所需时间即反应时间,动物跳下圆台次数即错误次数作为学习测试成绩。24 h后直接将各组大鼠置于安全台上,同时铜栅通电,记录小鼠第一次从台上跳至铜栅的时间即潜伏时间,动物跳下圆台次数即错误次数作为记忆测试成绩,结果取平均值。
1.2.3干湿重法检测脑含水率和脑指数采用脑组织干湿重法检测脑含水率、脑指数,断头法处死大鼠,取出大脑,剥去脑膜、小脑和脑干,用0.1 mmol/L磷酸盐缓冲清洗,滤纸吸干并称取脑质量。取左脑并称取湿质量;随后置于70℃烘箱中干燥24 h,取出并称取左脑干质量,计算脑含水率、脑指数。脑含水率(%)=(左脑湿质量−左脑干质量)/左脑湿质量×100%;脑指数(%)=脑质量/体质量×100%。
1.2.4HE染色观察脑组织病理损伤断头法处死大鼠,取出大脑,40 g/L多聚甲醛固定脑组织,石蜡包埋切片;经脱蜡、水化后,行HE染色;光镜下拍照并观察记录组织形态学变化。
1.2.5TUNEL染色观察脑组织细胞凋亡断头法处死大鼠并迅速取出大脑皮质于40 g/L多聚甲醛溶液中充分固定,48 h后脱水、浸蜡、石蜡包埋;按照TUNEL染色试剂盒说明书进行染色;凋亡细胞即阳性细胞在光镜下呈棕黄色或棕褐色,非凋亡细胞即阴性细胞呈蓝色。
1.2.6尼氏染色检测神经元凋亡断头法处死大鼠并迅速取出脑组织,石蜡包埋切片,二苯甲脱蜡3次,每次10 min,依次放入无水乙醇5 min、900 mL/L乙醇2 min、700 mL/L乙醇2 min、蒸馏水2 min,尼氏染色液染色3 min,蒸馏水洗涤2次,950 mL/L乙醇5 s,950 mL/L乙醇脱水2次(2 min/次),二甲苯透明5 min,中性树胶封片,显微镜下观察,尼氏小体呈蓝紫色或深蓝色。
1.2.7Western blotting检测凋亡蛋白表达取右侧脑组织研磨均匀,用RIPA蛋白裂解液于冰上提取脑组织总蛋白,用BCA蛋白浓度测定试剂盒测定脑组织蛋白浓度,每孔上样20 μg,经SDS-PAGE电泳、转模、脱脂奶粉封闭,加入cas-3、cas-9、Bax、Bcl-2兔单克隆抗体(1∶200),4℃孵育摇床过夜。回收一抗,加入按比例稀释HRP标记的对应二抗(1∶4 000),室温孵育120 min。采用ECL化学发光法于暗室下曝光显影(ACTIN作内参)。将胶片进行扫描存档,PhotoShop整理去色,Alpha软件分享吸光度值。独立实验重复3次,取平均值。
1.2.8MDA和SOD含量检测断头法处死大鼠并取脑组织,脑组织匀浆离心取上清,采用硫代巴比妥酸比色法测定MDA含量,MDA与硫代巴比妥酸在酸性条件下煮沸缩合,生成红色化合物,此化合物在波长532 nm处有最大吸收峰,其吸光度与MDA含量呈正比;羟基法测定SOD含量,超氧阴离子自由基(O2-)能氧化羟胺形成亚硝酸盐,在显色剂的作用下呈现紫红色,在550 nm处有最大吸收峰,其吸光度与SOD活性呈反比。
1.2.9ELISA法检测外周血中IL-6、IL-4、iNOS含量 收集外周血,4℃、3 000 r/min离心25 min,收集上清液,按照E L I S A试剂盒说明书测定IL-6、iNOS和IL-4含量。
1.3 统计学处理采用SPSS 17.0软件进行数据分析。正态分布的计量资料以均数±标准差(±s)表示。多组数据比较采用方差分析,两两比较采用LSD法。P<0.05为差异有统计学意义。
2 结 果
2.1 人参皂苷Rg1对HIBD幼龄大鼠脑功能、脑含水率和脑指数的影响与健康对照组相比,模型组HIBD幼龄大鼠跳台试验犯错次数显著增多(P<0.05),脑含水率和脑指数显著升高(P<0.05);与模型组相比,10 mg/kg人参皂苷Rg1组HIBD幼龄大鼠跳台试验犯错次数、脑含水率和脑指数变化差异无统计学意义(F=2.674、2.075、3.520,P=0.182、0.195、0.127),20、40 mg/kg人参皂苷Rg1组HIBD幼龄大鼠跳台试验犯错次数、脑含水率和脑指数显著降低,差异具有统计学意义(P<0.05,图1)。结果显示,人参皂苷Rg1可改善HIBD幼龄大鼠学习和记忆能力,降低脑组织水肿。
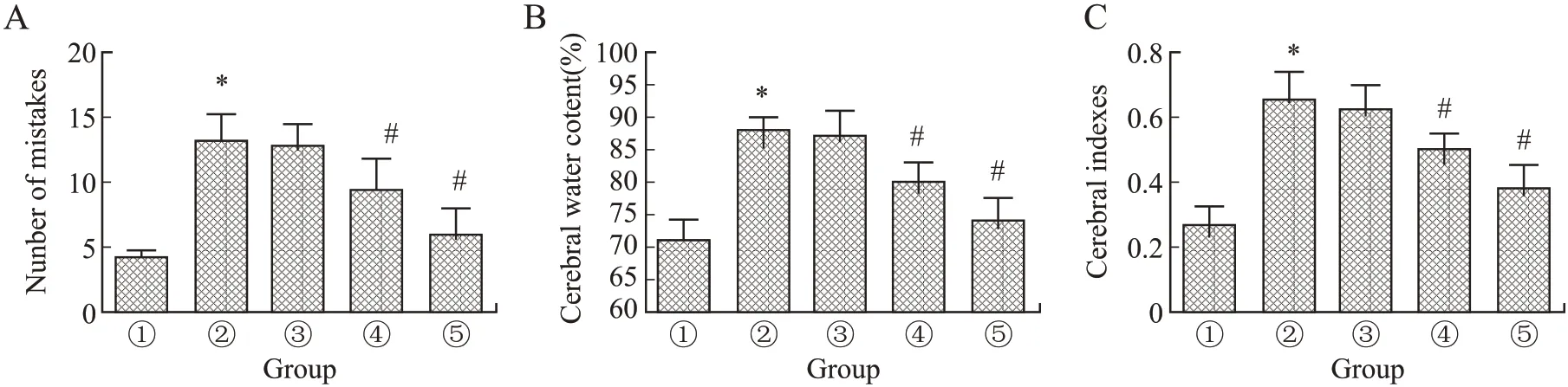
图1 人参皂苷Rg1对HIBD幼龄大鼠脑组织功能的影响Fig.1 The effect of Rg1 on brain tissue function of HIBD young mice
2.2 人参皂苷Rg1对HIBD幼龄大鼠脑组织病理损伤的影响HE染色检测脑组织病理损伤程度,结果显示,与健康对照组相比,模型组大鼠脑组织结构紊乱,可见大量细胞胞质空泡化、细胞核固缩破裂,炎性细胞浸润严重。与模型组相比,10 mg/kg人参皂苷Rg1组HIBD幼龄大鼠脑组织病理损伤程度无明显差异,20、40 mg/kg人参皂苷Rg1组HIBD幼龄大鼠脑组织中细胞胞质空泡化数、细胞核固缩破裂程度显著减少,未见炎性细胞,脑组织接近正常生理结构(图2)。结果显示,人参皂苷Rg1缓解HIBD幼龄大鼠脑组织病理损伤。

图2各组幼龄大鼠脑组织HE染色Fig.2 HE staining of brain tissue of young rats in each group(×400)
2.3 人参皂苷Rg1对HIBD幼龄大鼠脑组织细胞凋亡的影响与健康对照组相比,模型组HIBD幼龄大鼠阳性细胞数(棕黄色或棕褐色)显著增多(P<0.05)。与模型组相比,10 mg/kg人参皂苷Rg1组HIBD幼龄大鼠阳性细胞数无显著差异(F=1.601,P=0.265),20、40 mg/kg人参皂苷Rg1组幼龄大鼠阳性细胞数显著减少,差异具有统计学意义(P<0.05)。结果显示,人参皂苷Rg1可以减轻HIBD幼龄大鼠脑组织细胞凋亡(图3)。

图3各组幼龄大鼠脑组织TUNEL染色结果Fig.3 Brain tissue apoptosis of young rats in each group(×400)
2.4 人参皂苷Rg1对HIBD幼龄大鼠神经元凋亡的影响健康对照组幼龄大鼠神经元排列整齐,结构较完整,多数细胞呈圆形或椭圆形,细胞尼氏小体明显,着色清晰可见(紫蓝色或深蓝色)。与健康对照组相比,模型组神经元分布少且结构紊乱,细胞核浓缩,基本上看不见细胞尼氏小体,平均吸光度值明显减小(P<0.05)。与模型组相比,10 mg/kg人参皂苷Rg1组尼氏小体和平均吸光度值无显著差异(F=5.673、5.218,P=0.842、0.0817),20、40 mg/kg人 参 皂 苷Rg1组细胞排列逐渐整齐,细胞形态也逐渐正常,层次明显,尼氏小体明显增多,着色清晰,平均吸光度值显著增高,差异具有统计学意义(P<0.05)。结果显示,人参皂苷Rg1可以抑制HIBD幼龄大鼠神经元凋亡,缓解神经元损伤(图4)。
2.5 人参皂苷Rg1对HIBD幼龄大鼠脑组织中凋亡蛋白表达的影响与健康对照组相比,模型组HIBD幼龄大鼠脑组织高表达Bax/Bcl-2、caspase-3和caspase-9(P<0.05)。与模型组相比,10 mg/kg人参皂苷Rg1组HIBD幼龄大鼠脑组织中Bax/Bcl-2、caspase-3和caspase-9蛋白表达无显著差异(F=3.067、5.439、4.330,P=0.092、0.070、0.086),20、40 mg/kg人参皂苷Rg1组HIBD幼龄大鼠脑组织中Bax/Bcl-2、caspase-3和caspase-9蛋 白 表 达 显 著 下调,差异具有统计学意义(P<0.05,图5)。结果显示,人参皂苷Rg1可以抑制脑组织凋亡蛋白表达,减少HIBD幼龄大鼠脑组织细胞凋亡。
2.6 人参皂苷Rg1对HIBD幼龄大鼠脑组织氧化应激水平的影响与健康对照组相比,模型组大鼠脑组织中MDA含量异常升高,SOD含量减少(P<0.05)。与模型组相比,10 mg/kg人参皂苷Rg1组大鼠脑组织中MDA和SOD含量无显著差异(F=5.360、6.102,P=0.078、0.061),20、40 mg/kg人参皂苷Rg1组HIBD幼龄大鼠脑组织中MDA含量显著降低,SOD含量增高,差异具有统计学意义(P<0.05)。结果显示,人参皂苷Rg1可以抑制HIBD幼龄大鼠脑组织氧化应激,缓解脑组织损伤(图6)。
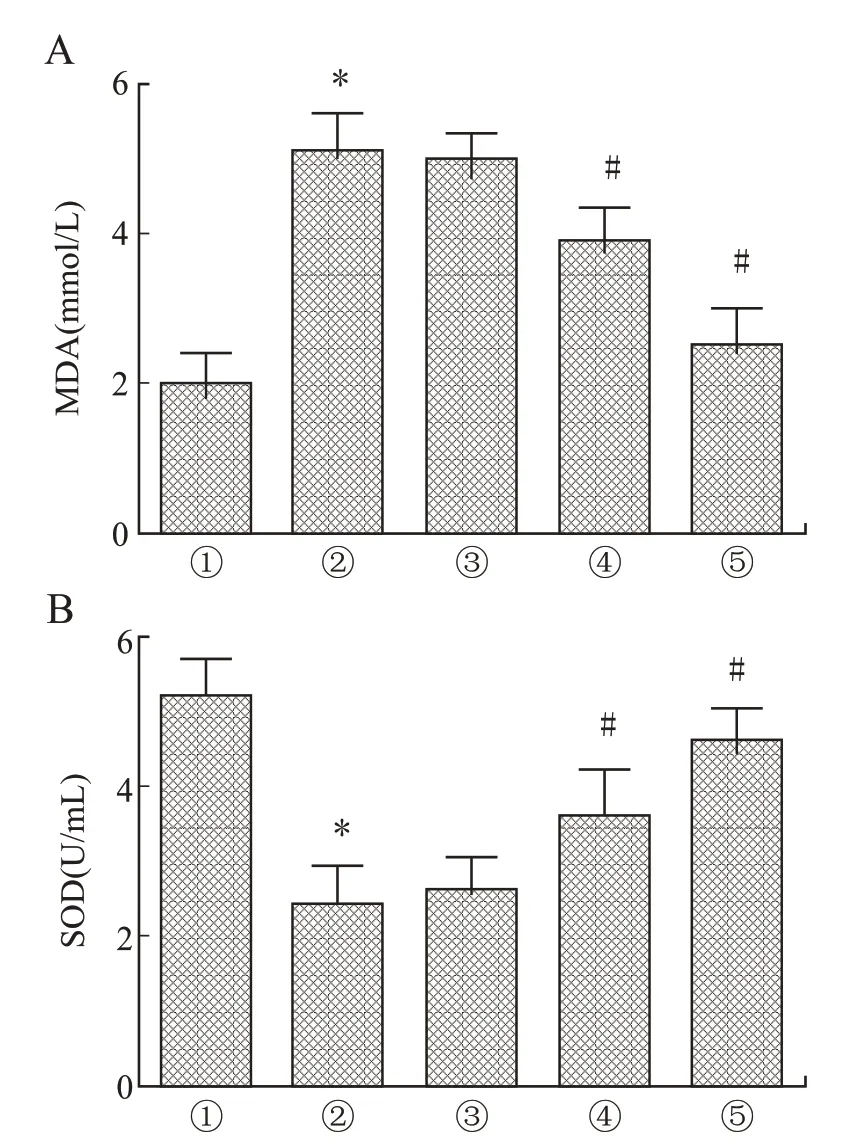
图6 各组幼龄大鼠脑组织MDA、SOD含量变化Fig.6 Changes in MDA and SOD contents in brain tissue of young rats in each group
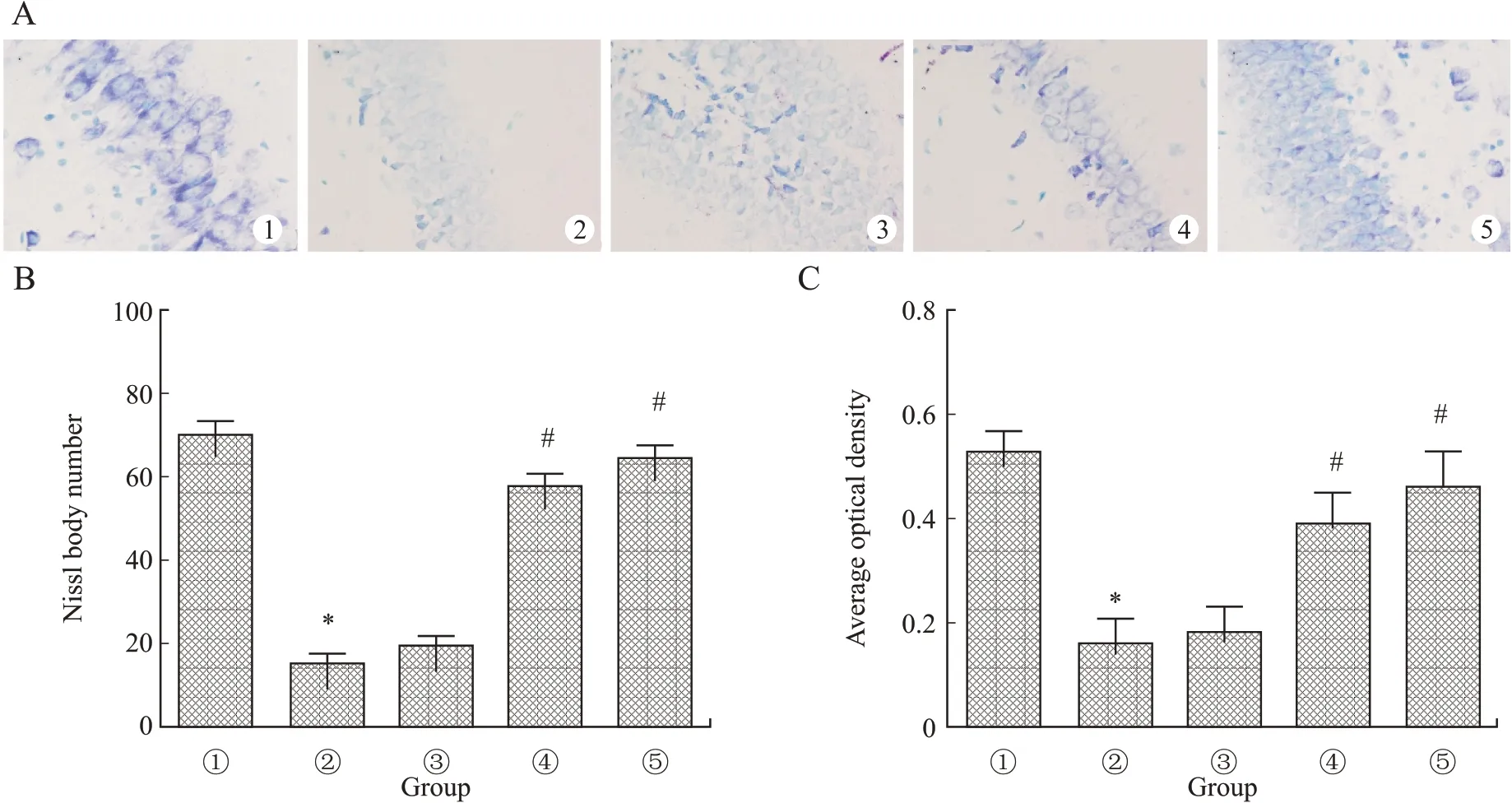
图4各组幼龄大鼠神经元尼氏染色结果Fig.4 Nissl body staining of neurons in young rats of each group(×200)
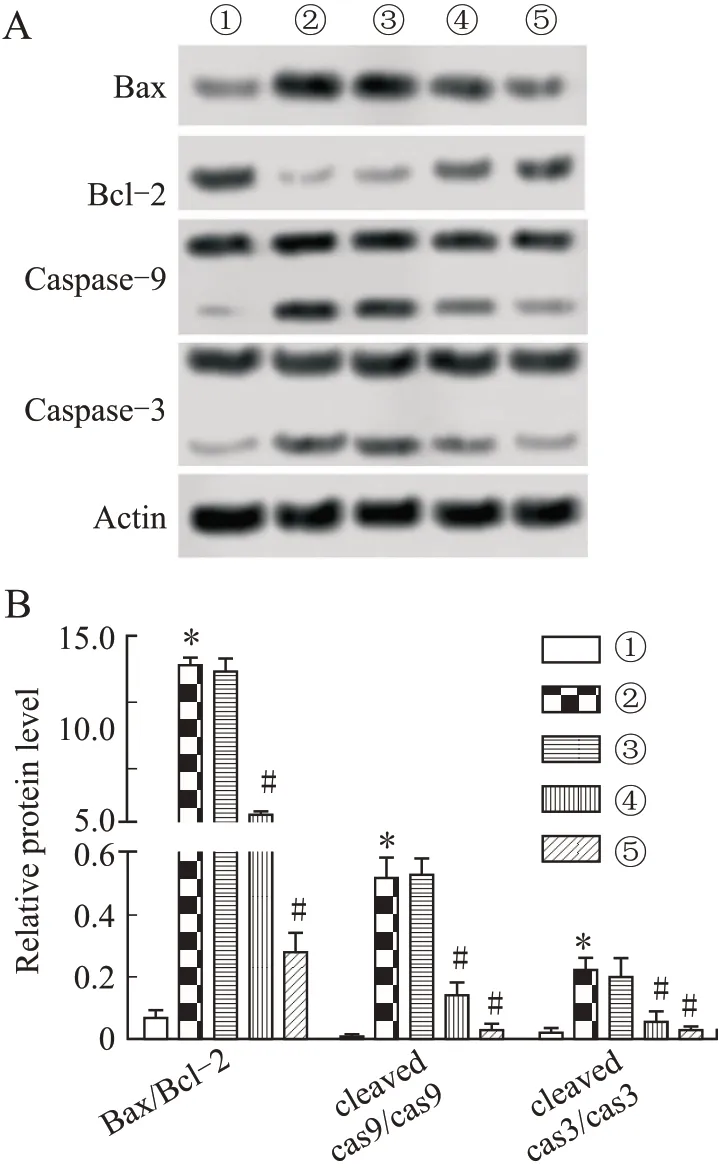
图5各组幼龄大鼠脑组织凋亡蛋白表达Fig.5 The expression level of apoptotic protein in the brain tissue of young rats in each group
2.7人参皂苷Rg1对HIBD幼龄大鼠炎症因子表达水平的影响与健康对照组相比,模型组大鼠外周血中IL-6、iNOS和IL-4含量均升高(P<0.05)。与模型组相比,10 mg/kg人参皂苷Rg1组大鼠外周血中IL-6、iNOS、IL-4含量无显著差异(F=4.802、5.750、3.011,P=0.081、0.074、0.125),20、40 mg/kg人参皂苷Ra1组大鼠外周血中IL-6和iNOS含量显著下调,IL-4含量上调,差异具有统计学意义(P<0.05)。结果显示,人参皂苷Rg1通过上调HIBD幼龄大鼠脑组织中促炎因子表达,下调抗炎因子表达,缓解脑组织损伤(图7)。

图7各组幼龄大鼠外周血中炎症因子含量Fig.7 Inflammatory factors in the peripheral blood of young rats in each group
3 讨 论
缺氧缺血性脑损伤常伴随着严重的神经元损伤,缺氧缺血性脑损伤发生时,释放大量的活性氧和活性氮,进而引起神经元退化和死亡,影响脑组织和神经元正常功能[10]。减少脑组织细胞凋亡、氧化应激和炎症反应是改善缺氧缺血性脑损伤和神经元凋亡的关键基础。文献报道,人参皂苷Rg1具有抗衰老、抗细胞凋亡、抗氧化应激和抗炎等作用[11-14],但未见人参皂苷Rg1在成年或老年大鼠缺氧缺血性脑损伤中作用的研究报道。本研究通过建立缺氧缺血性脑损伤幼鼠模型,探究人参皂苷Rg1在缺氧缺血性脑损伤幼鼠脑组织功能和神经元凋亡中的作用。
缺氧缺血性脑损伤诱发的氧化应激和炎症反应致使神经元炎性浸润,蛋白酶分泌增加,产生大量的炎症因子和氧化中间产物致使神经元损伤。缺氧缺血性脑损伤发生时,脑组织功能受损严重,大量脑组织细胞凋亡并伴随炎症反应[15-17]。已有研究表明,人参皂苷Rg1通过多种信号通路在组织损伤和多种疾病中发挥抗细胞凋亡、抗氧化应激和抗炎症等作用[18-20]。本研究结果显示,人参皂苷Rg1改善缺氧缺血性脑损伤幼龄大鼠脑组织功能,缓解脑组织损伤,抑制神经元凋亡。
Bax、Bcl-2、cas-3和cas-9是细胞凋亡重要调控因子,在缺氧缺血性脑损伤发生时,上游细胞凋亡起始蛋白cas-9诱导并活化下游细胞凋亡执行蛋白cas-3,凋亡蛋白cas-3和cas-9被异常激活,使得大脑组织产生大量的cleaved cas-3和cleaved cas-9,并进一步执行DNA裂解及细胞凋亡过程,加重脑组织损伤[21-23]。本研究结果显示,人参皂苷Rg1显著上调抗凋亡蛋白Bcl-2蛋白表达,下调促凋亡蛋白Bax、cleaved cas3和cas9蛋白表达。提示人参皂苷Rg1抑制脑组织细胞凋亡,缓解幼龄大鼠缺氧缺血性脑损伤。
MDA和SOD在线粒体氧化应激反应过程中发挥着重要作用,MDA是膜脂过氧化标志物,MDA高表达促使线粒体膜损伤,抑制三羧酸循环相关酶活性,导致机体组织功能严重受损。SOD在氧化和抗氧化平衡中起调控作用,在脑组织发生氧化应激时,SOD通过清除超氧阴离子自由基抑制脑组织氧化应激超氧化物生成,缓解因氧化应激造成的脑损伤[24-25]。本研究结果显示,经人参皂苷Rg1给药处理后,缺氧缺血性脑损伤幼龄大鼠脑组织中MDA和SOD蛋白含量明显减少。说明人参皂苷Rg1抑制缺氧缺血性脑损伤氧化应激水平,降低脑组织损伤程度。
IL-6和iNOS是炎症反应过程中重要的促炎因子,参与多种生理病理和细胞免疫过程,诱导机体发生炎症反应,在缺氧缺血性脑损伤中主导负调控作用。IL-4是由活性T细胞分泌的生长因子,在缺氧缺血性脑损伤中抑制促炎因子产生,调节脑组织免疫系统[26-27]。本研究结果显示,人参皂苷Rg1显著减少促炎因子IL-6和iNOS蛋白含量,增加IL-4蛋白含量。提示人参皂苷Rg1通过下调脑组织促炎因子蛋白表达,缓解幼龄大鼠缺氧缺血性脑损伤。
综上所述,人参皂苷Rg1通过抑制脑组织细胞凋亡、氧化应激和炎症反应在幼龄大鼠缺氧缺血性脑损伤和神经元凋亡中发挥保护作用。
