基于Cell-SELEX技术的去势抵抗性前列腺癌细胞核酸适配体的筛选与鉴定
2021-10-14仲津漫丁健科刘朵朵杨全新
仲津漫,丁健科,邓 蕾,向 颖,刘朵朵,杨全新
(1.西安交通大学第二附属医院医学影像科,陕西西安 710004;2.空军军医大学第一附属医院整形外科,陕西西安 710032)
前列腺癌是严重威胁男性健康的泌尿生殖系恶性肿瘤[1]。早期多数前列腺癌患者对雄激素剥夺治疗有效,但在历经3~5年的缓解期后,约20%的患者会由激素依赖性前列腺癌(androgen-dependent prostate cancer,ADPC)发展为去势抵抗性前列腺癌(castra⁃tion-resistant prostate cancer,CRPC)[2]。CRPC患 者极易发生骨转移,生存率较低。在前列腺癌发展为CRPC早期,如能在分子水平及早发现并给予有效治疗方案,可延缓肿瘤进展速度,延长患者生存期,提高患者终末期生活质量。
适配体是一段由短链RNA或单链DNA(singlestranded DNA,ssDNA)折叠形成的具有特定二维或三维结构的寡聚核苷酸[3]。与抗体类似,适配体能以高亲和力、高特异性结合相应靶标,此外,适配体还具有分子量小、低免疫原性、高组织渗透性、高稳定性等独特优势。适配体通过指数富集配基的系统进化技术(system⁃atic evolution of ligands by exponential enrichment,SELEX)筛选[4]。细胞SELEX(Cell-SELEX)是以完整活细胞为靶标筛选适配体,Cell-SELEX无需预先确定分子靶标就可筛选出靶向该种细胞的特异性适配体。本研究利用Cell-SELEX技术筛选特异性靶向CRPC细胞的适配体,并应用流式细胞术等一系列实验,研究所筛选的适配体对CRPC组织细胞的靶向性和亲和性,以期为CRPC的早期诊断和靶向治疗提供新方向。
1 材料与方法
1.1 主要仪器和试剂人前列腺癌细胞系LNCap(ADPC细胞系)、C4-2(CRPC细胞系)购自中国科学院上海生命科学研究所细胞库,链霉亲和素磁珠购自苏州海狸纳米科技有限公司,RPMI-1640培养基、DMEM培养基均购自Gibco公司,进口胎牛血清购自ZETA LIFE公 司,DNA Marker(DL 2000)购 自TaKaRa公司,其他试剂均为进口分装或国产分析纯试剂。
PCR仪(Bio-Rad美国),磁性分离器(西安金磁纳米生物技术有限公司),流式细胞仪(BD美国),激光共聚焦荧光显微镜(Nikon日本),荧光显微镜及照相系统(Olympus日本)。1.2 CRPC适配体筛选设计随机单链DNA文库及上、下游引物,其序列分别如下:DNA文库TGCG⁃GCAGTTGAAGCAAGGC(N40)ACGGCAGCACCAGAGAACCA;上 游 引 物5’-TGCGGCAGTT⁃GAAGCAAGGC-3’;下游引物5’-TGGTTCTCTG⁃GTGCTGCCGT-3’;上游引物的5’端用FITC标记,下游引物的5’端用生物素标记;DNA文库和引物由北京奥科鼎盛生物科技有限公司合成,采用固相亚磷酸酰胺合成法,经HPLC纯化。
分别制备ADPC细胞系LNCap和CRPC细胞系C4-2的细胞悬液,置于超声破碎仪作用60 min,所得产物作为PCR模板,行PCR扩增。以C4-2细胞基因组作为正筛选的PCR模板,以LNCap细胞基因组作为负筛选的PCR模板,将每一轮次筛选得到的DNA产物为模板进行PCR扩增、纯化。用生物素-链霉亲和素磁珠分离法将PCR产物分离后所获得的产物用于下一轮次的筛选,共扩增14个循环。用流式细胞仪监测Cell-SELEX筛选进程。
1.3 CRPC适配体的鉴定将最后一轮次筛选所得的DNA产物行PCR扩增纯化,PCR产物与pTOPO载体连接,然后转化至大肠杆菌感受态DH5a中进行扩增。随机挑取60个单克隆,分别置于LB培养基中培养12 h后行菌液PCR。PCR产物经核酸凝胶电泳鉴定。将出现明显目的条带的菌液样品送北京奥科鼎盛生物科技有限公司进行DNA测序。用mfold预测目的DNA及核酸适配体的二级结构。
采用单点吸附测定法获得适配体的平衡解离常数。以流式细胞术荧光几何平均值为纵坐标,以适配体浓度为横坐标,根据公式Y=Bmax×X/(Kd+X)方程模拟曲线,分别计算所筛选适配体CRPC-1和CRPC-2的平衡解离常数。
1.4 检测筛选出的适配体特异性靶向CRPC细胞的能力
1.4.1流式细胞术常规培养人前列腺癌细胞系LNCap和C4-2。取对数生长期的前列腺癌细胞,用胰酶消化,800 r/min离心5 min,弃上清,加入流式洗液重悬细胞,1 000 r/min离心5 min,胎牛血清封闭30 min,加入200 pmol FITC标记的适配体CRPC-1/CRPC-2溶液,充分重悬细胞,置于冰上孵育30 min,用流式细胞仪检测各细胞系分别与所筛选适配体的特异性结合情况。
1.4.2细胞免疫荧光检测同样取对数生长期的前列腺癌细胞LNCap和C4-2,分别接种于20 mm激光共聚焦培养皿中,置于细胞培养箱中培养,待细胞完全伸展并生长至培养皿底面积约75%时,吸弃上清液,PBS洗涤,向培养皿中加入40 g/L多聚甲醛固定15 min,50 g/L BSA室温封闭1 h,用PBS洗涤后加入200 pmol FITC标记的适配体CRPC-1/CRPC-2溶液,置于4℃避光孵育6~8 h,加入DAPI(1∶1 000)孵育5 min衬染细胞核,封片后置于激光共聚焦荧光显微镜下,观察各细胞的荧光显示比例。
1.5 检测适配体CRPC-1对CRPC组织特异性结合的能力收集临床确诊的良性前列腺增生、早期前列腺癌及CRPC患者各2例,取各组患者病理组织浸泡于40 g/L多聚甲醛固定后,石蜡包埋组织块,制作4 μm厚切片。经抗原修复后,滴加适量50 g/L BSA完全覆盖切片组织,室温封闭1 h,然后滴加标记FITC荧光基团的适配体CRPC-1溶液,4℃避光孵育过夜;加入适量DAPI(1∶1 000)室温孵育5 min衬染细胞核,封片后置于激光共聚焦荧光显微镜下,观察3种前列腺病理组织的荧光显示比例。
2 结 果
2.1 CRPC适配体的筛选情况利用Cell-SELEX技术从随机单链DNA文库中筛选与C4-2细胞特异性结合,而不与LNCap细胞结合的DNA序列,共筛选14轮;对每一轮筛选得到的DNA产物行流式细胞术检测,观察DNA产物与靶细胞特异性结合的相对荧光强度与相对细胞计数的结果显示,随着筛选次数的增加,DNA产物与C4-2细胞结合的荧光强度呈逐渐增强趋势,而与LNCap细胞结合的荧光强度始终较低;相对荧光强度量化结果显示荧光强度差异有统计学意义(图1)。

图1 CRPC特异性适配体Cell-SELEX的筛选Fig.1 The selection process of CRPC aptamer generation by Cell-SELEX
2.2 CRPC适配体的鉴定结果将经过14轮次筛选后所得的DNA产物进行PCR扩增、连接、转化并随机挑取60个单克隆行菌液PCR及电泳鉴定,将出现明显目的条带的样本送公司测序,去除未检出、非单克隆序列、同源性序列,余下序列送上海生工生物工程有限公司合成,最后经非变性核酸凝胶电泳鉴定,选取两条序列作为目的适配体,分别命名为CRPC-1和CRPC-2,其序列及预测的二级结构示意图如图2所示。计算所筛选适配体的解离常数,分别为CRPC-1的解离常数为(4.9±1.6)nmol/L,CRPC-2的解离常数为(33.26±4.1)nmol/L(图3)。
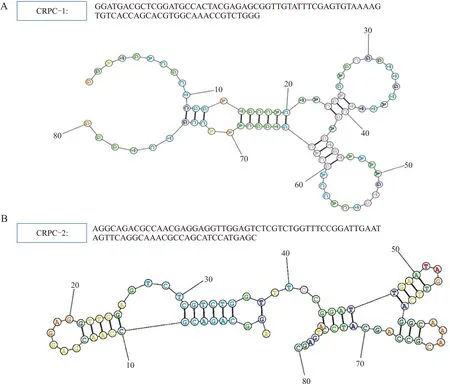
图2 Cell-SELEX筛选所获得的核酸适配体CRPC-1(A)和CRPC-2(B)的序列及二级结构示意图Fig.2 Sequence and secondary structure prediction of aptamer CRPC-1(A)and CRPC-2(B)selected by Cell-SELEX
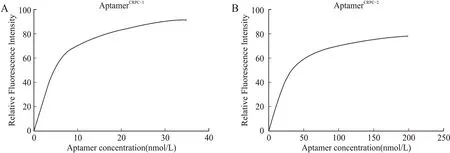
图3 Cell-SELEX筛选所获得的核酸适配体CRPC-1(A)和CRPC-2(B)的的解离常数Fig.3 Dissociation constants of aptamer CRPC-1(A)and CRPC-2(B)selected by Cell-SELEX
2.3 检测适配体对CRPC细胞特异性结合的能力
2.3.1流式细胞术检测结果显示,FITC标记的适配体特异性靶向前列腺癌细胞的CRPC-1和CRPC-2均可以与C4-2细胞特异性结合,结合荧光强度较高,而不能结合LNCap细胞;作为对照的随机DNA文库,对2种细胞均不能结合;相对荧光强度量化结果显示,荧光强度组间差异有统计学意义(图4)。这提示筛选出的两条适配体对CRPC细胞具有良好的靶向亲和性。
2.3.2细胞免疫荧光将FITC标记的适配体CRPC-1和CRPC-2分别与LNCap和C4-2细胞共孵育的激光共聚焦荧光显微镜下的观察结果显示,C4-2细胞表面可见明显的荧光标记,而LNCap细胞表面未见特异性荧光显示(图5),表明筛选出的2个适配体均能特异性结合CRPC细胞。
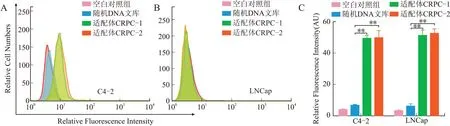
图4流式细胞术检测核酸适配体CRPC-1、CRPC-2对CRPC细胞的靶向亲和性Fig.4 Binding affinity of aptamer CRPC-1 and CRPC-2 to CRPC cell lines detected by flow cytometry
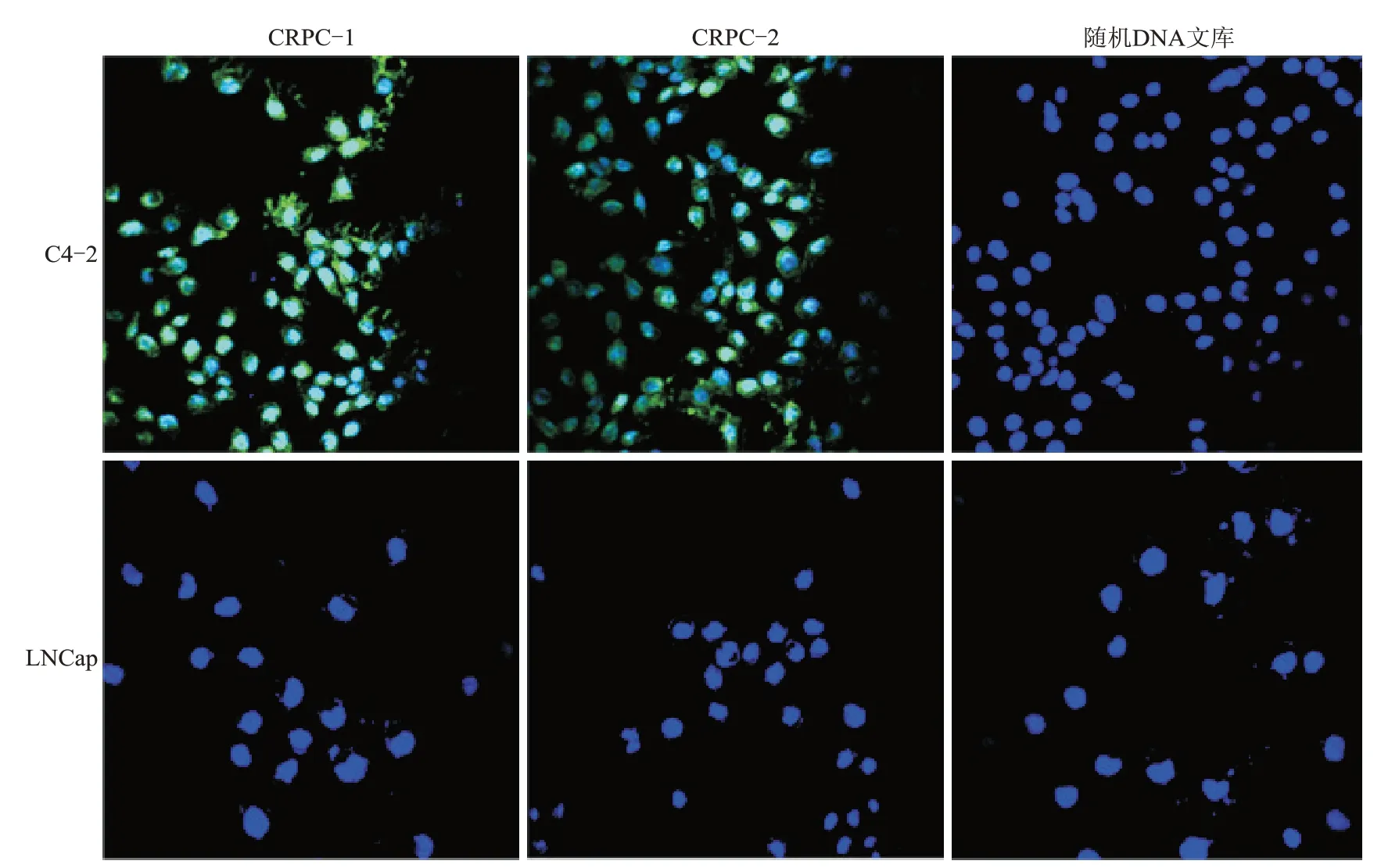
图5细胞免疫荧光实验检测核酸适配体CRPC-1、CRPC-2对CRPC细胞的靶向亲和性Fig.5 Binding affinity of aptamer CRPC-1 and CRPC-2 to CRPC cell lines detected by immunofluorescence assay
2.4 检测适配体CRPC-1对CRPC组织特异性结合的能力对3种前列腺病理组织的免疫荧光染色的分析发现适配体CRPC-1能使CRPC组织特异性染色,而对良性前列腺增生组织及早期前列腺癌组织染色不明显(图6)。提示筛选出的适配体CRPC-1能特异性识别并结合CRPC组织。
3 讨 论
最新数据表明,前列腺癌居全球男性癌症发病率第三位,死亡率第五位,严重影响了男性的生命健康[5]。雄激素剥夺治疗是目前前列腺癌治疗的标准方法,其对于减少肿瘤负荷、降低前列腺特异性抗原(prostate-specific antigen,PSA)水平具有重要意义[6]。但雄激素剥夺治疗不能治愈前列腺癌,多数进展期前列腺癌最终都会发展为CRPC[7]。
欧洲泌尿外科协会将CRPC定义为去势后血清睾酮水平<50 ng/dL并且合并三项之一的(生化进展:1周内连续3次PSA升高并且PSA>2 ng/mL;或者影像学进展出现新的转移灶;或者患者症状进展恶化[2])。尽管体外细胞实验可以明确鉴别激素依赖性与激素非依赖性前列腺癌细胞,但在体内难以实现CRPC的早期发现与诊断。多数CRPC患者在确诊时已有明显症状或出现生化进展。由于发现时间晚,这类患者极易产生耐药性,病情进展快、死亡率高[8-9]。因此,从细胞分子水平早期诊断CRPC对于及时调整临床用药、改善前列腺癌患者预后、提高患者生存质量至关重要。

图6组织免疫荧光实验检测核酸适配体CRPC-1的CRPC组织特异性Fig.6 Binding affinity of aptamer CRPC-1 to CRPC tissues detected by immunohistofluorescence assay
肿瘤在进展过程中伴随的基因或蛋白的变异使得癌变细胞与正常细胞或其他肿瘤细胞之间存在分子水平上的差异,这些差异正是SELEX技术筛选适配体的分子基础。传统的SELEX需要预先选定相应靶标才能进一步行适配体筛选,而Cell-SELEX不需要准确了解细胞表面的分子及其结构信息,可以在未知标志物的情况下用完整的活细胞作为靶标获取高特异性、高亲和性的适配体[4,10]。因此,Cell-SELEX技术在疾病的早期诊断和靶向治疗中极具应用前景。目前,国内外已有学者利用Cell-SELEX成功筛选出源于肝细胞癌、小细胞肺癌以及结直肠癌细胞的适配体[11-15],为后续相关肿瘤特异性诊疗方案的研究奠定了实验基础。
当前,尚未见CRPC特异性分子靶点的报道,以CRPC特异性分子为靶点筛选CRPC适配体的方法难以实现。本课题利用Cell-SELEX技术,以激素非依赖性前列腺癌细胞C4-2为靶细胞,以其同源激素依赖性前列腺癌细胞LNCap为负筛细胞,从随机单链DNA文库中筛选出可特异性结合CRPC细胞而不结合ADPC细胞的适配体,即特异性靶向CRPC细胞的适配体CRPC-1和CRPC-2,并经一系列实验研究证实CRPC-1和CRPC-2均能特异性结合CRPC组织细胞,而不与ADPC组织细胞结合。本研究证实这两种适配体对CRPC组织细胞具有良好的靶向性和亲和性,有望在分子细胞学水平将ADPC与CRPC相鉴别,进而早期识别CRPC状态,并为早期筛查CRPC提供了新思路和理论依据,为CRPC的早期诊断和靶向治疗提供新方法,对及时调整前列腺癌治疗方案、延缓肿瘤进展速度、改善患者预后具有重要意义。
