黄连素联合吉西他滨对胰腺癌PANC-1细胞增殖及凋亡的影响*
2021-10-14宋春灼李想李俊俊刘猛付立跃朱海涛
宋春灼, 李想, 李俊俊, 刘猛, 付立跃, 朱海涛*
(1.贵州医科大学附属医院 肝胆外科, 贵州 贵阳 550004; 2.贵州医科大学 临床医学院, 贵州 贵阳 550004)
胰腺癌是一种恶性程度极高的肿瘤,患者的5年生存率低于5%[1-2]。胰腺癌患者的预后差的原因部分归因于局部肿瘤侵袭和远处转移、肿瘤的极端耐药等[3]。吉西他滨(gemcitabine,GEM)是目前胰腺癌化疗“金标准”中的首选药物之一[4], 但晚期胰腺癌患者在治疗过程中极易对GEM产生耐药,单用GEM在临床治疗中的效果并不理想,患者的中位生存期仅约4~6个月[5-6]。因此,寻找新的药物联合GEM应用在胰腺癌的临床治疗中非常重要。近年来,随着对中药研究的不断加深,已发现大黄素、苦参碱等对胰腺癌具有抗肿瘤作用[7-8]。黄连素(berberine,BBR)又名小柴碱,是从黄连、黄柏等植物中提取的一种药用价值很高的化合物,具有抗炎、降脂、降糖以及抗氧化等多种药理作用[9-12];有报道黄连素被用于肺癌、胃癌、大肠癌等多种恶性肿瘤中,且具有抗肿瘤作用[13-15],张劲等[16]研究表明黄连素通过增加Caspase-3表达促进胰腺癌细胞的凋亡。因此,本研究将BBR以及BBR联合GEM作用于胰腺癌PANC-1细胞,观察两种用药方式在体外对胰腺癌细胞增殖和凋亡的影响。
1 材料与方法
1.1 实验材料
1.1.1细胞株 人胰腺癌细胞株PANC-1购自中国科学院干细胞库。
1.1.2主要试剂及仪器 GEM(美国Selleck Chemicals公司)、BBR(美国Sigma公司)、DMEM高糖培养基、0.25%胰酶溶液(美国Gibco公司)、胎牛血清(以色列Biological Industries公司)、二甲基亚砜(dimethyl sulfoxide, DMSO,美国Hycione公司)、CCK-8细胞毒性试剂盒(上海Dojido)、细胞裂解液、4%多聚甲醛、0.01%结晶紫(广州Affinity);兔抗人甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体、兔抗人B细胞白血病/淋巴瘤2凋亡调节因子(Bcl-2)单克隆抗体、兔抗人B淋巴细胞瘤-2相关蛋白X(BAX)单克隆抗体(武汉Proteintech Group)、山羊抗兔二抗(武汉Boster),371型恒温细胞培养箱、多功能酶标仪(美国Thermo)。
1.2 实验方法
1.2.1细胞培养及药物配置 人胰腺癌PANC-1细胞在含10% FBS的DMEM高糖培养基中培养,于 37 ℃、5% CO2的恒温培养箱中,细胞融合度达90% 时进行传代处理,取对数生长期的细胞进行后续实验。BBR和GEM均用 DMSO 配制成 10 mol/L的母液放置于-20 ℃冰箱中储存,用时以DMEN高糖培养基稀释成各个浓度的工作液使用。
1.2.2筛选最佳药物浓度 取对数生长期的PANC-1细胞,用胰酶消化制备细胞悬液并计数;于96孔板中每孔种植 5×103个细胞,每组5个复孔,另设一组只加DMEM高糖培养基作为调零组。待细胞贴壁后,将细胞分为对照1组(未处理)、12.5 μmol/L BBR组、25.0 μmol/L BBR组以及50.0 μmol/L BBR组,48 h后吸去培养基,向每孔中加入配置好的含CCK-8的溶液110 μL(DMEM培养基 ∶CCK-8溶液=100 ∶10),在培养箱中继续孵育2 h后,于酶标仪450 nm波长下读取各孔吸光度值(optical density,OD值),并计算各组细胞的抑制率及药物对细胞的半数抑制浓度(IC50)。细胞抑制率(%)=[(对照组OD值-实验组OD值) / (对照组OD值-调零组OD值) ]×100%,药物对PANC-1细胞的IC50是在GraphPad 8.3软件中通过药物各浓度对细胞的抑制率构建非线性回归函数公式得出。在研究GEM单药作用时,细胞贴壁后,以0.0、0.1、1.0、10.0和100.0 μmol/L的GEM处理细胞48 h,后续操作同黄连素单药应用。在研究BBR联合GEM作用时,根据BBR药物对PANC-1细胞的IC50,选取25.0 μmol/L BBR进行联合用药实验;细胞贴壁后,以0.0、0.1、1.0、10.0和100.0 μmol/L GEM联合25.0 μmol/L BBR处理细胞48 h,后续操作同上。应用金氏计算公式计算药物协同指数(q值),q=EA+B/[EA+(1-EA)×EB],其中EA、EB分别表示A药物和B药物单独使用时对细胞的抑制率,EA+B表示A药物和B药物联合使用时对细胞的抑制率。q>1.15时表示药物存在协同效应。根据计算的q值选择协同抑制效果最佳的药物浓度组合进行后续实验。
1.2.3分组 根据GEM和BBR对PANC-1细胞的IC50值以及各药物浓度组合的q值,将细胞分为对照2组(未处理)、GEM组(1.0 μmol/L GEM)、BBR组(25.0 μmol/L BBR)以及联合组(25.0 μmol/L BBR联合1.0 μmol/L GEM)。
1.3 观察指标
1.3.1细胞克隆形成数 取对数生长期的 PANC-1 细胞,胰酶消化制备细胞悬液并计数,在 6孔板中每孔种值1×103个细胞;细胞贴壁之后,按上述分组处理PANC-1细胞,待 12 d后吸去皿里的培养基,用4%的多聚甲醛固定30 min,结晶紫染色30 min,烘干,拍照并计算各组细胞的克隆数。
1.3.2Bcl-2和BAX蛋白表达 收集各组细胞,用含苯甲基磺酰氟(phenylmethylsulfonyl fluoride, PMSF)蛋白酶抑制剂的细胞蛋白裂解液裂解30 min,超声破碎10 s,以12 000 r/min在4 ℃下离心10 min,收集上清蛋白液;在蛋白液中加适量 5×loading buff在100 ℃下变性10 min;取50 μg 蛋白上样,用10%的丙烯酰胺凝胶经100 V恒定电压电泳2 h、250 mA 恒定电流转膜90 min至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,用含5%的脱脂奶粉在常温下封闭 2 h;分别加入稀释度为 1 ∶1 000 的Bcl-2、BAX和GAPDH一抗,4 ℃过夜后,洗涤缓冲液(tris buffered saline tween,TBST)洗涤 3 次,加入稀释度为1 ∶5 000 二抗室温孵育 2 h,滴加高敏曝光液在 Bio-rad成像系统中曝光。
1.4 统计学分析

2 结果
2.1 最佳药物浓度
CCK-8结果显示,BBR在PANC-1细胞中的IC50为39.92 μmol/L(图1A),GEM对PANC-1细胞IC50为29.07 μmol/L;25.0 μmol/L BBR联合不同浓度GEM作用时,其对PANC-1细胞IC50为1.604 μmol/L。通过金氏公式计算得出,25.0 μmol/L BBR联合GEM(0.1、1、10、100 μmol/L)共同作用时,q值分别为1.08、1.42、1.26、1.18,见图1B。其中,25.0 μmol/L BBR联合1.0 μmol/L GEM作用时协同抑制效果最佳,此联合浓度用于后续研究。
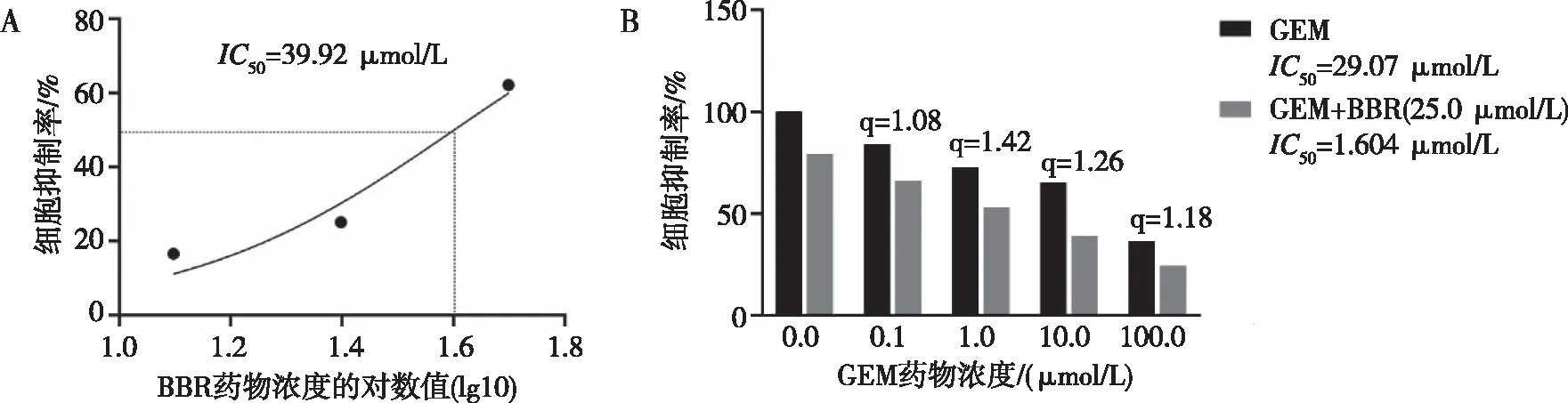
注:A为BBR单药对细胞的抑制率,B为GEM单药或联合BBR对细胞的抑制率。
2.2 克隆形成数
克隆形成数研究结果显示,与对照组相比,随着BBR浓度增加,细胞克隆数形成逐渐减少,差异有统计学意义(P<0.05),见图2A、图2B。与对照组相比,GEM组、BBR组和联合组的PANC-1细胞克隆形成数均减少,且联合组细胞克隆形成减少较GEM组和BBR组更明显,差异有统计学意义(P<0.05),见图2C、图2D。
2.3 PANC-1细胞中Bcl-2和BAX蛋白表达
与对照组相比,随着BBR浓度的增加,Bcl-2表达逐渐降低, BAX表达逐渐增加(P<0.05),见图3A~图3C。与对照组相比,GEM组、BBR组和联合组细胞中Bcl-2表达降低,BAX表达增加,且联合组细胞中Bcl-2蛋白表达降低及BAX蛋白表达增加较GEM组和BBR组均更明显(P<0.05),见图3D~图3F。

注:A为不同浓度BBR处理的细胞蛋白结果,B为Bcl-2相对表达量,C为BAX相对表达量,D为BBR、GEM及联合用药处理的细胞蛋白结果,E为Bcl-2相对表达量,F为BAX相对表达量;(1)与对照1组或2组比较,P<0.05;(2)与联合组比较,P<0.05。
3 讨论
对于不能进行手术切除治疗的晚期胰腺癌患者,化疗发挥了极其重要的作用。GEM作为目前晚期胰腺癌治疗的一线化疗药物,主要作用于细胞分裂的G1/S期,通过抑制DNA合成、修复及诱导细胞凋亡而发挥抗肿瘤的作用[17-19]。然而,胰腺癌的发展是一个建立在遗传和表观改变基础上的多步骤过程,随着疾病不断发展,晚期胰腺癌患者即使采用全身性支持治疗,效果仍不理想,且患者在治疗后期可能会出现对GEM耐药的情况[20]。因此,目前临床治疗晚期胰腺癌患者的主要策略是将GEM与其他细胞毒性药物或靶向药物联用,以降低患者对GEM耐药的发生[21-23]。这意味着寻找一种或多种新的药物联合GEM应用尤为重要。
BBR在多种恶性肿瘤中发挥抗肿瘤作用,其抗肿瘤机制包括调节细胞自噬、调控细胞周期、抑制细胞增殖及增强药物敏感性等[24]。在本实验中,重点研究应用BBR单药以及联合GEM应用对胰腺癌细胞增殖及凋亡的影响,用不同浓度BBR(12.5、25.0、50.0 μmol/L)在体外作用于人胰腺癌PANC-1细胞,CCK-8、克隆形成等实验结果表明BBR能抑制胰腺癌细胞增殖,且抑制细胞增殖的能力与剂量呈依赖关系;接下来,本实验还探究了在胰腺癌中BBR与GEM联用的可能性,通过计算BBR单药应用在PANC-1细胞中的IC50值,选取25.0 μmol/L BBR与不同浓度GEM联合应用,并通过金氏公式计算得出,25.0 μmol/L BBR联合GEM(1.0、10.0、100.0 μmol/L)时均发挥协同作用抑制胰腺癌细胞增殖,且在25.0 μmol/L BBR联合1.0 μmol/L GEM时协同作用最佳。
细胞凋亡是细胞的程序性死亡过程,主要受以Bcl-2家族和caspase3家族为主的多基因调控[25-26]。Bcl-2 和BAX是Bcl-2家族的成员,主要通过改变线粒体膜上电位,释放下游相关促凋亡因子,促发caspase级联反应,从而诱导细胞凋亡[27-28]。课题组前期研究发现,GEM能通过上调BAX蛋白表达促进胰腺癌细胞凋亡[29]。李舒等[30]研究表明,BBR能通过下调Bcl-2及上调BAX蛋白表达促进人胃癌细胞SGC7901的凋亡。因此,本研究检测不同处理组PANC-1细胞中Bcl-2及BAX蛋白表达情况,结果表明,BBR联合GEM能显著下调细胞中Bcl-2蛋白表达及上调BAX蛋白表达,提示BBR联合GEM作用可以通过调节细胞中Bcl-2及BAX蛋白表达,从而诱导胰腺癌细胞发生凋亡。
综上所述,BBR能抑制胰腺癌PANC-1细胞增殖并促进凋亡,且与GEM联用能发挥协同作用,能增强GEM单药应用的敏感性,使抑制细胞增殖和诱发细胞凋亡的能力增强。BBR有望成为GEM治疗胰腺癌的有效联合药物之一。
