HMGB1调控TLR4/MyD88/NF-κB通路对胃癌侵袭及转移的影响*
2021-10-14吴琦王洪伟郑慧哲于建渤王红艳于微于泽宇郭素芬
吴琦, 王洪伟, 郑慧哲, 于建渤, 王红艳, 于微, 于泽宇, 郭素芬**
(1.牡丹江医学院附属红旗医院 病理诊断中心, 黑龙江 牡丹江 157000; 2.牡丹江市第二人民医院, 黑龙江 牡丹江 157000; 3.牡丹江市康安医院, 黑龙江 牡丹江 157000; 4.牡丹江医学院, 黑龙江 牡丹江 157000)
胃癌(gastric cancer, GC)是消化系统最常见的恶性肿瘤之一[1],由于缺乏明显的症状和筛查方案,大多数患者在首次诊断时就发现为晚期GC[2],且通常预后不良[3]。GC的侵袭转移是导致GC患者死亡及预后不良的主要因素[4]。高迁移率族蛋白B1(high mobility group box 1, HMGB1)被报道参与调控多种肿瘤的侵袭与转移[5-6],另有研究报道toll样受体4(toll-like receptor 4, TLR4)/骨髓分化因子88(myeloid differentiation factor 88, MyD88)/核转录因κB(nuclear factor kappa B, NF-κB)信号通路在介导炎症及肿瘤的恶性行为中发挥着重要作用[7-8]。HMGB1能否通过TLR4/MyD88/NF-κB通路对GC的恶性行为产生影响,目前尚未见相关报道,故本研究通过基因干扰技术干扰HMGB1在GC细胞中的表达,并检测TLR4/MyD88/NF-κB信号通路相关分子的变化及GC细胞生物学行为变化,以阐明HMGB1对GC细胞恶性行为影响的内在分子机制。
1 材料与方法
1.1 材料
1.1.1主要试剂 人胃癌细胞株MGC-803、SGC-7901、人胃上皮细胞株GES-1;DMEM培养基(Gibco,美国),胰酶、丝裂霉素C(Sigma,美国),Transwell小室(Corning,美国),Super M-MLV 反转录酶、RNase inhibitor、2×Power Taq PCR Mastermix(BioTeke,北京),SYBR Green(Solarbio,北京),全蛋白提取试剂盒、SDS-PAGE凝胶快速制备试剂盒、ECL发光液、HMGB一抗、TLR4一抗、NF-κB p65一抗、MyD88一抗、p-NF-κB p65一抗、羊抗兔IgG-HRP(wanleibio,中国),PVDF膜(Millipore,美国)。
1.1.2主要仪器 电泳仪(DYY-7C,北京六一),凝胶成像系统(WD-9413B型,北京六一),超速冷冻离心机(H-2050R,湖南湘仪),酶标仪(ELX-800,Biotek),电热恒温培养箱(DH36001B,天津泰斯特),紫外分光光度计(NANO 2000,Thermo),荧光定量PCR仪(Exicycler 96,Exicycler 96),倒置相差显微镜(IX53,OLYMPUS)。
1.2 实验方法
1.2.1细胞培养及转染 采用DMEM培养基,于37 ℃、5% CO2环境内培养,待细胞生长融合至70%左右,将细胞随机均分为3组,分别为Control组(未转染组)、HMGB1 siRNA-NC组(HMGB1 siRNA阴性对照转染组)及HMGB1 siRNA组(HMGB1 siRNA转染组);于转染后24 h收集细胞进行实时荧光定量定量(Real-time)PCR、侵袭及迁移检测,于48 h后收集细胞进行Western blot试验。
1.2.2划痕实验检测细胞迁移 将细胞接种于6孔板中,在划痕前将培养基换为无血清培养基并加入1 mg/L的丝裂霉素C处理1 h;将细胞造成细胞划痕,以无血清培养基清洗细胞1次,除去细胞碎片,显微镜下观察拍照,记下照片中细胞的位置,为后续拍照准备,并换用无血清培养基培养。将各组细胞置于37 ℃、5% CO2环境中培养24 h拍照记录。最后计算细胞的迁移距离。
1.2.3Transwell检测细胞侵袭 采用Matrigel胶原包被到小室膜上建立Transwell侵袭小室模型。将细胞培养至90%融合,以0.2%胰蛋白酶消化、并以无血清培养基制成单细胞悬液,以PBS进行10倍稀释(滴入一滴台盼蓝染料)、混匀、室温静置2 min,在下室加入含10% FBS的培养液800 μL、分别取细胞悬液200 μL(细胞数为2×104/孔)加入上室,将24孔板置于37 ℃、5% CO2、饱和湿度条件下培养24 h,之后进行固定和结晶紫染色,在倒置显微镜下对迁移至微孔膜下层的细胞计数。
1.2.4Real-time PCR检测相关基因的mRNA水平 收集需要检测总RNA的细胞并提取细胞总RNA,测定RNA的浓度后进行反转录,然后以cDNA为模板,采用目的基因的引物,按照cDNA模板1 μL、上下游引物(10 μmol/L)各0.5 μL、SYBR Green mastermix 10 μL用ddH2O补足至20 μL,进行Real-time PCR反应检测目的基因的mRNA水平,条件为94 ℃预变性 5 min,94 ℃变性10 s、60 ℃退火20 s、72 ℃ 延伸30 s,进行40个循环;按72 ℃ 2.5 min,40 ℃ 1.5 min,并从60 ℃加热到94 ℃(1.0 ℃/1 s),25 ℃ 1~2 min的条件检测扩增产物的溶解曲线,最后利用2-△△CT方法进行结果分析。HMGB1上游引物序列为GATGTTGCGAAGAAACTGGG、下游引物序列为TTCAGCCTTGACAACTCCCT,TLR4 上游引物序列为GACCTGTCCCTGAACCCTA、下游引物序列为TCTCCCAGAACCAAACGA,Myd88上游引物序列为TACAAGGCAATGAAGAAAGAGT、下游引物序列为CAAGGCGAGTCCAGAACC,NF-κB p65上游引物序列为GGGGACTACGACCTGAATG、下游引物序列为GGGCACGATTGTCAAAGAT,β-actin 上游引物序列为CTTAGTTGCGTTACACCCTTTCTTG、下游引物序列为CTGTCACCTTCACCGTTCCAGTTT。
1.2.5Western blot检测相关蛋白表达水平 提取细胞总蛋白,测定蛋白浓度后按照40 μg/孔的蛋白量上样进行SDS-PAGE电泳、转印、封闭,4 ℃过夜孵育一抗,37 ℃ 45 min孵育二抗;行ECL底物发光后,将胶片进行扫描,凝胶图像处理系统分析目标条带的光密度值。
1.3 统计学分析

2 结果
2.1 细胞迁移能力
划痕实验结果如图1A与1B,与GES-1相比较,GC细胞MGC-803与SGC-7901在培养24 h后细胞迁移能力均明显增强,差异具有统计学意义(P<0.01)。采用MGC-803进行转染实验,如图1C与1D所示,与Control组相比,HMGB1 siRNA组的迁移能力明显降低,差异具有统计学意义(P<0.01)。表明,在GC细胞中干扰HMGB1基因的表达能够降低细胞的迁移能力。
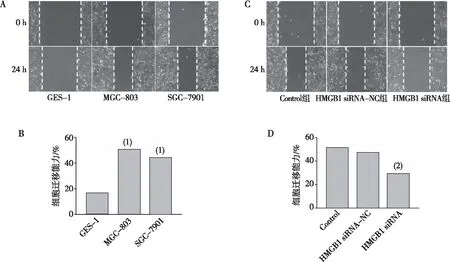
注:(1)与GES-1组相比,P<0.01;(2)与Control组比较,P<0.01。
2.2 细胞侵袭能力
Transwell侵袭实验的检测结果显示,与GES-1比较,两株GC细胞系的侵袭力均增强,差异均具有统计学意义(P<0.01)。除此之外,从图2A与2B的结果中可见,MGC-803较SGC-7901细胞的侵袭能力更强,差异具有统计学意义(P<0.01)。选择MGC-803细胞进行转染实验,结果显示,与Control组比较,HMGB1 siRNA组迁移率明显降低,差异具有统计学意义(P<0.01)。见图2C与2D。

注:(1)与GES-1组相比,P<0.01;(2)与MGC-803组相比,P<0.01;(3)与Control组比较,P<0.01。
2.3 各基因mRNA表达水平
Real-time PCR结果如图3A所示,SGC-7901及MGC-803细胞的HMGB1、TLR4、MyD88、NF-κBp65 mRNA水平均明显高于GES-1细胞,同时在MGC-803细胞的mRNA水平也较SGC-7901细胞明显升高,差异有统计学意义(P<0.01)。选取HMGB1相对高表达的MGC-803细胞进行转染实验,如图3B所示,与Control组相比,HMGB1 siRNA组TLR4、MyD88 mRNA水平均明显下调,差异有统计学意义(P<0.01)。但检测结果显示,NF-κB p65的转录水平未发生显著变化(P>0.05)。

注:与GES-1组比较,(1)P<0.01;(2)与MGC-803组比较,P<0.01;(3)与Control组比较,P<0.01。
2.4 各蛋白表达水平
2.4.1GES-1细胞、SGC-7901及MGC-803细胞 Western blot结果显示,与GES-1细胞比较,SGC-7901及MGC-803细胞中HMGB1、TLR4、MyD88及p-NF-κB p65的蛋白表达水平均明显升高,差异有统计学意义(P<0.01),NF-κB p65表达不变。同时各指标在MGC-803细胞中的蛋白表达水平较SGC-7901细胞也明显升高,差异有统计学意义(P<0.01)。见图4。
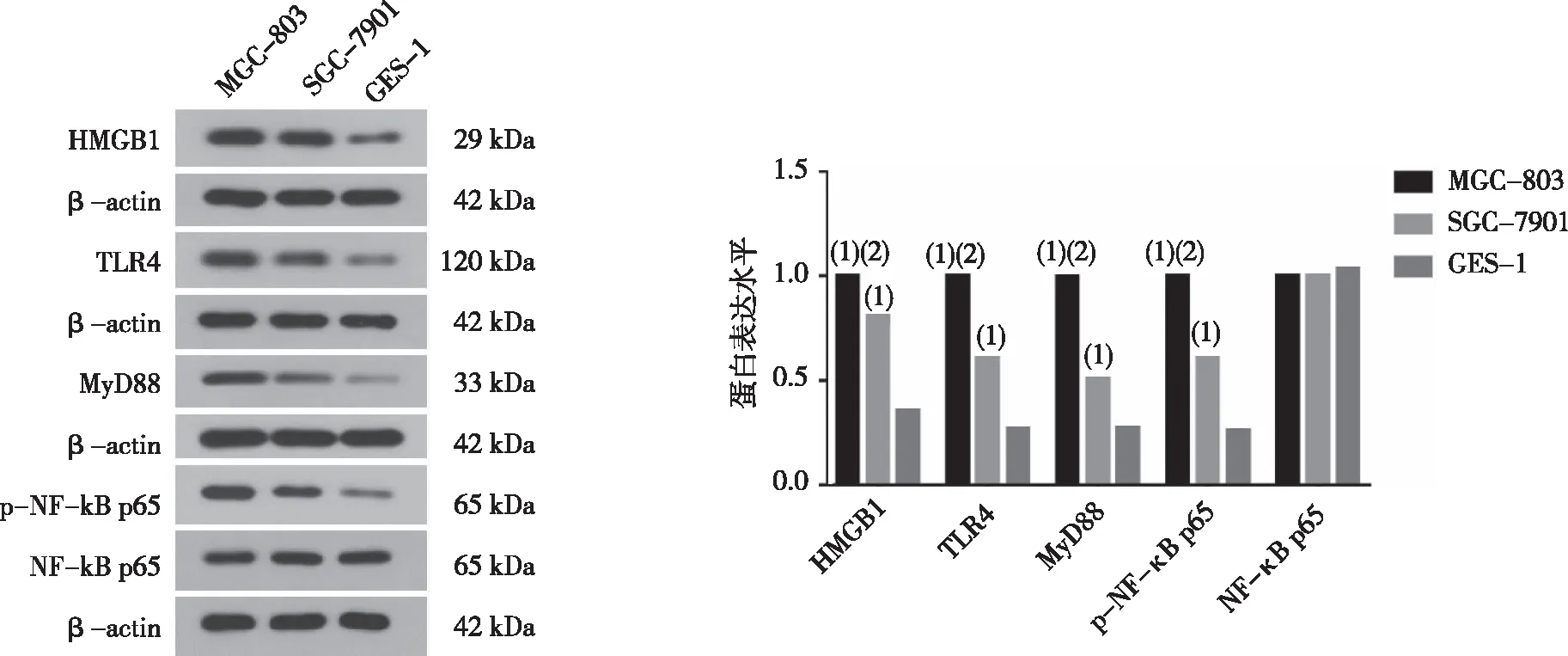
注:(1)与GES-1组比较,P< 0.01;(2)与MGC-803组比较,P< 0.01。
2.4.2HMGB1对MGC-803中蛋白表达量的影响 利用HMGB1干扰片段转染MGC-803细胞后,如图5所示,与Control组比较,除总NF-κB p65表达不变外,各指标的蛋白表达水平均明显降低,差异有统计学意义(P<0.01),提示干扰HMGB1的表达可能能够抑制TLR4/MyD88/NF-κB信号通路的活化,且HMGB1的表达及TLR4/MyD88/NF-κB信号通路的活化与细胞的恶性表型密切相关。

注:(1)与NC组比较,P< 0.01。
3 讨论
GC是世界上最常见的恶性程度最高的胃肠道肿瘤[9-10]。GC死亡率高的主要原因是GC的恶性程度太高[11-13]。侵袭和迁移是GC恶性进展的主要生物学特征,与GC的治疗和预后密切相关[14-15]。因此,寻找影响肿瘤迁移和侵袭的相关基因,明确能准确区分GC转移的生物标志物与靶标分子是目前研究的重中之重。
HMGB1是高迁移率族盒超家族中的一种蛋白,具有广泛的表达[16]。HMGB1在炎症和肿瘤细胞迁移等多种细胞过程中发挥着重要作用[17-19]。细胞外HMGB1可通过诱导细胞因子释放和募集白细胞来触发和维持炎症反应[20]。因此,它已被用作许多疾病的关键分子靶标[21]。同时,发现它参与基因的转录调控,HMGB1通过调节癌症相关基因的转录在癌症的发展中起作用[22]。HMGB1也被证实在许多人类癌症中过度表达[6,23-24]。研究结果一致表明,阻断HMGB1的表达抑制了癌症的进展。本研究的结果也显示,HMGB1在GC细胞中高表达,在干扰HMGB1的表达后,GC细胞的侵袭转移能力被抑制,表明干扰HMGB1确实能够阻断GC的进展。此外,TLR4/MyD88/NF-κB信号通路的激活被报道参与肿瘤的恶性进展。其中TLR4是生物体内典型的模式识别受体,TLR4在接受肿瘤的抗原信息时,激活MyD88,并进一步促进NF-κB的核易位,最终激活基因转录[25]。有学者研究发现,MyD88的高表达水平与上皮性卵巢癌患者的总体生存率低相关。因此,抑制TLR4/MyD88/NF-κB信号可能是一个有效的抑制癌症进展的方法。HMGBl是TLR4的一种内源性配体,TLR4作为一种跨膜受体,能够激活MyD88依赖的信号,以响应HMGB1的结合。HMGB1介导的TLR4/MyD88/NF-κB信号传导与许多不同类型癌细胞的侵袭和转移有关[26]。然而,其在GC中的作用尚未见报道。本研究结果表明,当在GC细胞中干扰HMGB1的表达后,TLR4/MyD88/NF-κB信号通路的表达被抑制,在表型实验中也观察到相应的侵袭及转移能力受到显著的抑制。
综上所述,在GC的进程中,HMGB1发挥着重要的促进作用,其可能的分子机制是通过激活TLR4/MyD88/NF-κB信号通路促进GC侵袭转移。这一研究结果可为临床上研究治疗GC的靶向药物提供科学的参考。
