胆汁淤积性肝损伤大鼠肝脏组织中水通道蛋白8/9表达的变化
2021-10-14叶蕾张婷婷曹婕露陈曦姚侃男姚嘉明陈芝芸严峻彬
叶蕾 张婷婷 曹婕露 陈曦 姚侃男 姚嘉明 陈芝芸 严峻彬
胆汁淤积是一类由于肝细胞、胆管细胞分泌胆汁障碍或胆汁运行障碍导致的极具破坏性的肝脏疾病[1-2],若未及时进行治疗,胆汁淤积进一步恶化会造成肝损伤,最终导致肝硬化或肝功能衰竭[3-4]。水通道蛋白8(AQP8)和水通道蛋白9(AQP9)均属水通道蛋白家族,广泛分布于肝细胞膜和胆管膜,在调控胆汁分泌中发挥重要作用[5-6]。磷脂酰肌醇3-激酶(PI3K)、蛋白激酶B(PKB/AKT)分别是AQP8、AQP9的上游信号通路,PI3K和AKT的激活可以上调AQP8、AQP9的表达[7-8]。本研究以α-异硫氰酸萘酯(ANIT)诱导胆汁淤积性肝损伤大鼠模型,观察AQP8/9及其上游信号通路PI3K/AKT在大鼠肝脏的动态变化,为胆汁淤积性肝损伤的防治提供新的治疗靶点和思路。
1 材料与方法
1.1 实验动物 SD雄性大鼠48只,体质量(140±10)g,SPF级,由上海西普尔-必凯实验动物中心提供,动物许可证[SCXK(沪)2013-0016],饲养于浙江中医药大学实验动物中心。
1.2 试剂与仪器 ANIT(Cat:249447)购自北京百灵威科技有限公司;总RNA提取试剂盒(Cat:9767)、逆转录试剂盒(Cat:RR036A)、荧光定量PCR试剂盒(Cat:RR820A)均购自宝生物工程(大连)有限公司;丙氨酸氨基转移酶(ALT)试剂盒(REF:14127070201)、天门冬氨酸氨基转移酶(AST)试剂盒REF:14126070201)、碱性磷酸酶(ALP)试剂盒(REF:141041702201)、总胆红素(TBIL)试剂盒(REF:14108170201)、总胆汁酸(TBA)试剂盒(REF:13300102101)为德赛诊断系统(上海)有限公司产品;总蛋白提取试剂盒(Cat:KGP2100)购自江苏凯基生物技术股份有限公司;BCA法蛋白定量试剂盒(Cat:PQ0011)、β-actin鼠单抗(Cat:ab008-040)、过氧化物酶标记的羊抗鼠二抗(Cat:GAM007)、过氧化物酶标记的羊抗兔二抗(Cat:GAR0072)、Potent ECL Kit(Cat:P1425)为杭州联科生物技术有限公司产品;AQP8鼠单抗(Cat:sc-81870)、AQP9鼠单抗(Cat:sc-74409)为美国Santa Cruz产品;AKT兔单抗(Cat:4960S)、P-AKT(Ser473)兔单抗(Cat:4060S)、PI3K p85兔单抗(Cat:4257S)为美国Cell Signaling Technology产品。日立7020全自动生化分析仪为日本高新技术株会会社产品;柏精核酸蛋白分析仪为英国Biochrom公司产品;AB17900荧光定量PCR仪为美国ABI公司产品;小型垂直电泳电转系统为美国Bio Rad司产品;FCE型ProteinSimple化学发光成像系统为美国ProteinSimple公司产品。免疫组化所用CK19抗体(Cat:PB9715)为博士德生物公司产品,通用型试剂盒(Cat:PV-6000)和DBA显色试剂盒(Cat:ZLI-9019)为中杉金桥生物公司产品。
1.3 动物分组及处理 所有大鼠每笼4只分笼,于明暗处各12 h,温度 (25±1)℃,相对湿度60%~70%的环境中饲养,普通饲料,自由饮水。48只大鼠适应性饲养1周后随机分为模型组和对照组,每组各24只。麻油配制成4%ANIT,模型组大鼠予以ANIT灌胃1次,100 mg/kg,灌胃体积为1 mL/kg;对照组予以等容量麻油灌胃。分别于灌胃后24 h、48 h、72 h三个时间点处理大鼠,每组各8只,处理前16 h禁食不禁水,空腹麻醉下腹腔静脉取血分离血清待用,分离肝脏,部分组织以4%多聚甲醛固定,常规石蜡包埋待用,其余肝组织放入液氮2 h后,冻存于-80 ℃冰箱中待用。
1.4 血清肝功能检测 采用全自动生化分析仪检测各组大鼠的血清ALT、AST、ALP、TBIL 和TBA水平。
1.5 免疫组化检测胆管上皮细胞标记物CK19表达 石蜡组织切片脱蜡至水,H2O2孵育15 min阻断内源性过氧化物酶,加CK19一抗工作液4 ℃冰箱过夜,PBS代替一抗为阴性对照,加生物素标记的二抗室温孵育30 min,DAB显色,苏木素复染,梯度酒精脱水,中性树胶封固,显微镜下观察CK19阳性显色表现为胞浆呈黄棕色。
1.6 qRT-PCR检测肝组织PI3K、AKT1、AKT2、AQP8和AQP9mRNA表达 以柱式总RNA试剂盒提取肝组织总RNA,核酸蛋白分析仪检测A260/A280比值在1.8~2.0之间,计算总RNA浓度。采用逆转录试剂盒以500 ng总RNA为模板合成cDNA,以下列反应体系进行PCR反应:2×SYBR5 μL、10μM上下引物各0.4μL、10 ng/ μL的cDNA模板2μL、加dd H2O补充体积至10μL。PCR反应条件:95 ℃预性5 min,再95℃15 s,60 ℃45 s,循环扩增40次。溶解曲线分析:95 ℃×15 s,60 ℃×5 s,缓慢上升至95 ℃×15 s。以β-actin为内参,相对表达量(2-△△Ct)来表示目的基因PI3K、AKT1、AKT2、AQP8和AQP9的mRNA表达水平。基因引物由生工生物工程(上海)有限公司设计并合成,见表1。

表1 PI3K、AKT1、AKT2、AQP8、AQP9引物
1.7 Western blot检测肝组织PI3K、AKT1/2、AQP8、AQP9蛋白表达或磷酸化水平 以全蛋白提取试剂盒经precellys-24生物样品均质器裂解成匀浆,离心取上清液采用BCA法进行蛋白定量,加上样缓冲液95 ℃变性后-80 ℃保存。配置10% SDS-PAGE胶,以每孔50 μg上样,180 V恒压电泳40 min,湿转转膜60~90 min。使用5%BSA室温封闭1 h后,加入相应一抗工作液PI3K(1∶800)、AKT1/2(1∶700)、P-AKT(1∶600)、AQP8(1∶600)、AQP9(1∶600)、β-Actin(1∶1000),4 ℃冰箱过夜;TBST洗膜后加入相应的抗兔或抗鼠二抗(1∶5000),室温孵育1 h;TBST洗膜后,以ECL在FCE型ProteinSimple化学发光成像系统进行曝光显影,并用AlphaView SA 3.3.0.0软件分析灰度值,采用目的蛋白灰度值/β-Actin灰度值代表目的蛋白的相对表达量,P-AKT灰度值/ AKT灰度值代表AKT的磷酸化水平。
1.8 统计学方法 采用SPSS 17.0统计软件。计量资料以(±s)表示,两组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 肝内胆汁淤积大鼠血清肝功能的动态变化 对照组大鼠的血清ALT、AST、ALP、TBIL、TBA水平在灌胃后24 h、48 h、72 h三个时相点基本持平。模型组大鼠三个时相点的血清ALT、AST、ALP、TBIL、TBA水平均较对照组明显升高(P<0.05)。模型组大鼠灌服ANIT后,血清ALT、AST、ALP、TBIL、TBA水平均在48 h达到最高值,72 h有所下降。见图1。
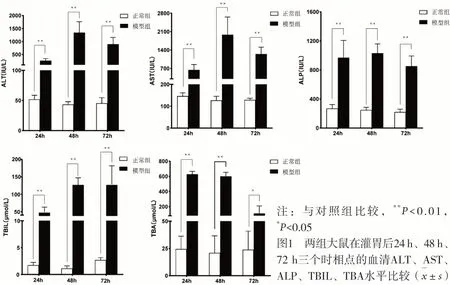
注:与对照组比较,**P<0.01,*P<0.05图1 两组大鼠在灌胃后24 h、48 h、72 h三个时相点的血清ALT、AST、ALP、TBIL、TBA水平比较(±s)
2.2 肝内胆汁淤积大鼠肝组织CK19表达的动态变化 对照组大鼠肝组织中CK19表达较低,灌胃后24 h、48 h、72 h三个时相点的CK19阳性染色较对照组明显增强,主要集中于汇管区。模型组大鼠灌胃后48 h、72 h的CK19阳性表达更为明显。见图2。
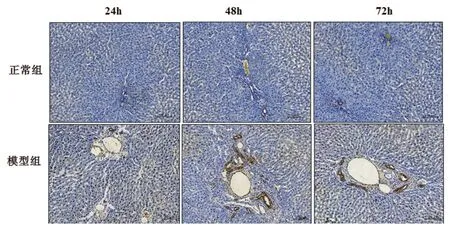
图 2 两组大鼠肝组织CK19表达结果(免疫组化×50)
2.3 肝内胆汁淤积大鼠肝组织PI3K、AKT1、AKT2、AQP8、AQP9各基因mRNA表达动态变化 对照组大鼠肝组织PI3K、AKT1、AKT2及下游靶基因AQP8、AQP9的mRNA表达水平在灌胃后24 h、48 h、72 h基本持平,模型组大鼠肝组织PI3K、AKT1、AKT2及下游靶基因AQP8、AQP9mRNA表达水平均不同程度低于对照组的同一时相点,除24 h时相点模型组大鼠AKT1、AKT2和AQP8 mRNA表达水平与对照组的差异无统计学意义(P>0.05),其他均显著下降(P<0.01)。模型组大鼠在灌服ANIT后PI3K、AKT1、AKT2及其下游靶基因AQP8、AQP9的mRNA表达水平在48 h达到最低值,72 h有所恢复,但明显低于对照组(P<0.01)。见图3。
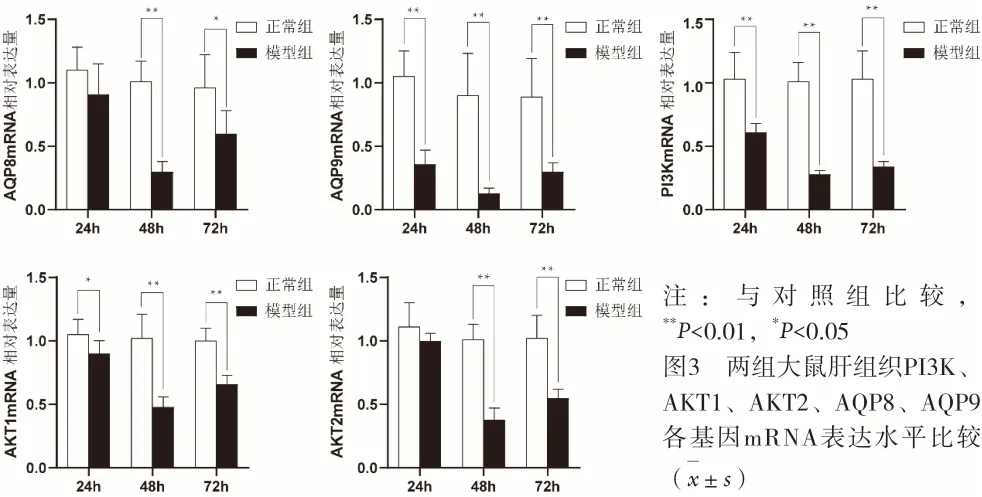
注:与对照组比较,**P<0.01,*P<0.05图3 两组大鼠肝组织PI3K、AKT1、AKT2、AQP8、AQP9各基因mRNA表达水平比较(±s)
2.4 肝内胆汁淤积大鼠肝组织PI3K、AKT1/2、AQP8、AQP9蛋白或磷酸化水平动态变化 对照组大鼠肝组织PI3K、AKT1/2及下游靶蛋白AQP8、AQP9的蛋白表达水平和AKT磷酸化水平在灌胃后24 h、48 h、72 h基本持平,模型组大鼠3个时相点的肝组织PI3K、AKT1/2及下游靶蛋白AQP8、AQP9表达水平和AKT蛋白磷酸化水平均低于对照组,其中AKT磷酸化水平较对照组显著降低(P<0.01)。模型组大鼠PI3K、AKT及下游靶蛋白AQP8、AQP9的蛋白表达水平在灌服ANIT后48 h达到最低值,72 h有所回升,但仍低于对照组。AKT磷酸化水平,在灌服ANIT后24 h、48 h、72 h持续降低。见图4和图5。
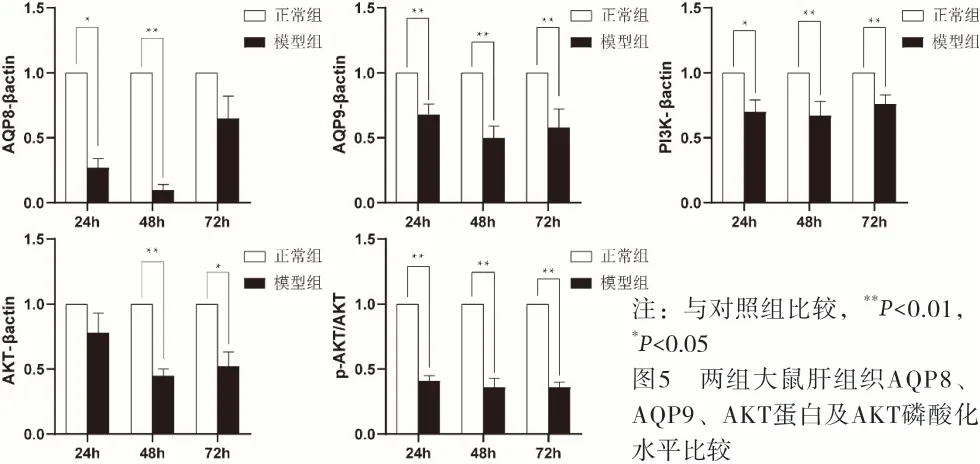
注:与对照组比较,**P<0.01,*P<0.05图5 两组大鼠肝组织AQP8、AQP9、AKT蛋白及AKT磷酸化水平比较
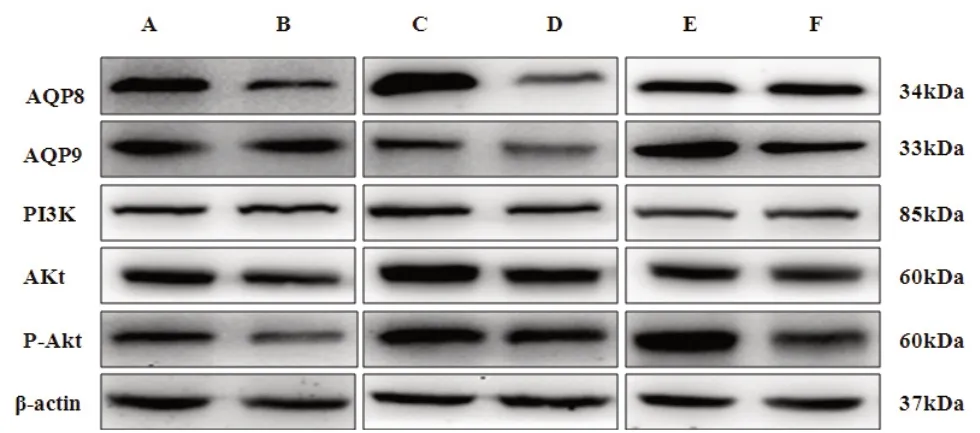
图4 两组不同时间AQP8、AQP9、PI3K、AKT、P-AKT、β-actin蛋白条带
3 讨论
胆汁淤积的具体机制尚未完全明确。有研究显示,胆汁分泌可能与水通道蛋白的调控有关[9]。水通道蛋白(AQP)是一系列广泛分布于哺乳动物、植物和低等生物的跨膜蛋白,充当着细胞水液进出的通道[10-11]。在胆汁分泌的过程中,肝细胞、胆管上皮细胞可以介导AQP的表达,改变水液在细胞内外的流动,建立细胞膜两侧浓度差,进而调控胆汁分泌。因此,胆汁淤积可能是AQP表达减少导致水渗透性降低,无法建立细胞内外浓度差,胆汁无法顺利分泌所导致。AQP8、AQP9作为水通道蛋白家族中最重要的蛋白,在胆汁分泌、合成中发挥关键作用[12]。研究发现,静止状态下AQP8主要位于细胞内的囊泡中,只有少量AQP8位于细胞膜、胆管膜[13-14],AQP9在细胞膜上的表达量明显高于细胞质中[15]。在一定条件下,AQP8、AQP9会向细胞膜转运,调控水液进出[14],介导胆汁分泌[16]。AQP8、AQP9表达缺陷会引起胆汁分泌功能障碍,造成胆汁淤积[17-18],进而引起肝损伤。已有实验证明,肝损伤小鼠肝组织中的AQP9表达显著降低[19]。PI3K/AKT作为AQP8、AQP9的上游通路,可以介导调控囊泡运输和胆汁形成的信号通路[20],磷酸化的PI3K会促进AQP8向细胞膜转运,提高AQP9的表达[21]。PI3K/AKT通路不仅可以通过调控下游AQP8、AQP9的转运造成肝损伤,也可以直接介导死亡受体,造成肝细胞凋亡及肝损伤[22]。研究证明,抑制PI3K/AKT的表达会增加肝脏损伤、炎症及肝癌的发生风险[23],成年小鼠肝脏中Akt1和Akt2的缺失会导致慢性肝损伤、炎症和肝癌。
α-异硫氰酸萘酯(ANIT) 能造成大鼠胆汁淤积性肝损伤,其诱导的大鼠肝损伤病理改变与人类胆汁淤积性肝损伤相似,因此被广泛用于建立胆汁淤积性肝损伤模型进行相关研究。本实验模型组大鼠灌服ANTI后出现肝损伤,血清ALT、AST、ALP、TBIL、TBA水平均显著高于对照组,提示建模成功。大鼠肝损伤程度在48 h最高,72 h后有所恢复,提示ANTI的肝毒性随着作用时间的延长逐渐减弱,说明ANTI诱导的大鼠胆汁淤积性肝损伤模型具有局限性,造模时应选择合适的药物作用时长。模型组大鼠肝组织CK19染色阳性,提示胆管上皮细胞增生,出现胆汁淤积。在灌服ANIT后的24 h、48 h、72 h三个时相点,模型组大鼠肝组织PI3K、AKT和靶蛋白AQP8、AQP9的mRNA及蛋白表达水平、AKT磷酸化水平均低于对照组,提示ANTI诱导大鼠肝损伤会抑制PI3K、AKT、AQP8、AQP9的表达及AKT的活化。ANIT灌胃48 h后,上述基因表达抑制最显著,72 h开始恢复,与大鼠肝损伤变化趋势相符,提示PI3K、AKT、AQP8、AQP9的表达与ANTI诱导大鼠胆汁淤积性肝损伤的机制密切相关。但AKT的磷酸化水平在24 h、48 h、72 h三个时相点持续降低,72 h后未出现明显回升,提示可能存在新的机制通过调控AKT的磷酸化造成大鼠肝损伤,有待进一步深入研究。
综上所述,ANTI可以通过抑制PI3K/AKT信号通路的活化来下调AQP8、AQP9的表达,且与大鼠的肝损伤变化相一致,但具有时效性,或可能存在未知机制通过调控AKT的磷酸化造成大鼠肝损伤。
