乳腺癌CSCO 2020分子分型与术后复发的相关性分析
2021-10-14张睿馨徐可佩方晓政王世威许茂盛
张睿馨 徐可佩 方晓政 王世威 许茂盛
2020年,全球新发确诊乳腺癌病例约230万,死亡率约6.9%[1]。局部或远端复发是乳腺癌诊治中面临的巨大挑战,乳腺癌术后复发多在术后2~3年,复发率为10%~41%[2-3],导致复发的因素包括年龄、绝经、肿瘤的大小、淋巴结转移、手术方式、病理类型、肿瘤的分子生物学特征及微环境等。本研究旨在探讨不同乳腺癌分子分型标准与术后复发的因素,以及乳腺癌分子分型2020版与术后复发的相关性,为临床个体化治疗提供更多的参考。
1 对象与方法
1.1 研究对象 回顾性收集2013年1月至2017年12月在本院行手术治疗并经病理确诊的乳腺癌患者。(1)纳入标准:具有完整的临床及随访资料;均经病理学诊断、分子分型;无其他部位癌症病史;确诊时无远处转移;随访时间≥2年。(2)排除标准:合并脑、肝等多器官功能障碍;术后随访资料不完整;失访患者。
1.2 资料收集 (1)临床资料:包括乳腺癌患者的年龄、月经、生育史、肿瘤大小、淋巴结转移及手术方式等。(2)病理资料:采用免疫组化法检测患者ER、PR、HER2及Ki67等指标,均经病理科医师诊断。按照2020 CSCO指南及2013 St Gallen会议乳腺癌分子分型标准将患者进行分类,见表1。

表1 乳腺癌分类标准与分子分型
1.3 乳腺癌术后复发判定标准 术后的前2年,每6个月进行一次随访,连续观察2年以上。(1)区域内复发:指局限于同侧的乳房内或胸壁,同侧的腋窝、腋下软组织内或腋下的淋巴结。(2)远端复发:指转移到身体的其他部位。所有患者均是通过磁共振检查发现可疑复发的病灶,并通过穿刺活检或切除活检以证实复发。
1.4 统计学方法 采用SPSS 22.0统计软件。采用Kapla-Meier法进行生存分析,组间比较采用Log-rank检验,将单因素分析中P≤0.1的变量纳入Cox比例风险模型进行多因素分析。以P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌术后复发风险单因素分析 共收集到726例乳腺癌患者,因各种原因未入组共279例,包括术后随访资料不完整或失访256例,合并其他部位癌症病史或远处转移14例,同时存在心、肺等多器官功能障碍9例。最终纳入研究的乳腺癌患者共447例,其中复发患者60例,均为女性,年龄24~85岁,平均年龄(53±11)岁。按照CSCO 2020版乳腺癌分子分型:Luminal A型55例,复发患者3例(5.5%);Luminal B型(HER2阴性)患者55例,复发患者10例(18.2%);HER2阳性型(HR阳性)患者197例,复发患者23例(11.7%);HER2阳性型(HR阴性)患者107例,复发17例(15.9%);三阴型患者33例,复发患者7例(21.2%)。Log-rank检验结果显示,CSCO 2020与2013 St Gallen不同乳腺癌分子分型标准与乳腺癌术后复发风险的相关性存在差异,但差异无统计学意义(P>0.05),见表2。
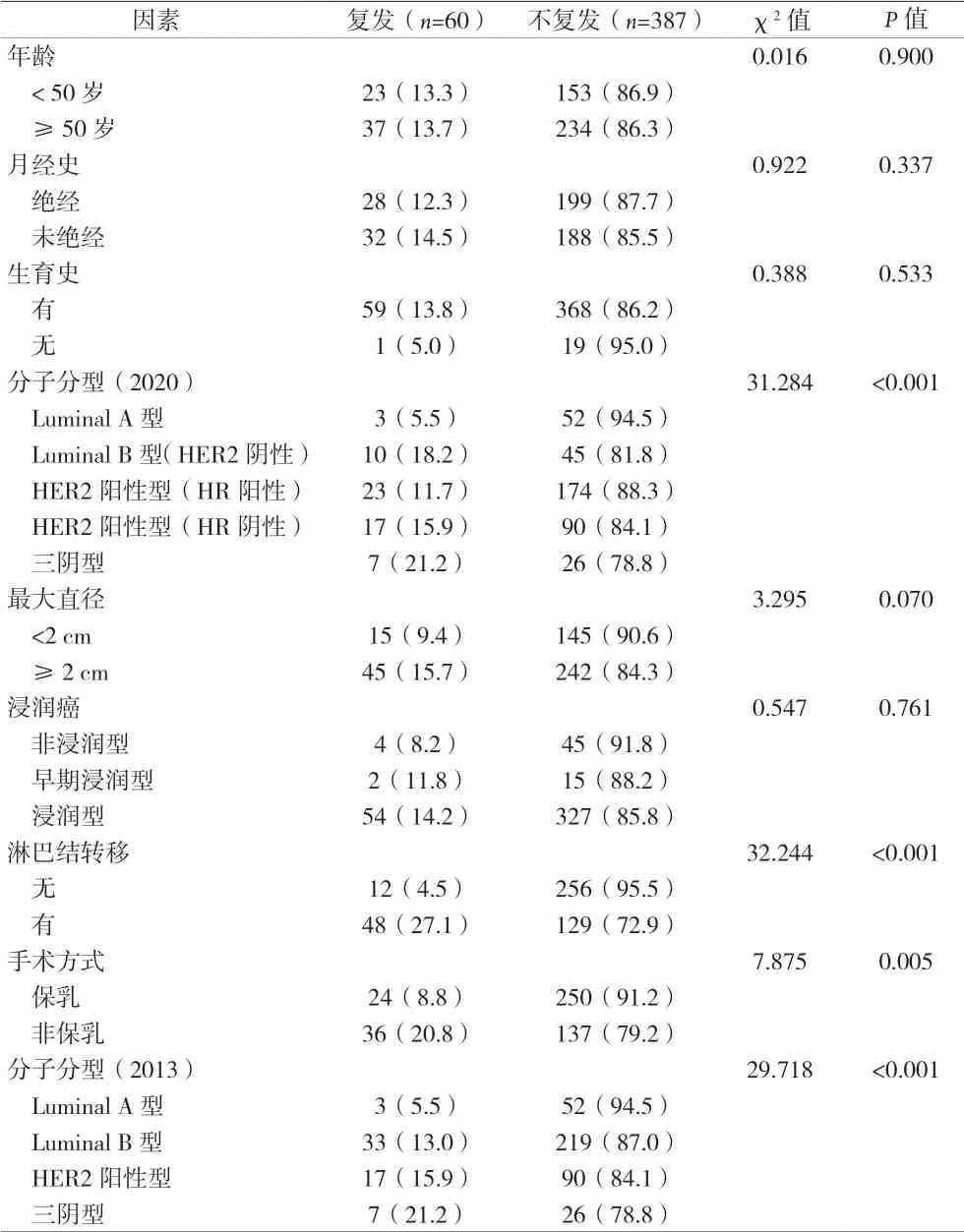
表2 乳腺癌患者术后复发单因素生存分析[n(%)]
2.2 乳腺癌术后复发风险多因素Cox比例风险分析 将单因素分析中有统计学意义的变量纳入Cox比例风险模型进行多因素分析,结果显示CSCO 2020中新增Luminal B(HER2阴性)及三阴型是乳腺癌复发的高危因素,2013 St Gallen中三阴型是乳腺癌复发的高危因素;乳腺癌淋巴结转移及手术方式是乳腺癌术后复发的独立高危险因素。见表3和表4。

表3 乳腺癌患者术后复发多因素Cox比例风险模型(2020版)

表4 乳腺癌患者术后复发多因素Cox比例风险模型(2013版)
3 讨论
2000年,PEROU等专家首次依照基因表达模式的差异,将乳腺癌分为Luminal A型、Luminal B型、HER2过表达型及基底细胞样型等四个主要亚型[4]。2001年,GALLEN提出将雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(HER2)、Ki67的表达结果作为乳腺癌分子分型的标准。2013年,GALLEN又将PR≤20%的患者归入Luminal B型,并将Luminal B型的两种亚型加以区分重新定义为Luminal B型(HER2阴性)和HER2阳性(HR阳性),表明Luminal B型乳腺癌更具侵袭性及异质性。CSCO 2020版明确将乳腺癌分为Luminal A型、Luminal B型(HER2阴性)、HER2阳性(HR阳性)、HER2阳性(HR阴性)及三阴型[5]。乳腺癌由于其遗传特性及分子功能的细胞亚群,导致其肿瘤异质度高[6-7],细化的乳腺癌分子分型可为其治疗及预后评估提供更精准的信息[8-9]。目前,乳腺癌分子分型研究与临床应用最多的仍是2013 St Gallen分型,更加精准的分子分型虽然有助于患者的治疗及预后评价,但同时也增加了乳腺癌患者临床诊治的复杂性。本研究通过比较两种乳腺癌分子分型标准的差异,进一步结合临床资料、肿瘤病理分型及免疫组化等相关指标综合分析影响乳腺癌患者术后复发的相关因素,以期帮助临床有效决策乳腺癌的治疗方案,合理优化使用医疗资源,提高乳腺癌患者的治疗效果和生活质量。
本组分子分型不同的乳腺癌患者术后复发的风险存在差异。Luminal A型、Luminal B型(HER2阴性)、HER2阳性型(HR阳性)、HER2阳性型(HR阴性)及三阴型的风险比(HR)分别为1、3.872、2.212、3.377、9.065。其中,Luminal A型乳腺癌患者的复发率最低,此分子分型中Ki67低表达表明肿瘤细胞的增殖水平较低,预后更好。三阴型患者的复发率及复发风险均最高,即激素受体(ER、PR)和HER2均为阴性的乳腺癌患者,具有侵袭性高、预后差、5年复发率较高等风险。本研究发现,CSCO 2020中新增分子分型 Luminal B(HER2阴性)型也是乳腺癌复发的高危因素。通过分析Luminal B(HER2阴性)型患者的临床数据,发现该类患者入组例数少,但复发多,复发率为18.2%,仅次于三阴型乳腺癌患者的复发率,且入组患者免疫组化Ki67值均大于30。由于本研究为回顾性分析,且患者随访时间较长,失访例数较多,所以复发率相对较高,可能存在一定的误差。PRAT等[10]分析了Ki67在腋窝淋巴结阴性乳腺癌患者中的预后效果及Ki67的表达与患者临床资料的关系,多变量分析表明Ki67是乳腺癌死亡的独立预测因子。Ki67反映乳腺癌的侵袭性,同时与无病生存期和总体生存率相关,可用于评估乳腺癌和其他恶性肿瘤的临床预后[11-12]。由此推断,Ki67可能成为Luminal B(HER2阴性)型患者具有较高复发率及Luminal B(HER2阴性)型为乳腺癌复发高危因素的主要原因。可见,CSCO 2020将2013GALLEN Luminal B型的两种亚型加以区分单独分组有一定的合理性。
目前,已发现乳腺癌分子分型的相关参数可以预测乳腺癌预后[13],但目前的预后评估标准尚不足以预测死亡率高的患者。不同乳腺癌分子分型患者的治疗手段和预后不尽相同,寻找最适合于临床诊疗的指标在乳腺癌患者的治疗及预防复发中至关重要。本研究通过对乳腺癌患者术后分子分型以及首诊年龄、绝经、生育史、肿瘤最大直径、淋巴结是否转移、手术方式、乳腺癌病理分型等诸多因素进行Log-rank检验,结果表明分子分型、淋巴结转移及手术方式与乳腺癌术后复发均有相关。与此同时,将单因素分析有统计学意义变量,分子分型、最大直径、淋巴结转移、手术方式等纳入Cox比例风险模型进行多因素分析,结果表明CSCO 2020新增Luminal B型(HER2阴性)、三阴型乳腺癌、与淋巴结转移是乳腺癌患者术后复发的独立高危因素。此外,结果还提示非保乳手术复发的风险是保乳手术的1.858倍,可能是由于行保乳手术的乳腺癌患者较多且病情轻、肿块体积小、未见明显淋巴结转移,而非保乳术患者例数少且肿块体积大、病灶侵袭性强,同时伴随淋巴结转移等影响乳腺癌复发的高危因素。淋巴结转移是乳腺癌复发的危险因素[14],术中发现乳腺癌患者存在淋巴结转移,表明肿瘤的浸润程度较高,已出现扩散、脱落等现象,累及淋巴结,会加大治疗难度,复发率也随之升高,因此临床应对该类患者给予更多重视,鼓励患者积极参与治疗。
综上所述,与2013 St Gallen版分子分型比较,CSCO 2020版中新增分型Luminal B型(HER2阴性)乳腺癌有较高的复发率,该分型也是预测乳腺癌患者术后复发风险的独立高危因素。CSCO 2020版乳腺癌分子分型可指导乳腺癌治疗个性化方案的准确决策。
