一里坪盐湖夏季卤水25℃等温蒸发
2021-10-12唐发满杨红军张生鹏
唐发满,杨红军,张生鹏,王 敏
(1.五矿盐湖有限公司,青海西宁810003;2.中国科学院青海盐湖研究所,中国科学院盐湖资源综合高效利用重点实验室;3.青海省盐湖资源化学重点实验室)
全球锂资源储量(以锂计)约为8 000万t[1],主要集中在玻利维亚、阿根廷和智利等(已探明储量约占全球储量的60%),中国的储量约为450万t。全球锂资源的35%赋存于伟晶岩中,65%存在于卤水中[2]。传统的提锂原料为锂辉石等伟晶岩,随着液体锂矿开采技术的发展,液体矿提锂以资源丰富、工艺简单、成本低等优势,已成为世界上生产锂盐的主要途径,目前,国内外从卤水资源中生产的锂产品(以Li2CO3计)已占锂产品总量的85%以上[3]。
中国的液体锂矿主要分布于青藏高原的盐湖中,与国外“锂三角”盐湖相比,中国青海盐湖锂资源的特点是锂含量相对较低、镁锂比高,高镁锂比是造成中国盐湖提锂进展迟滞的主要因素之一。位于青海省柴达木盆地中部盐湖带西部的一里坪盐湖,是中国重要的含锂盐湖之一[4]。该盐湖卤水水化学类型属硫酸镁亚型,其中富含钠、钾、镁、硼、锂等资源,是特大型锂、钾、硼等综合性矿床,现已探明该盐湖中钾、锂、硼资源储量分别为1 640万t(KCl)、178万t(LiCl)、89万t(B2O3),具有极大的经济开发价值。东台吉乃尔盐湖、西台吉乃尔盐湖和大柴旦盐湖等与一里坪盐湖类似,均为硫酸镁亚型富锂盐湖。
盐湖卤水蒸发析盐规律是盐湖资源开发的基础,许多研究者针对硫酸镁亚型含锂盐湖卤水蒸发浓缩的析盐规律和锂、硼等的富集规律进行了研究。陈 敬 清 等[5]、唐 发 满 等[6]、张 宝 全 等[7-8]和 其 他 研 究者[9-13]研究了东台吉乃尔盐湖卤水在不同条件下的蒸发结晶路线和析盐规律,表明锂以一水硫酸锂析出,硼则富集在液相中;余明祥等[14]和郭爱武等[15]研究了西台吉乃尔盐湖卤水不同条件下蒸发析盐顺序,表明锂和硼一直在液相富集;高世扬等[16-17]研究了大柴旦盐湖卤水蒸发析盐顺序,表明锂和硼在液相富集浓缩;边绍菊[18]研究了从大柴旦盐湖卤水中结晶高品位钾锂硼矿的工艺,得到硼酸盐固体矿和一水硫酸锂矿,液相中锂可富集到1.01%。陈敬清等[19]研究了一里坪冬季晶间卤水25℃等温蒸发过程,表明析出了五水硫酸镁和四水硫酸镁,蒸发路线与25℃Na+,K+,Mg2+∥Cl-,SO42-—H2O五元体系介稳相图理论预测结果基本相符;时历杰等[20]研究了一里坪晶间卤水在20~25℃蒸发过程中析盐规律和钾锂硼行为,表明在水氯镁石析出前锂和硼均在液相富集;析盐规律与25℃Na+,K+,Mg2+∥Cl-,SO42-—H2O五元体系介稳相图理论预测结果基本相符;预测老卤深度蒸发至Li+质量分数为0.30%~0.50%时锂以Li2SO4·H2O析出。李建国等[21]利用35℃Na+,K+,Mg2+∥Cl-,SO42-—H2O五元体系介稳相图对一里坪盐湖卤水35℃等温蒸发过程的析盐规律进行分析,表明蒸发过程中依次析出石盐、钾石盐、钾盐镁矾、光卤石、六水泻利盐和水氯镁石等,析出光卤石后的老卤中LiCl质量分数可达0.779%,得到极大富集。李俊德等[22]研究了一里坪盐湖晶间卤水自然蒸发的析盐规律,表明蒸发过程中依次析出石盐、钾石盐、泻利盐、光卤石和水氯镁石等,老卤中Li+质量分数达到0.48%。毕思峰[23]研究了一里坪盐湖卤水的自然蒸发析盐规律,表明蒸发过程中卤水依次析出石盐、光卤石、钾石盐、钾盐镁矾、水合硫酸镁和水氯镁石等,锂和硼在液相富集。杨春节等[24]研究了一里坪盐湖冬季卤水的自然蒸发过程,表明蒸发过程中依次析出石盐、钾石盐、光卤石、水合硫酸镁和水氯镁石等,锂和硼富集在老卤中。
前人研究了冬季卤水的25℃等温蒸发和自然蒸发过程[19-20]和一里坪盐湖卤水的自然蒸发过程[21-23],并对一里坪盐湖卤水35℃等温蒸发过程进行了理论分析[24];一里坪盐湖区气候干燥、多风少雨,夏季平均气温可达25℃左右;夏季盐湖卤水组成与冬季卤水不同,夏季是主要的蒸发季节,也是主要的盐田生产期,夏季盐田蒸发析盐的种类和数量对于生产有重要影响。研究该盐湖夏季卤水25℃等温蒸发的析盐规律和锂、硼等的富集规律可为盐湖资源开发工艺提供依据,然而这方面的研究未见文献报道,因此有必要进行一里坪夏季卤水25℃等温蒸发研究。夏季盐湖卤水主要化学组成可简化为Na+,K+,Mg2+∥Cl-,SO42-—H2O五元水盐体系,本文依据Na+,K+,Mg2+∥Cl-,SO42-—H2O五元体系25℃介稳相图[25],对一里坪盐湖夏季卤水进行了25℃等温蒸发实验,以揭示蒸发过程中卤水析盐规律和锂、硼等元素的富集规律,指导盐湖资源开发的盐田工艺,并与南美阿塔卡玛盐湖资源开发盐田工艺进行对比,对于一里坪盐湖钾锂硼资源综合利用具有重要意义。
1 实验部分
1.1 原料卤水
实验所用卤水为2019年7月3日取自一里坪盐湖晶间卤水,该卤水密度为1.226 6 g/cm3(25℃),其主要化学成分见表1。
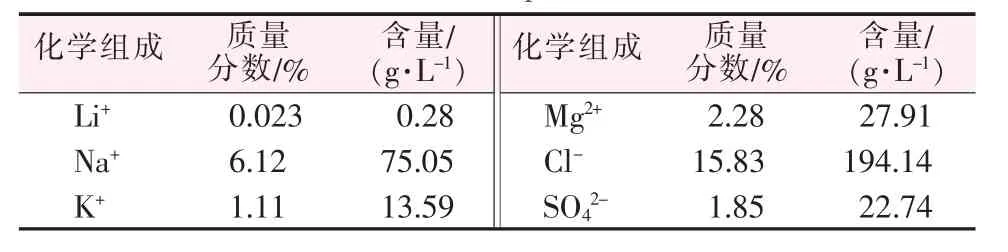
表1 原卤主要化学组成Table 1 Main composition of brine
1.2 实验装置
等温蒸发实验所用的简易恒温装置用通风柜作蒸发室,以红外灯作热源和排风扇吹风模拟自然蒸发条件,用电子继电器和接触温度计控制卤水蒸发温度。
1.3 实验方法
取一里坪盐湖晶间卤水5.0 L盛于35.0 cm×10.5 cm的搪瓷盆中,在简易恒温蒸发装置中设置温度为(25±0.3)℃,定时观察空气的温度、湿度及卤水的密度、温度和结晶情况。每次观察取所析出的固相样品采用偏光显微镜进行盐矿鉴定,适时进行固液分离,分离后量取余卤体积、测定卤水液相密度,固液相分别称重、分别取样品进行化学分析。
1.4 分析方法
Mg2+测定采用EDTA容量法;K+测定采用四苯硼钠-季铵盐容量法;B2O3测定采用甘露醇-氢氧化钠容量法;Cl-测定采用硝酸银容量法;SO42-测定采用EDTA-钡盐容量法;Na+测定采用差减法;Li+测定采用火焰原子吸收分光光度法[26-27];矿物鉴定采用X射线粉末衍射法(SIEMENS D500型);溶液密度测定采用密度计(KEM DA-130N型)。
2 结果与讨论
2.1 卤水蒸发过程的理论分析
根据表1卤水组成和图1的相图数据与原理[25,28-30]对卤水25℃等温蒸发的结晶路线进行理论预测:原卤组成的系统点L0点位于被氯化钠饱和的氯化钾相区,在蒸发过程中首先析出氯化钠,当氯化钾饱和后与氯化钠共析;继续蒸发则七水硫酸镁逐渐饱和,氯化钾、氯化钠和七水硫酸镁共析,液相点将沿石盐、钾石盐和七水硫酸镁共饱线向石盐、钾石盐、光卤石与七水硫酸镁共饱点方向运动直至光卤石饱和析出,在该共饱点体系的自由度为零;随着蒸发进行氯化钾溶解而光卤石析出直至氯化钾溶解完全;继续蒸发,液相点将沿氯化钠、光卤石和泻利盐共饱线向氯化钠、光卤石、泻利盐和氯化镁共饱点移动并最终在此点蒸干,预测的结晶路线见图1绿色线。

图1 卤水蒸发结晶路线Fig.1 The crystallization path for evaporation of brines
根据一里坪盐湖卤水的主要化学组成,在图2的简化干基图、水图和钠图上分别标出卤水组成的初始系统点M0(M0′、M0″),对原始卤水在一个蒸发池中的25℃等温蒸发过程进行分析,以100 g卤水为基准进行计算。

图2 Na+,K+,Mg2+∥Cl-,SO42-—H2O体系25℃介稳相图Fig.2 Metastable phase diagram of Na+,K+,Mg2+∥Cl-,SO42-—H2O at 25℃
进行蒸发过程中蒸发水量与析盐量的理论计算,结果如下:
1)氯化钠析出阶段:卤水组成的初始系统点位于氯化钠饱和的钾石盐结晶区,结合钠图可知,氯化钠首先饱和析出至氯化钾饱和;干基图系统点一直为M0;本阶段需蒸发水量46.00 g,析出氯化钠13.75 g,钠的析出率为88.7%;本阶段卤水最多可浓缩2.48倍。
2)氯化钾与氯化钠共析阶段:本阶段氯化钾与氯化钠共同析出至泻利盐刚刚饱和,固相点为K(KCl),液相点由M0移至E。
本阶段需蒸发水量4.12 g,析出KCl 0.67 g、NaCl 1.17 g,钾的析出率为31.7%,钠的析出率为96.2%;本阶段卤水最多可浓缩1.17倍。
3)氯化钠、氯化钾与泻利盐共析阶段:本阶段氯化钠、氯化钾与泻利盐共同析出至光卤石刚刚饱和,固相点由K移至F,液相点由E移至D;本阶段需蒸发水量1.80 g,共析出KCl 1.08 g、NaCl 0.41 g、MgSO4·7H2O 2.37 g,钾的析出率为50.7%,钠的析出率为98.8%;本阶段卤水最多可浓缩1.20倍。
4)光卤石析出段:本阶段光卤石析出同时氯化钾溶解至完全,固相点由F移至H,液相点D不动;本阶段析出光卤石4.80 g,钾的析出率为60.8%;本阶段卤水最多可浓缩1.24倍。
5)氯化钠、光卤石与泻利盐共析阶段:本阶段氯化钠、光卤石与泻利盐共同析出至水氯镁石刚刚饱和,固相点由H移至J,液相点由D移至P;本阶段需蒸发水量3.96 g,共析出光卤石7.70 g、MgSO4·7H2O 6.75 g,析出NaCl 0.15 g,钾的析出率为97.6%,钠的析出率为99.8%;本阶段卤水最多可浓缩1.97倍;当水氯镁石刚刚饱和时卤水量为11.79 g,相比原始卤水浓缩了约8.5倍。
6)水氯镁石析出阶段:本阶段氯化钠、泻利盐、光卤石与水氯镁石共同析出至卤水蒸干。
2.2 卤水蒸发结晶路线及析盐顺序
卤水等温蒸发实验共进行了11次固液分析,最后氯化镁饱和析出,先后析出9种盐类:NaCl、KCl、MgSO4·7H2O、KCl·MgSO4·3H2O、MgSO4·6H2O、KCl·MgCl2·6H2O、MgSO4·5H2O、MgSO4·4H2O和MgCl2·6H2O等。液、固样品主要化学组成分析结果分别列于表2和表3,卤水的蒸发结晶路线见图1蓝色线。表2、表3和图1中的实验结果表明,卤水蒸发过程和结晶路线与预测结果基本一致。

表2 蒸发实验分离的液相组成Table 2 Composition of the liquids by isothermal evaporation

表3 蒸发实验分离的固相主要化学组成Table 3 Composition of the solids by isothermal evaporation %
实验过程固相中检测到了溶解度数据[25]中不存在的钾盐镁矾、五水硫酸镁和四水硫酸镁等矿物,李红霞[31]研究发现在Li+,Mg2+∥Cl-,SO42-—H2O四元水盐体系25℃相图中出现的四水硫酸镁、五水硫酸镁是介稳相,实验过程固相中四水硫酸镁和五水硫酸镁也可能属于介稳固相;陈敬清等[19]认为一里坪盐湖卤水蒸发过程中钾盐镁矾的出现是氯化钾与硫酸镁反应的结果,水温越高转化越快,实验过程中钾盐镁矾的出现可能是温度波动造成的。
2.3 蒸发过程中卤水离子浓度变化规律
蒸发过程中,卤水中Na+、K+、Mg2+、Li+和B2O3等组分的浓度变化趋势见图3。根据图3可知:1)在蒸发过程中,NaCl始终处于饱和状态而大量析出,液相中Na+浓度随蒸发进行呈逐渐下降趋势,实验结束时氯化钠几乎析出完全,液相中Na+质量浓度降至1.65 g/L。2)液相中K+变化为先升高后降低的趋势。蒸发初期,液相中K+不断富集,K+浓度呈缓慢上升趋势,当K+质量浓度达到最大30.61 g/L时氯化钾开始饱和析出,随后K+浓度逐步降低,到实验结束时液相中K+质量浓度降至0.75 g/L,液相中的钾几乎完全析出;蒸发过程中析出的含钾矿物有钾石盐、钾盐镁矾和光卤石等。3)液相中Mg2+浓度在蒸发过程中逐步升高,到结束实验时Mg2+质量浓度达到120.37 g/L,此时MgCl2·6H2O饱和析出,在实验过程中累计有7种镁盐即MgSO4·7H2O、KCl·MgSO4·3H2O、MgSO4·6H2O、KCl·MgCl2·6H2O、MgSO4·5H2O、MgSO4·4H2O和MgCl2·6H2O析出。4)蒸发过程中Li+在液相中得到富集,实验结束时液相中Li+质量浓度为2.369 g/L,比原卤浓缩了7.5倍左右,说明在一里坪盐湖夏季利用盐田日晒蒸发获取富锂浓缩卤水是可行的。5)蒸发过程中硼在液相富集而没有硼酸盐析出,最后的母液中B2O3的质量浓度为3.15 g/L,为进一步加工提硼提供了基础。
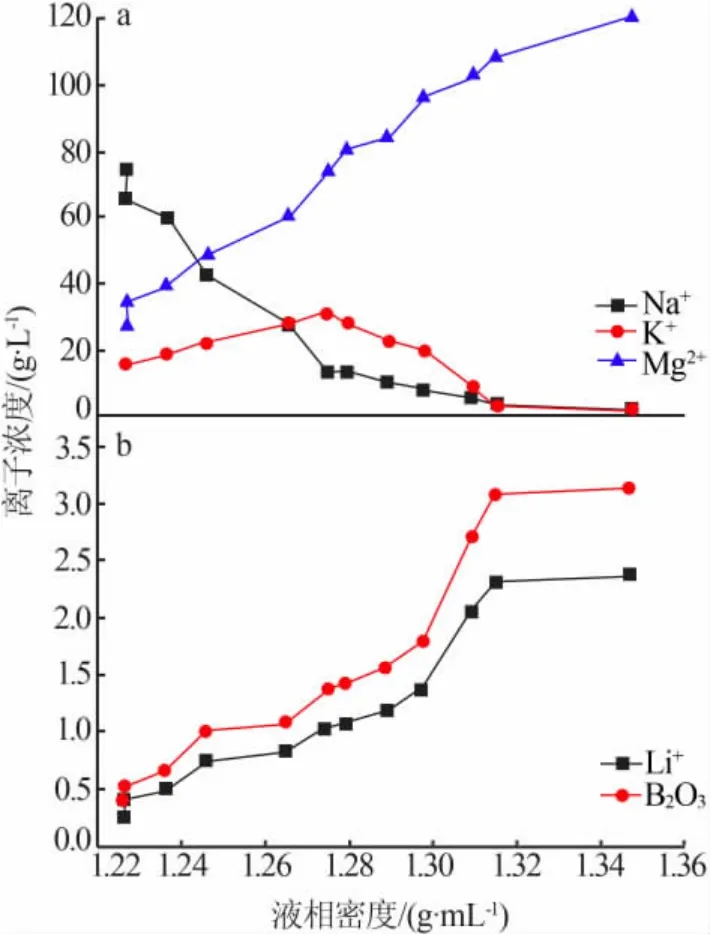
图3 实验过程中液相主要化学组分浓度变化趋势Fig.3 Trend of main composition in the liquids in the course of evaporation
2.4 实验结果对盐田生产的启示
根据实验结果及卤水开发钾、锂、硼等资源的需求,可把卤水蒸发过程分成不同的析盐阶段,见图4,盐田可设计成四级蒸发池,分别是石盐池、钾混盐池、光卤石池和老卤池等。石盐池主要析出NaCl,NaCl可作为生产食盐、工业盐的原料;钾混盐池 析出NaCl、KCl、KCl·MgSO4·3H2O和MgSO4·7H2O等矿物,可用来生产钾镁肥(或进一步转化生产K2SO4产品);光卤石池析出NaCl、KCl·MgCl2·6H2O和MgSO4·7H2O等,可作为生产KCl的原料,富锂、硼老卤作为生产Li2CO3、LiOH和H3BO3、Na2B4O7·10H2O的原料。

图4 蒸发各阶段析盐规律Fig.4 Crystallization rules from the brine in the course of evaporation
由图4实验结果可为一里坪盐湖卤水盐田控制节点提供依据,具体如下:1)原卤在钠盐池中经过浓缩蒸发至进入调节池时,卤水中氯化钠含量是主要控制指标,其次钾、硫酸根含量比也要进行控制。根据文献[25]和实验结果,调整进入调节池中卤水组成为W1(见表4);2)在调节池中控制进入钾混盐池卤水中钠盐含量,进入钾混盐池卤水组成为W2(见表4);3)进入光卤石池中卤水组成是根据浓缩卤水中钾的浓度确定的,在此点进行导卤储备,进入光卤石池中卤水组成为W3(见表4);4)进入储卤池中卤水组成是根据浓缩卤水中锂的浓度确定的,在此点进行导卤储备,一般情况下水氯镁石饱和的卤水中锂的浓度可满足提锂要求,为了后续锂车间提锂控制要求还必须控制钾、硼、硫酸根等离子浓度,尤其是钾离子质量浓度必须控制在1 g/L(0.075%)以下,进入储卤池中卤水组成为W4(见表4)。

表4 盐田蒸发控制节点Table 4 Evaporation control nodes of salt-field
2.5 与南美阿塔卡玛盐湖开发的盐田工艺比较
南美阿塔卡玛盐湖的资源开发是全球盐湖开发成功的典范[2]。阿塔卡玛盐湖卤水组成见表5,该卤水组成的特点是卤水含盐量高、重要组分钾、锂、硼等的浓度高且镁锂比低(镁锂比为6左右),卤水水化学类型属于硫酸镁亚型,目前开发的盐田工艺见图5。

表5 阿塔卡玛盐湖卤水主要化学组成Table 5 Main composition of the Atacama salt lake brine %
阿塔卡玛盐湖盐田工艺采用4级蒸发,分别是石盐池、钾石盐池、硫酸盐池和老卤池。加工工艺是:钾石盐池得到的钾石盐矿用于生产氯化钾或硝酸钾;硫酸盐池得到的矿物用于加工硫酸钾;浓缩卤水中锂质量浓度达到30 g/L左右,先送往硼酸加工厂生产硼酸,脱硼后的卤水送往碳酸锂加工厂生产碳酸锂。
一里坪盐湖和南美阿塔卡玛盐湖的卤水水化学类型相同,根据阿塔卡玛盐湖卤水的主要组成,可简 化 为Na+,K+,Mg2+∥Cl-,SO42-—H2O五 元 水 盐 体系,两者卤水组成的系统点在该体系25℃介稳相图(干基)上的位置如图6所示。由图6可知:虽然两者位置均位于氯化钾与氯化钠共饱相区,但阿塔卡玛盐湖卤水n(K)/n(Mg)为1.9,而一里坪盐湖卤水n(K)/n(Mg)为0.5,两者差异较大。阿塔卡玛盐湖卤水系统点位于氯化钠、氯化钾与软钾镁矾共饱线附近,一里坪盐湖卤水系统点位于氯化钠、氯化钾与泻利盐共饱线附近。阿塔卡玛盐湖卤水在25℃等温蒸发过程中依次析出石盐、钾石盐、软钾镁矾、泻利盐和光卤石等,其中析出的钾盐有钾石盐、软钾镁矾和光卤石等,与一里坪盐湖卤水蒸发析出的钾盐矿物明显不同,钾矿的后续加工也有所区别。阿塔卡玛盐湖卤水锂含量高而镁锂比低,经过盐田浓缩后卤水中的锂质量浓度可达到30 g/L左右,锂资源开发工艺较为简单。相比之下,一里坪盐湖卤水锂含量低且镁锂比高,经过盐田蒸发到老卤阶段,卤水中的锂质量浓度只有2.3 g/L左右且镁锂比仍高达50,从而增加了锂资源开发的难度。虽然阿塔卡玛盐湖卤水与一里坪盐湖卤水主要化学组成、盐田矿物种类及加工工艺等方面存在差别,但阿塔卡玛盐湖开发综合利用了钾、锂和硼等资源,对于一里坪盐湖资源开发及综合利用仍具有借鉴意义。

图6 阿塔卡玛与一里坪盐湖卤水在相图上位置Fig.6 Position of brine composition of Atacama and Yiliping salt lake on the phase diagram
3 结论
通过一里坪盐湖卤水25℃等温蒸发实验,并与南美阿塔卡玛盐湖资源开发工艺进行对比,可得到如下结论:1)一里坪盐湖夏季卤水等温蒸发实验中,共结晶析出了9种盐,分别是石盐、钾石盐、泻利盐、钾盐镁矾、六水泻盐、光卤石、五水泻盐、四水泻盐和水氯镁石;卤水蒸发路线基本遵从Na+,K+,Mg2+∥Cl-,SO42-—H2O(25℃)五元水盐体系介稳相图的规律。2)在卤水蒸发过程中,液相中的钾分别以钾石盐、钾盐镁矾和光卤石等矿物析出,可用于加工钾盐产品。3)在卤水蒸发过程中,锂、硼在液相中得到富集,最后液相中锂、硼质量浓度分别达到2.37 g/L和3.15 g/L,此富锂、硼老卤可作为进一步提取锂、硼的原料。4)蒸发实验结果可为卤水开发的盐田工艺节点控制提供依据。5)南美阿塔卡玛盐湖与一里坪盐湖卤水同属于硫酸镁亚型,阿塔卡玛盐湖资源的综合利用可以为一里坪盐湖资源开发提供借鉴。
