分子印迹固相萃取-酶联免疫分析法检测鱼肉中组胺
2021-10-12贾宝珠马斐然邱芷靖袁钰佩杨金易
◎ 贾宝珠,马斐然,邱芷靖,袁钰佩,杨金易,罗 林
(1.广东第二师范学院 生物与食品工程学院,广东 广州 510303;2.华南农业大学食品学院,广东 广州 510642)
组胺是一种肉类、高蛋白食品腐败产生的生物胺,超量摄入组胺会引起组胺中毒,威胁人们的身体健康[1]。美国FDA限定进口水产品中的组胺残留不能超过50 mg·kg-1[2]。因此加强对食品中组胺的检测非常有必要。以抗原-抗体特异性反应为基础的免疫检测技术具有分析时间短、操作便捷、灵敏性高、特异性好、通量高、检测成本低等优势,现已被广泛用于食品安全检测[3]。采用免疫分析法检测食品中组胺时,由于样品基质复杂,加之组胺分子极性较大,水溶性较好,难以与水溶性杂质分离,通常需要对样品提取液进行高倍数的稀释,降低实际样品的检测灵敏度及准确度[4-5]。
本研究采用本体聚合法,以组胺为模板分子,二乙烯基苯为交联剂,偶氮二异丁腈为引发剂,甲基丙烯酸与二烯丙基胺为混合功能单体,制备了适用于水相体系对组胺特异性吸附的分子印迹聚合物。并将其作为固相萃取材料对肉类样品中的组胺进行富集与净化,并结合酶联免疫分析技术实现对肉类食品中组胺的快速检测,该方法快速、便捷、成本低、灵敏度低、准确性好。
1 材料与方法
1.1 试剂与仪器
组胺二盐酸盐,组氨酸,酪胺,苯乙胺,购自于天津西恩思生化科技有限公司;二乙烯基苯(DVB)、偶氮二异丁腈(AIBN)、甲基丙烯酸(MAA)、二烯丙基胺,购自于阿拉丁试剂。VERTEX 70傅里叶红外光谱,德国 BRUKER公司;Multiskan MK3酶标仪,美国Thermo公司。
1.2 方法
1.2.1 组胺分子印迹聚合物的制备
称取0.111 g(1 mmol)组胺溶于4 mL甲醇中,加入2 mmol甲基丙烯酸和2 mmol二烯丙基胺,20 mmol DVB,磁力搅拌30 min,再加入引发剂偶氮二异丁腈120 mg,在超声波振荡器中振荡15 min,密封体系,60 ℃水浴加热聚合反应12 h,得到白色聚合物,去除表面未反应的粘稠物。在50 ℃下鼓风烘0.5 h。将干燥的疏松聚合物破碎,用150 目的不锈钢筛网筛分,使用甲醇-乙酸(v∶v/1∶9)溶液,索氏提取48 h,除去组胺。将聚合物粉末移至甲醇中除去乙酸,再测定残留组胺的浓度,直至模板被完全洗脱,得到分子印迹聚合物(dMIPP)。制备非分子印迹聚合物(dNIPP),除不添加模版分子外,其余的制备方法同上。
1.2.2 分子印迹聚合物的表征
分别取一定量的分子印迹聚合物粉末,60 ℃干燥12 h,将MIP粉末进行真空干燥,取少量该粉末于研钵中,与氯化镁一起研磨,压片处理,使用VERTEX 70(BRUKER)仪器进行红外吸收光谱扫描,测定分子印迹聚合物表面基团分布情况。
1.2.3 材料吸附性能研究
(1)静态吸附。将一定量的分子印迹材料放入一定体积系列浓度目标分子的水溶液中,用缓冲溶液调整溶液的pH值至某一数值,在常温下吸附24 h,用高效液相法测定吸附前后溶液中化合物的浓度,按式1计算分子印迹材料的吸附容量。

式中:C0为吸附前溶液浓度,μg·L-1;Ce为吸附后平衡溶液的浓度,μg·L-1;W为分子印迹材料的质量,mg;V为溶液的体积,mL;Q为分子印迹材料的吸附容量,mg·g-1。
(2)选择性性能测试。选取组胺、酪胺、苯乙胺、色胺,各自分别配成0.01 mg·mL-1、0.001 mg·mL-1两个浓度的溶液,再向每种溶液中分别加入40 mg的MIPP和NIPP,并置于振荡器37 ℃恒温条件下振荡24 h。随后,将上述溶液离心(3 000 r·min-1,10 min),取上层清液,测定其中对应目标成分的浓度。
1.2.4 固相萃取的预处理
(1)MISPE柱的制备。向固相萃取空柱中填入70 mg dMIPP,并确保聚合物外泄。同时将70 mg NIPP填入空柱中制备非印迹固相萃取柱(NISPE)以作为对照。
(2)MISPE柱洗脱液的优化。取2 mg·L-1的组胺标准溶液作为MISPE的上样液,以体积比为3∶1的乙腈-甲醇混合溶液为淋洗液,分别以纯甲醇、体积比9∶1的甲醇-甲酸混合溶液、体积比8∶2的甲醇-甲酸混合溶液为洗脱液。同时在NISPE上样相同浓度的组胺标准溶液,以相同3∶1的乙腈-甲醇混合溶液为淋洗液,纯甲醇为洗脱液进行洗脱。收集的洗脱液在50 ℃条件下用氮气吹干,随后以PBS缓冲液复溶,并用之前建立的ELISA方法进行检测[4]。
1.2.5 实际样品的处理
准确称取2 g鱼肉样品于50 mL离心管,向其中加入10 mL乙腈,涡旋振荡1 min后,超声20 min,随后在离心(10 000 r·min-1,20 min),取上层清液为上样液,体积比9∶1的乙腈-甲醇混合溶液为淋洗液进行淋洗,体积比为8∶2的甲醇-甲酸混合溶液为洗脱液进行洗脱。收集洗脱液并在50 ℃条件下用氮气吹干,用PBS缓冲溶液复溶后进行ELISA检测。
2 结果与分析
2.1 分子印迹聚合物的表征
红外光谱显示见图1,MIPP与NIPP具有一些相同的特征吸收峰,这是由于MIPP和NIPP本身具有共同的化学组成基团,1 664 cm-1(C=C),1 465 cm-1表明MIPP和NIPP均含芳香环,2 925 cm-1和2 855 cm-1(C-H),1 394 cm-1(C-O),1 111 cm-1(C-N),1 664 cm-1(C=O),这表明DVB已经成功地将印迹聚合物进行了交联。

图1 dMIPP和dNIPP傅里叶红外光谱图
2.2 分子印迹材料的吸附性能分析
2.2.1 dMIPP的静态吸附分析
由图2可知,随着组胺初始浓度的上升,dMIPP和dNIPP对组胺的吸附性逐渐增加。在0.001~0.100 mg·mL-1的组胺初始浓度范围内,聚合物对组胺吸附量的增长速率基本稳定,而当初始浓度高于0.1 mg·mL-1后聚合物对组胺吸附量的增长速率开始下降,吸附量也逐渐趋于平衡。由此可知在浓度0.1 mg·mL-1左右聚合物基本吸附完成。

图2 dMIPP与dNIPP对组胺的静态吸附曲线图
2.2.2 分子印迹材料的选择性
为了考查印迹聚合物的特异性,选择组胺结构类似物酪胺、苯乙胺和色胺进行研究。选择0.010 mg·mL-1和0.001 mg·mL-1两个浓度,结果dMIPP在两个浓度下对组胺均表现出良好的选择性,对其吸附性能力均优于其结构类似物。如表1所示,两种质量浓度下组胺的选择性因子均大于1.7。表明所制备的dMIPP对于组胺具有较好的吸附效果。dNIPP在两个浓度下对组胺的吸附能力较dMIPP显著下降,且对其余竞争物的吸附同样不明显,通过计算,其印迹因子均达到2.0以上,表明dMIPP对组胺的吸附性能远优于NIPP,可用于组胺的富集与分离。

表1 不同质量浓度下的dMIPP的印迹因子与选择性因子表
2.3 MISPE柱洗脱液的优化
相同浓度下以体积比9∶1的甲醇-甲酸为洗脱液的MISPE,所测得的回收率为73%;而以纯甲醇为洗脱液的MISPE所测得的回收率为44.5%,以体积比8∶2的甲醇-甲酸为洗脱液的MISPE所测得的回收率为92%。由此可知,以体积比8∶2的甲醇-甲酸为洗脱液的洗脱效果最好。而以纯甲醇为洗脱液的NISPE所测得的回收率仅为2%。上述结果表明以MIPP为填料的MISPE萃取柱萃取,以体积比8∶2的甲醇-甲酸洗脱液进行洗脱对样品的净化效果最好。
2.4 鱼肉样品加标回收试验
为了验证所建立方法的准确性,进行了加标回收试验。由表2可知,添加量分别为10.0 mg·kg-1、2.0 mg·kg-1和0.5 mg·kg-1,每个添加水平重复3次。平均回收率在84%~106%,相对标准偏差在7.4%~12.2%,表明MISPE充当吸附柱料对组胺的特异选择性较好,所开发的方法可以用于实际样品中组胺的检测研究。
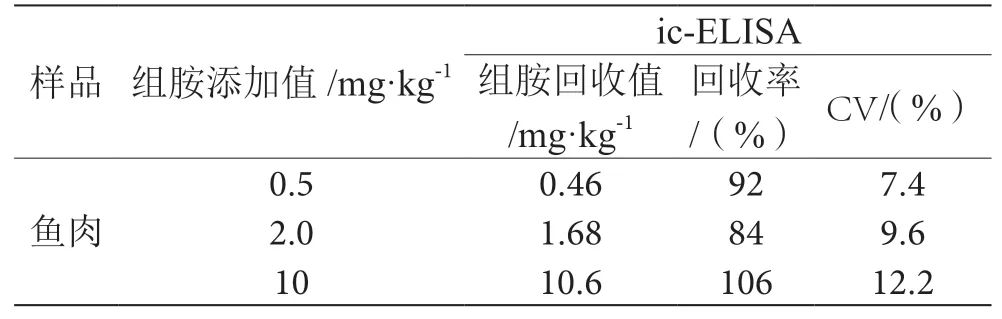
表2 鱼肉中组胺的加标回收率表(n=3)
3 结论
本研究以对组胺特异性吸附的印迹材料作为固相萃取吸附剂用于鱼肉样品前处理,结合前期所建立的酶联免疫分析方法,建立了快速检测组胺方法。对于复杂基质样品-鱼肉的检测具有满意的回收率和精确性,可用于实际样品中对组胺残留的测定。
