羊膜干细胞免疫调节新进展
2021-10-12周阳陈梦梦邹伟张炳强
周阳 陈梦梦 邹伟,2 张炳强△
(1. 青岛瑞思德生物科技有限公司,山东 青岛 266000;2. 辽宁省生物技术与分子药物研发重点实验室,辽宁 大连116000)
干细胞是具有自我更新和分化潜能两大特性的细胞,根据其分化潜能被分为全能干细胞、多能干细胞和单能干细胞[1]。胚胎干细胞和诱导多能干细胞是两种最常见的干细胞类型,但研究发现这两类细胞存在致瘤性和低存活率等问题,给临床应用带来了巨大挑战[2]。羊膜干细胞来源于胎盘,具有其他干细胞无法比拟的优势,是再生医学优良的种子资源,近年来倍受关注。本文将着重介绍羊膜干细胞免疫调节的机制新的研究进展。
1 羊膜及羊膜干细胞
羊膜是胎盘的一部分,它是一种透明、光滑、无血管的单层薄膜(约100μm),由上皮和间充质组成[3]。羊膜来源的干细胞(Amnion-derived Stem Cells,ADSCs)包括羊膜上皮细胞(Amnion Epithelial Cells,AECs)和羊膜间充质干细胞(Amnion Mesenchymal Stem Cells,AMSCs),见图1。2005年,Miki 等人发表论文描述了AECs的干细胞特性:AECs在在体外有分化成内胚层(肝、胰腺)、中胚层(心肌细胞)和外胚层(神经细胞)三个胚层的潜力[4]。2007年第一届胎盘来源干细胞的国际研讨会明确指定AECs和AMSCs均为胎盘可获取的干细胞[5]。近年来,研究发现,ADSCs具有其他干细胞无法比拟的优势,如可再生性、多分化潜能、无致瘤性/无免疫原性、无伦理或法律问题以及其强大的旁分泌作用,尤其是免疫调节作用[6]。这些优势使羊膜来源的干细胞成为治疗多种疾病的“种子细胞”[7-9]。
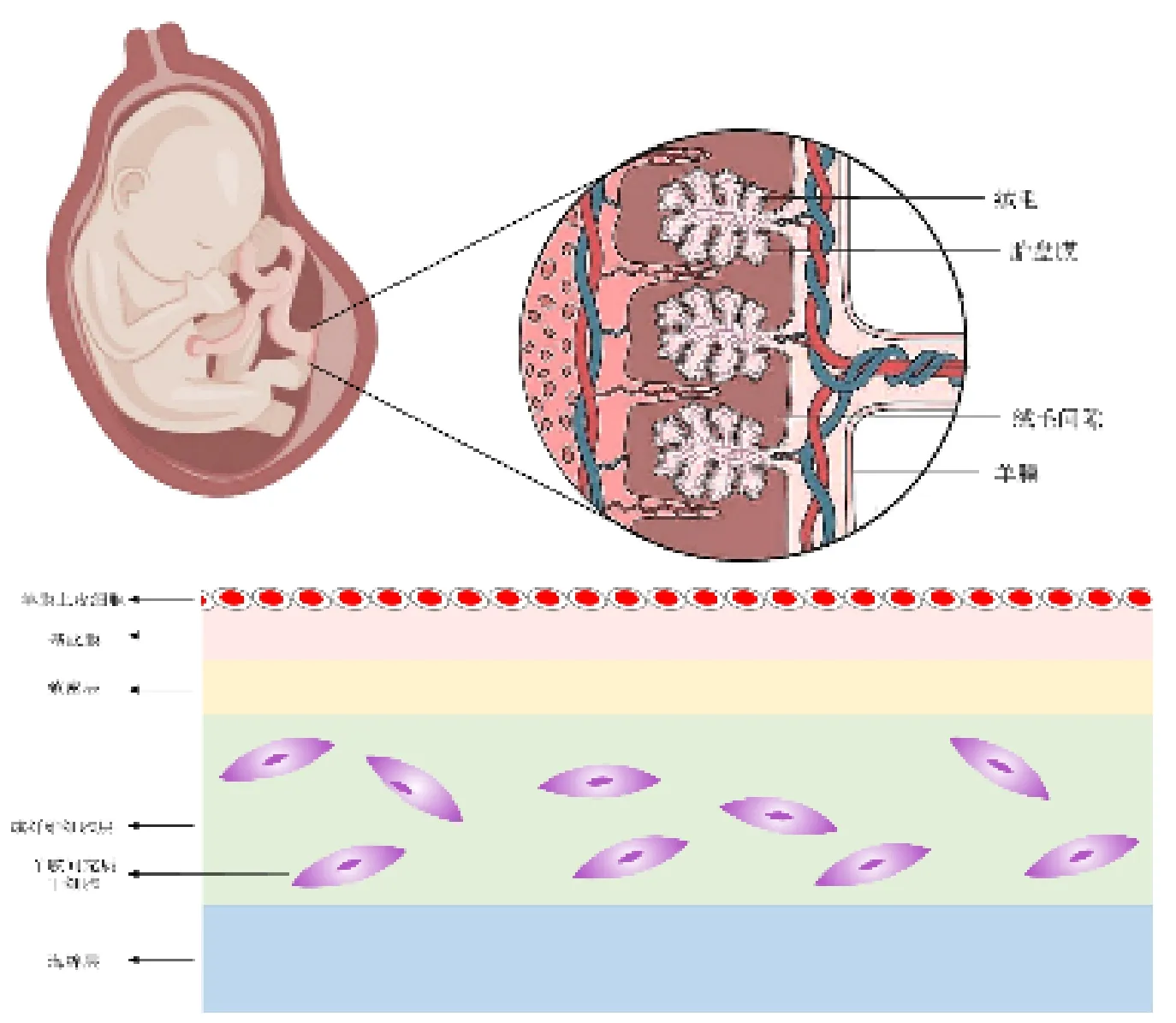
图1 羊膜及羊膜干细胞示意图
AECs和AMSCs表达胚胎干细胞和间充质干细胞的各种标记,具有低免疫原性和无致瘤性。AMSCs特异性表达Nanog、Oc4和CD29等多种标记,但不表达CD34和CD133[10]。同时,羊膜干细胞也能表达CD90、CD44、CD73 和 CD105 等经典间充质干细胞(MSCs)标记物,但缺乏 CD45、CD34、CD45、HLA-DR、CD80、CD86 等细胞表面标记物,这提示二者具有特殊的免疫调节能力[5]。
近年来,多项临床前研究表明,羊膜来源的干细胞对妇科疾病、神经系统疾病、脑损伤、肺病、肝病、肿瘤、皮肤病、骨病、心血管疾病、炎症性肠病、肾病、糖尿病、自身免疫疾病等多种疾病具有潜在的治疗效果[11],见图2。
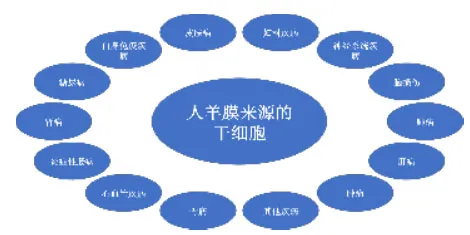
图2 人羊膜来源的干细胞对多种疾病具有潜在治疗效果
2 羊膜间充质干细胞的免疫调节作用
众所周知,组织损伤会引起一系列导致炎症反应的分子和细胞事件发生。炎症过程包括在胞外调节因子(细胞因子和趋化因子)的控制下招募免疫细胞到受损部位。被招募的免疫细胞有单核细胞、巨噬细胞、中性粒细胞,树突状细胞,T细胞和B细胞,见图3。

图3 组织损伤引起的免疫细胞招募
在损伤组织再生的过程中,炎症作为一种重要的防御性反应起着关键作用。消除炎症是修复的必经之路,持续的慢性炎症会造成组织损伤过度,导致包括纤维化和自身免疫性疾病在内的一系列症状。羊膜细胞及其衍生物可以通过作用于不同的炎症介质达到消炎的目的。
2.1 促进多种细胞因子、趋化因子和抗炎细胞因子的分泌
细胞因子和趋化因子是炎症的早期调节因子。它们由受损组织的细胞和随后被招募到受损部位的免疫细胞产生,并提供分子信号来协调免疫细胞迁移,激发免疫细胞活化。细胞因子和趋化因子产生的减少会下调炎性细胞向炎症部位的招募,从而抑制炎症传播。新近很多课题组报道了羊膜细胞条件培养基对CD3+的T淋巴细胞增殖抑制具有剂量依赖性[12]。
Bulati 等人研究发现hAMSCs的免疫调节作用依赖于以PDL-1/PD-1轴为基础的细胞间接触[13]。Cargnoni, A.等人研究发现,hAMSCs 和 hAESCs 可以明显降低博来霉素诱导的肺纤维化鼠的促炎症细胞因子水平,其中细胞/生长因子包括单核细胞趋化蛋白-1 (Monocyte Chemotactic Protein 1,MCP-1)、肿瘤坏死因子-α ( Tumor Necrosis Factor,TNF-α)、白 介 素-1(Interleukin-1,IL-1)、干扰素-γ (Interferon-γ,IFNγ)、白介素-6(Interleukin-6,IL-6)和促纤维化的转化生长因子β(Transforming Growth Factor -β,TGF-β)、血小板源性生长因子-α(Platelet Derived Growth Factor-α,PDGF-α)和血小板源性生长因子-β(Platelet Derived Growth Factor-β,PDGF-β)等[14,15]。
羊膜细胞可以通过调整免疫调节因子(如抗炎细胞因子白细胞介素-10, Interleukin-10,IL-10)的产生来促进炎症过程分解,这种免疫调节因子可减轻炎症反应,并在重建组织完整性中发挥重要作用。据报道,在四氯化碳(Tetrachloromethane,CCl4)诱导的肝纤维化小鼠的肝脏中注入hAEC后,IL-10的基因表达增加[16]。
此外,研究表明,用羊水细胞输注胶原诱导关节炎的小鼠,引流的淋巴细胞分泌高水平的IL-10[17]。羊水细胞产生的其他具有免疫调节活性或已被认为可促进正常器官功能恢复的因子包括前列腺素E2(Prostaglandin E2,PGE2)、肝细胞生长因子(Hepatocyte Growth Factor,HGF)、双加氧酶(Dioxygenase, IDO)、人类白细胞抗原(Human Leucocyte Antigen,HLA-G)、转化生长因子β1(Transforming Growth Factor -β,TGF-β 1)和转化生长因子β2(Transforming Growth Factor -β,TGF-β2)以及血小板源性生长因子(Platelet Derived Growth Factor,PDGF)[12,18,19]。其中PGE2、HGF、IDO活性和HLA-G被认为是介导或至少参与了羊水细胞的免疫抑制活性。
2.2 抑制非特异性免疫细胞招募和迁移
通常炎症发生时,中性粒细胞第一个到达修复部位,在检测和清除损伤细胞方面起着至关重要的作用。随后,中性粒细胞停止内流和激活,这对消炎具有积极作用,因为中性粒细胞释放的氧化剂和蛋白酶可能会导致宿主组织损伤和长期炎症。研究表明,hAEC干预能显著减少中性粒细胞浸润到肺[20]。有文献报道,用胶原诱导小鼠关节炎,hAMSC治疗后小鼠的关节内中性粒细胞浸润减少[17],另外在博莱霉素诱导肺损伤小鼠的肺中也有同样报道[21]。由于凋亡的中性粒细胞会释放含有膜联蛋白1的微粒,这是一种对中性粒细胞具有抗迁移作用的蛋白[22],所以加速中性粒细胞凋亡也可以作为一种正反馈回路,进一步抑制中性粒细胞的迁移和募集。
继中性粒细胞后,抗原呈递细胞( Antigen-Presenting Cell, APCs)(如巨噬细胞、树突状细胞和来适应性免疫反应中的淋巴细胞)也被招募到损伤部位,并参与炎症反应。有证据表明,羊膜细胞可以阻碍这些免疫细胞的募集、成熟和增殖。将hAECs移植到多发性硬化症(Multiple Sclerosis, MS)模型小鼠中可以减少中枢神经系统中的单核/巨噬细胞和T细胞浸润,从而减缓临床疾病的进程[18]。用脂多糖(Lipopolysaccharide, LPS)诱导胎羊损伤后,向其大脑注入hAEC,发现炎性小胶质细胞/巨噬细胞减少[23]。体外证据表明,羊膜细胞可以直接作用于单核细胞和APCs。例如,hAECs、hAMSCs及其条件培养基可阻止单核细胞向树突状细胞的分化和成熟[24-26]。
2.3 诱导调节性T细胞生成,抑制T淋巴细胞的激活和增殖
调节性T细胞在炎症的解决中发挥着重要的作用。调节性T细胞是FOXP3基因表达的CD4+ CD25+ T淋巴细胞的一个亚群,通过分泌免疫抑制和促进分解的细胞因子如IL-10和TGF-β来调节免疫应答[27]。在类风湿关节炎、结肠炎和移植物抗宿主病等不同炎症性疾病的临床前研究中,调节性T细胞表现出有益作用[28-30]。羊膜细胞的一个显著特性是它们在体内和体外都能诱导产生调节性T细胞。在胶原诱导关节炎小鼠模型中,hAMSC治疗显著增加了抗原特异性调节性T细胞的生成,这些调节性T细胞具有免疫抑制功能,能够阻止关节炎的进展[17]。也有报道称,调节性T细胞在hAEC介导的巨噬细胞极化和随后博莱霉素诱导的肺损伤的减弱中是必需的[31]。
T淋巴细胞是在细胞免疫中发挥主要作用的淋巴细胞,根据其表面抗原CD4、CD8等的表达的不同,分为CD4+ T淋巴细胞和CD8+ T淋巴细胞。大量文献表明,无论在体内还是体外,羊膜细胞及其衍生物在抑制T细胞增殖和活化中起着重要作用。众所周知,在体外hAECs,hAMSC和羊膜细胞群能够抑制由多种刺激物诱导的T淋巴细胞增殖[19,32,33]。研究表明,来自hAMSCs和hAECs的条件培养基能够发挥与hAMSCs和hAECs相似的作用,抑制活化的T淋巴细胞增殖[34,35]。Bulati 等人观察到 INF-γ诱导的 hAMSC 免疫调节作用依赖于活化的淋巴细胞、细胞间接触和可溶性因子[13]。
Rossi 等人表明 hAMSCs 释放的前列腺素也与淋巴细胞的抗增殖作用有关[12]。 Meesuk等人发现, AMSCs和骨髓间充质干细胞在与活化T细胞共培养时表现出相当程度的免疫抑制作用,AMSCs分泌的吲哚胺2,3-双加氧酶(IDO)与骨髓间充质干细胞具有相同的免疫抑制活性[36]。Morandi等人发现 HLA-G和HLA-E 分子参与了 hAESCs 介导的 T 细胞增殖抑制[37]。 此外,hADSCs 对炎症过程也有免疫调节和免疫抑制作用,包括降低炎症细胞的活性,抑制小胶质细胞的迁移和免疫细胞向损伤部位的募集[7,8]。 ADSCs 还表现出血管生成、细胞保护、抗瘢痕和抗菌性能[38]。
2.4 促进M1型巨噬细胞向M2型转化
一般来说,极化的巨噬细胞通常称为M1和M2,对应巨噬细胞的两种主要的、相反的活动。M1巨噬细胞通过产生促炎细胞因子、趋化因子和活性氧来消除损伤启动因子,从而协调炎症阶段。随后,M2巨噬细胞促进从炎症期到组织修复期的进展,恢复受损的组织结构和完整性[39]。
有趣的是,不同的研究结果均表明巨噬细胞在羊膜细胞的下游免疫抑制作用中起关键作用,并最终改善治疗效果。例如,Murphy等人证明,对于巨噬细胞功能受损的肺纤维化小鼠,hAECs不能发挥修复作用[20]。此外,在博莱霉素诱导的肺损伤实验中,hAEC干预使巨噬细胞向肺部的浸润显著减少[20,21]。此外,未经治疗的患病动物中浸润的巨噬细胞以M1为主,而hAECs处理的动物主要巨噬细胞表型为M2[21,31]。此外,体外研究表明,在解决慢性炎症后的纤维化过程中,巨噬细胞及其向M2型的转换起到了重要的作用。事实上,有报道称,在四氯化碳(Tetrachloromethane, CCl4)诱导的肝纤维化小鼠中,hAECs移植可减少伤口愈合M2巨噬细胞表型诱导形成的肝纤维化[16]。最近,实验证明在皮肤伤口愈合的小鼠模型中,皮下注射来自hAEC的条件培养基可以加速伤口愈合。同样,条件培养基介导的组织修复与定居骨髓群体的调节有关,其特征是减少炎症环境和M1巨噬细胞数量以及诱导M2巨噬细胞[40]。研究证实,羊膜细胞对巨噬细胞具有免疫调节作用。例如,有报道称,在体外单核细胞分化为DC或M1巨噬细胞时,即使在没有任何分化/极化刺激的情况下,hAMSCs也会使单核细胞向抗炎M2巨噬细胞分化[24,40,41]。在hAMSCs或其条件培养基存在下产生的巨噬细胞,抗炎细胞因子IL-10的产生增加,不同促炎因子的分泌减少。这些细胞可诱导具有潜在抑制活性的调节性T细胞[40]。
3 问题与展望
虽然羊膜细胞在再生医学上表现出非常好的修复能力,但是目前的研究还处于比较初期的阶段,大多数研究还集中在动物模型中,临床试验较少。目前的研究仅能表明羊膜细胞在动物模型和少数患者上是安全有效的,大规模的临床试验还没有开展,因此该治疗方法是否具有普适性还需要大量的临床工作支撑。另外,羊膜细胞的制备、质控体系的构建、临床级细胞或衍生物的剂量标准等一系列制度尚未确立,故临床效果可重复性差,不适合大规模进行研究。综上所述,羊膜干细胞应用于临床还有很多工作要做。本研究所致力于羊膜干细胞的制备、质控体系构建等工艺标准化,希望从制剂标准方面为羊膜干细胞的临床应用做出贡献。
