联体共生动物模型在生理学的应用研究进展#
2021-10-12袁顺灵朱悦熊文婕刘文锋
袁顺灵 朱悦 熊文婕 刘文锋△
(1. 湖南师范大学体适能与运动康复湖南省重点实验室,湖南 长沙 410012;2. 中南大学湘雅附属二医院,湖南 长沙 410011)
联体共生(Parabiosis)是指运用外科手术的方法,将两只动物连接在一起,使血细胞和可溶性因子交换,从而改变配对伙伴的全身环境。其灵感来源于自然界中的联体婴儿[1]。关于联体双胞胎的报道可追溯到1100年前,在19世纪初,泰国出现一例生活到63岁联体双胞胎的报道,使联体婴儿再次吸引了人们的眼球[2,3]。1864年,法国生理学家Bert首次用大鼠成功完成人工联体手术[1]。1908年,德国外科医生Sauerbruch和Heyde对该技术进行了复兴,并引入了“parabiosis”一词来指代两动物之间人工建立的共生关系[4]。2005年,Coonboy 等人利用异时联体共生模型,在《NATURE》上发表了《年轻环境使衰老干细胞重新年轻化》的文章,使联体共生模型重回人们视野[5]。从Bert首次造模成功,到现在基于该模型已产生一系列的生理学和医学发现。本文综述联体共生的历史及造模方法,并综述其在各个系统的主要研究进展。
1 联体共生造模方法及演变
造模方法最早由Bert于1864年描述,将大鼠的腹侧面皮肤切开进行连接[1]。这之后,Andresen等人将兔子的耳朵进行连接[6],其他动物如蝾螈、非洲爪蟾也开始应用[7-8]。Demy等人还用囊胚融合产生联体共生斑马鱼[9]。但实验证明,啮齿动物手术后恢复得最好。Conboy等人[10]对当前手术过程做了详细示例(如图1):(A)小鼠手术面剃毛;(B)手术面皮肤切口;(C)分离皮肤下方筋膜;(D)并排俯卧放置,将两只小鼠的背部皮肤聚拢,用皮肤缝合器装订缝合;(E)背部皮肤连接完成;(F)缝合线皮下捆绑关节(肘和膝),以确保连接牢固;(G)翻转露出腹侧皮肤;(H)重复缝合皮肤和关节的过程,完成联体生物对。
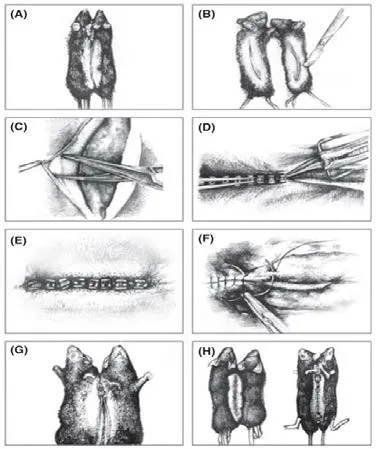
图1 联体手术过程[10]
2 联体共生模型与各系统的研究
2.1 联体共生与神经系统
Villeda等人[11]将年轻的小鼠与年老小鼠联体,实验观察到年轻小鼠的脑神经细胞突触可塑性明显下降,皮层认知功能和空间学习记忆功能亦受到损害。研究证实年轻的小鼠从年老小鼠的血液环境内获得负性调节因子嗜酸粒细胞趋化蛋白CCL11,增加年轻小鼠体内CCL11浓度水平可导致其脑内神经细胞数量减少,损害学习和记忆功能。提示年老系统环境可能会对干细胞功能有害,从而对共生对中年轻小鼠大脑神经的发生不利。中枢神经系统通过髓鞘再生来恢复神经传导和防止轴突变性[12]。然而,中枢神经系统髓鞘再生的效率随着年龄的增长而降低[13]。Ruckh等报道,暴露在年轻系统环境中的老年小鼠可恢复神经干细胞髓鞘再生能力[14]。Francesco等人利用异时联体共生模型发现生长分化因子(Growth Differentiation Factor 11,GDF11)可逆转年龄导致的相关性心肌肥厚[15]。随后GDF11鉴定为“恢复活力的因子”,为神经退行性疾病的治疗提供新的视角[16]。Kim等人发现,通过异时联体共生和注射血浆的方法,将3xTg-AD小鼠暴露于运动小鼠的血液环境中,可改善神经可塑性和线粒体功能并抑制细胞凋亡,最终改善认知功能[17]。基于上述一系列重要的发现,未来应该意识到GDF11和联体共生模型在阿尔兹海默病等神经退行性疾病研究中的价值。
2.2 联体共生与内分泌系统
1969年,Lewis等人[18]将野生型大鼠与具有体质性高血压大鼠联体。结果发现,两大鼠中肾小球高血压的发生频率相同。指出诱发野生型动物高血压的是某种体液因子。此外,他们切除易患高血压的大鼠肾上腺,发现野生型共生大鼠不会产生高血压,这表明该因子是在高血压大鼠的肾脏中产生的。此因子的存在随后在其他研究中也得到证实[19],1993年,Lewanczuk等人将其鉴定为甲状旁腺高血压因子(Parathyroid Hypertension Factor,PHF)[20]。此外,Coleman等人将缺失db基因易于肥胖发展成Ⅱ型糖尿病模型小鼠与非肥胖小鼠组成联体共生模型,观察到野生型小鼠显著减少了食物摄取,而肥胖型小鼠继续增加体重。由此推断必须有一个饱足感因子,只有野生型才能产生响应[21]。30年后Friedman在此基础上,发现了确定饱腹感出现的关键因素——瘦素,瘦素发挥抑制食欲,减少能量摄取,增加能量消耗,已成为调节体重的关键激素之一[22]。
联体共生最突出特点就是联体对之间体液因子的交换。在70年代初,科学家开始将不同年龄的动物进行联体。这种异时共生联体通过将老化的有机体暴露于年轻的系统环境而引起一系列效应。Ludwig等人发现与等时联体对照相比,异时联体中的老年小鼠寿命更长[23]。Conboy等使用异时共生实验,发现源自年轻的系统环境因素能够激活旧生物体的肝脏或肌肉干细胞中的分子信号传导途径,从而导致增殖和组织再生增加。这些结果通过培养含有年幼动物血清的肌肉干细胞得到进一步证实[5]。他们的发现清楚地表明,干细胞功能与年龄相关的损伤在很大程度上是由内环境的组成引起的,而不是仅由细胞内在变化引起的。由此可见,该模型对于研究不同组织和器官衰老的全身体液因素至关重要。
2.3 联体共生与运动系统
早在1959年,Hall等人对患有肌肉营养不良的小鼠与健康小鼠联体共生,就发现可以延长肌肉营养不良的小鼠寿命[24]。Li等发现通过共生可改善营养不良小鼠的骨质量和骨愈合[23]。Wagers等利用小鼠联体共生模型展开研究,观察到年轻小鼠的血液在老年小鼠体内循环,对老年小鼠损伤后的肌肉修复可产生再生效应[25]。相比之下,暴露于旧系统环境的年幼小鼠的肌生长减少[5,26]。此后,又有了一系列延缓骨骼肌衰老的发现。衰老过程中WNT通路改变可改变骨骼肌再生能力[14]。Sinha通过该模型发现睾酮可减轻骨骼肌细胞衰老带来的影响[27]。Gurpreet 等人通过异时联体共生模型,发现在老年小鼠与年轻小鼠建立起血液循环后,长骨的修复的能力和成骨细胞的分化能力都得到了明显的改善。其中β-连环蛋白可促进老年骨折愈合[28]。GDF11除对神经系统产生有益影响外,也可延缓骨骼肌细胞的衰老进程[29],Rochette等人发现,GDF11分子在年轻小鼠血液中自然浓度较高[16]。通过异时共生模型将年轻健康小鼠与具有由衰老引起的骨骼肌细胞功能障碍的老年小鼠联体,发现GDF11能逆转骨骼肌细胞由于衰老引起的功能紊乱[27]。Baht GS等人也证实,血液中较高的GDF11水平可改善肌肉的结构和功能特点,增加肌肉力量[28]。
2.4 联体共生与心血管系统
Francesco等人在小鼠联体4周时观察发现联体共生小鼠中年老小鼠肥大的心肌细胞体积明显缩小,细胞功能也明显恢复。其利用蛋白质组学实验,发现并确认其中起作用的为GDF11。GDF11属于调节细胞生长和分化的转化生长因子-β家族中的一员,是防止和逆转心肌细胞老年性肥大的关键因素,该因子在老年小鼠的血浆中显著降低。指出这可能是未来医学治愈心脏衰老的途径之一[15]。Rochette等研究表明,年龄相关的导致心脏舒张性心力衰竭等正常心脏功能的丧失是由于老年小鼠缺乏某些循环因子所致。他们报道,这种肥大在老年动物通过异时共生而暴露于年轻的系统环境中是可逆转的。他们确定了GDF11是防止心脏肥大的关键因素,此外,还证明GDF11还可舒张脑血管,增强神经发生,改善小鼠大脑功能障碍[16]。
3 联体共生模型的限制与挑战
该模型主要挑战之一是需要良好的手术技术以及手术死亡率的问题[30-31]。通过标准的手术过程和术后护理,可以使联体生物存活率提高到90%以上。另外,与操作无关,存在“联体疾病”的现象,称为“联体中毒”,它导致死亡[32]。这种死亡目前没有得到有效解决,Spencer等的研究提出,可能跟免疫攻击新生的血管吻合有关[33]。1951年Finerty等报道共生生物疾病的发生率可高达20~30%[32]。但此后很多研究都低于这一死亡率。Lu则报道联体生活的小鼠有极好的健康状况,死亡率为零[34]。Ashapkin指出术后死亡率仅1%[35],联体动物存在这样的死亡率差异,可能跟实验条件和术后护理有关。
另外一个有争议的是涉及动物伦理。1990年英国实验动物科学协会提出该模型对动物的伤害后,就影响了该模型的应用[36]。但是Aicher 等指出由于对联体动物的疼痛和痛苦评估的基本原则不同,影响了对该模型的合理评价[37]。基于此,张富祥等人观察联体小鼠的术后生理变化,发现小鼠疼痛持续时间短暂,不至于死亡,并无任何生活质量降低的迹象,直至术后第四个月,小鼠的死亡率均为零[38]。由此可见,随着手术及护理技术水平的提高,前人提出的这样一些问题已经明显得到弱化,能够使该模型更好地服务于科学研究。此外,需要引起重视的是尽管具有潜在价值,但该模型体液因素非常复杂,无法精确控制。血液中多种因素(细胞、蛋白质)的混合更有可能发挥作用。要确定其中一些“神秘因子”,还需要付出很多努力。
4 总结与展望
在一个多世纪中尽管联体共生模型产生了一系列惊人的生理学发现,但是它的应用并不广为人知。此外联体共生动物模型在血液循环因子干预研究中具有巨大潜力,探究这些循环因子将是未来生理学的重要任务之一。我们认为,联体共生是一种应该得到更广泛接受和应用的模型,有能力成为生理学研究中一个变革性的创新性实验范式。
