泛素特异性蛋白酶44在肝细胞癌中的表达及预后价值
2021-10-12王随境赖杰怡张丽红李孜孜张新科陈杰伟
王随境,赖杰怡,张丽红,李孜孜,张新科,陈杰伟
(1.华南肿瘤学国家重点实验室//中山大学肿瘤防治中心病理科,广东广州510060;2.中山大学附属第五医院病理科,广东珠海519000)
原发性肝癌是全球最常见的恶性肿瘤之一,发病率排世界第6位,是全球第3大癌症致死原因[1]。肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌的主要类型,约占85%~90%[2]。尽管我国过去十来年中,HCC发病率和死亡率都有所下降[3],但早期诊断困难、术后复发、转移率高导致肝癌患者普遍预后较差[4]。晚期HCC的5年存活率不足15%[5]。有效的预后指标能够对患者进行分组并指导相应治疗,改善临床预后,但目前尚缺乏敏感性及特异性较好的指标对HCC患者预后作出准确预测[6]。泛素特异性蛋白酶44(ubiquitin specific pro⁃tease 44,USP44)是去泛素化酶(DUBs)中USP家族成员之一,其基本功能是去除靶蛋白的泛素链来避免靶蛋白被26S蛋白酶体降解并以此影响信号转导[7]。USP44被认为是细胞周期进程、基因表达和DNA修复等细胞过程的重要调节因子[8]。在先前的研究中,USP44被发现是一种肿瘤抑制因子,通过去泛素化Cdc20-Mad2复合体来调控纺锤体组装检查点蛋白,防止有丝分裂后期过早的到来;以及调节中心体分离、定位和纺锤体几何形状,防止染色体错误分离,进而抑制肿瘤发生发展[9-11]。近年来,研究者陆续报道USP44表达水平在肺癌、胰腺癌、肾细胞癌等显著下调,表达水平的下降促进了癌细胞增殖和迁移,低表达USP44的患者预后较差[10,12-16]。然而目前USP44在HCC患者中的预后价值未见文献报道。本研究运用免疫组织化学方法检测HCC患者组织中的USP44蛋白表达水平,并通过统计学分析判断与预后的相关性,旨在探讨USP44对HCC患者预后的价值。
1 材料与方法
1.1 病例临床资料收集
收集2000年至2015年在中山大学肿瘤医院行肝癌切除术且经病理确诊的161例HCC石蜡标本及29例相应癌旁组织,构建组织芯片。HCC患者诊断分级参照WHO肿瘤分类标准第四版,临床分期依据美国癌症联合委员会/国际抗癌联盟TNM(tumor-node-metastasis)分期系统(2010版)。病例纳入标准:①患者术前未接受过抗癌治疗;②具有完整的临床病理信息和随访资料,所有患者均随访至2021年3月;③本研究获得中山大学肿瘤医院伦理委员会批准免知情同意。
1.2 免疫组化染色
USP44蛋白的免疫组化染色应用标准Envision法。组织芯片切片4µm,60℃烤片2 h,二甲苯脱蜡,梯度酒精水化,PH 9.0的EDTA高压修复2.5 min,流水冷却后,3%H2O2浸泡10 min消除内源性过氧化物酶,蒸馏水漂洗,一抗USP44兔抗人多克隆抗体(Abcam,ab205032,美国,稀释浓度1:150)37℃孵育50 min,PBS漂洗2 min×5次,二抗(DA⁃KO,k5007,丹麦)37℃孵育30 min,PBS漂洗2 min×5次,DAB显色,流水冲洗,苏木素复染,梯度酒精脱水,二甲苯透明,中性树胶封片。
1.3 荧光免疫组化染色
采用荧光免疫组化染色试剂盒(佰诺全景生物技术有限公司,0061000050,中国)进行荧光免疫组化染色。
同1.2进行常规脱蜡,抗原修复,滴加封闭液(0018001030),室温孵育10 min,一抗USP44(Ab⁃cam,ab205032,美国,稀释浓度1:150)室温孵育30 min,PBS漂洗后,鼠兔通用型HRP标记二抗(0013001015)室温孵育10 min,PBS漂洗,滴加PPD570荧光染料染色工作液(0008100050,信号放大反应液稀释100倍),室温孵育10 min,PBS洗净,EDTA9.0微波修复后使用DAPI工作液(0012100050)复染10 min,PBS洗脱后,浸泡蒸馏水2 min,烤干,用抗淬灭剂封片,橡胶水泥封固四周,室温风柜风干,激光显微镜观察定位。
1.4 免疫组化染色评分
USP44免疫组化染色评分根据阳性肿瘤细胞的百分比和染色强度来评分:1)阳性肿瘤细胞百分比用百分数(%)表示;2)染色强度用(-、1+、2+、3+)表示:“-”为0分,“1+”为100分,“2+”为200分,“3+”为300分;3)阳性肿瘤细胞百分比与强度的乘积就是样本的分数(0~300分)。结果由两位经验丰富的病理医师进行独立评估,如果结果不一致,则由第3位高级病理医师重新阅片评分。本研究使用ROC曲线确定USP44表达水平的截断值[17]。
1.5 统计学方法
所有数据使用SPSS 25.0软件进行统计学分析。运用ROC曲线分析得出USP44表达水平的截断值,Wilcoxon符号秩和检验分析肝细胞癌组织和相应癌旁组织的表达差异,χ2检验分析USP44蛋白高低表达与临床病理参数的相关性。无病生存期(DFS)定义为从肝癌切除术后到复发或死亡的时间;总生存期(OS)定义为肝癌切除术后到癌症相关死亡或最后一次随访的时间。用Kaplan-Meier法绘制生存曲线,采用Log-rank检验比较生存曲线,再用Cox比例风险模型进行HCC患者影响预后的多因素危险因素分析,P<0.05被认为具有统计学意义。
2 结果
2.1 临床病理资料概述
161例HCC患者包括男性138名,女性23名;年龄21~81岁,平均年龄51岁;临床分期Ⅰ~Ⅱ期112例,Ⅲ~Ⅳ期49例;病理分级G1~G2级85例,G3~G4级76例;161例HCC患者详细临床病理资料见表1。
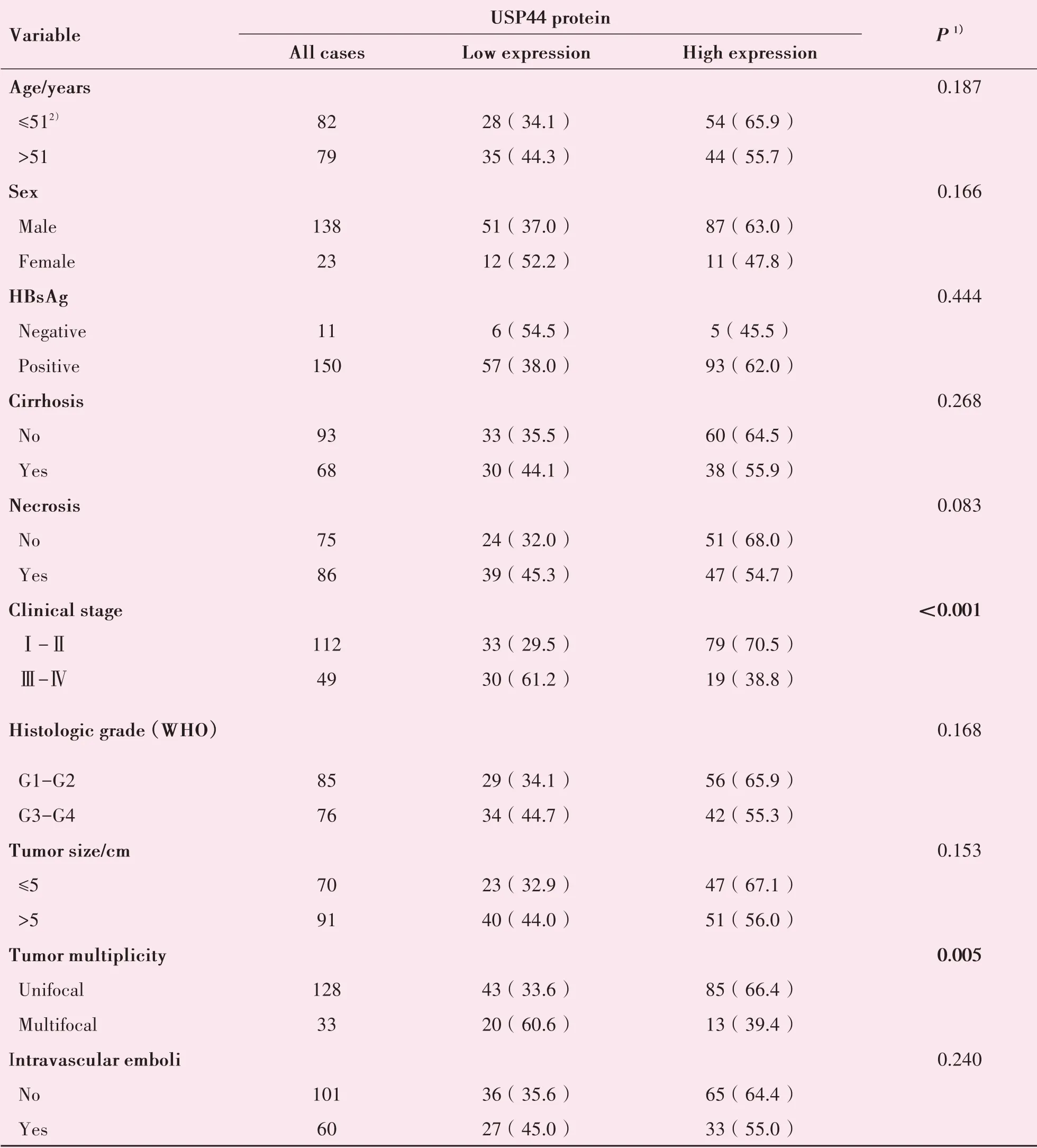
表1 USP44蛋白表达与肝细胞癌患者临床病理参数相关性分析Table 1 Correlation between USP44 protein expression and clinicopathological parameters in 161 patients with hepato⁃cellular carcinoma [n(%)]
2.2 UPS44蛋白在HCC组织及癌旁组织中的表达情况
本研究发现USP44蛋白在HCC中表达以细胞浆为主,可见核浆表达两例(2/161);免疫组化染色强度可见阴性(-)、弱阳性(+)、中等阳性(2+)和强阳性(3+;图1);通过比较肝细胞癌组织与相应癌旁组织的USP44蛋白染色分数,发现USP44在肝癌组织中的表达低于相应癌旁组织(Z=-5.124,P<0.001,图3I),表明USP44在HCC中低表达,提示USP44在肿瘤发生发展中发挥潜在作用。
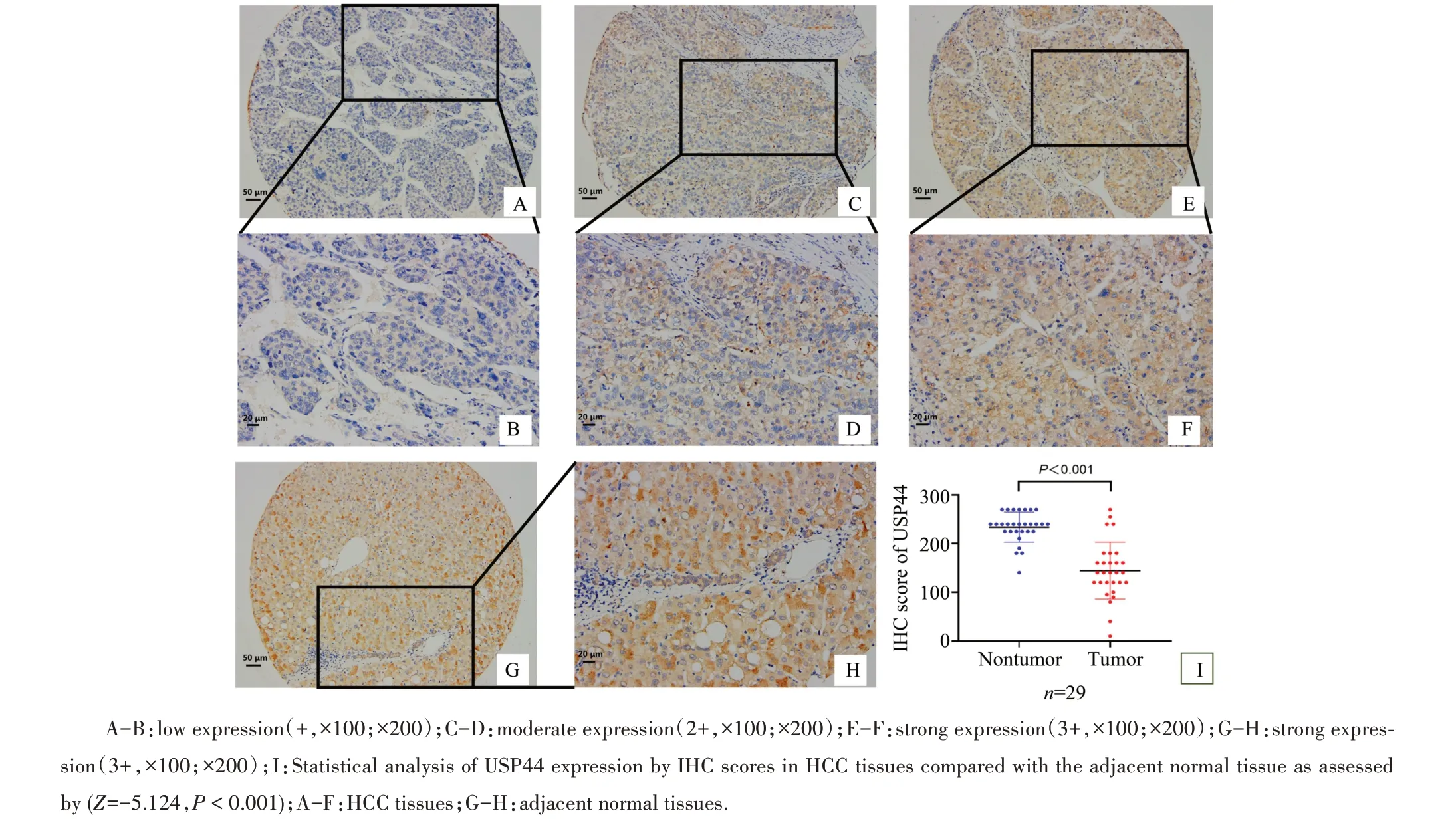
图1 UPS44在肝细胞癌组织及癌旁组织中的表达情况Fig.1 Expression of USP44 protein in hepatocellular carcinoma and adjacent normal tissues
2.3 USP44蛋白荧光免疫组化染色情况
经免疫荧光组织化学染色表明,USP44在HCC组织中主要表达于细胞浆(图2)。
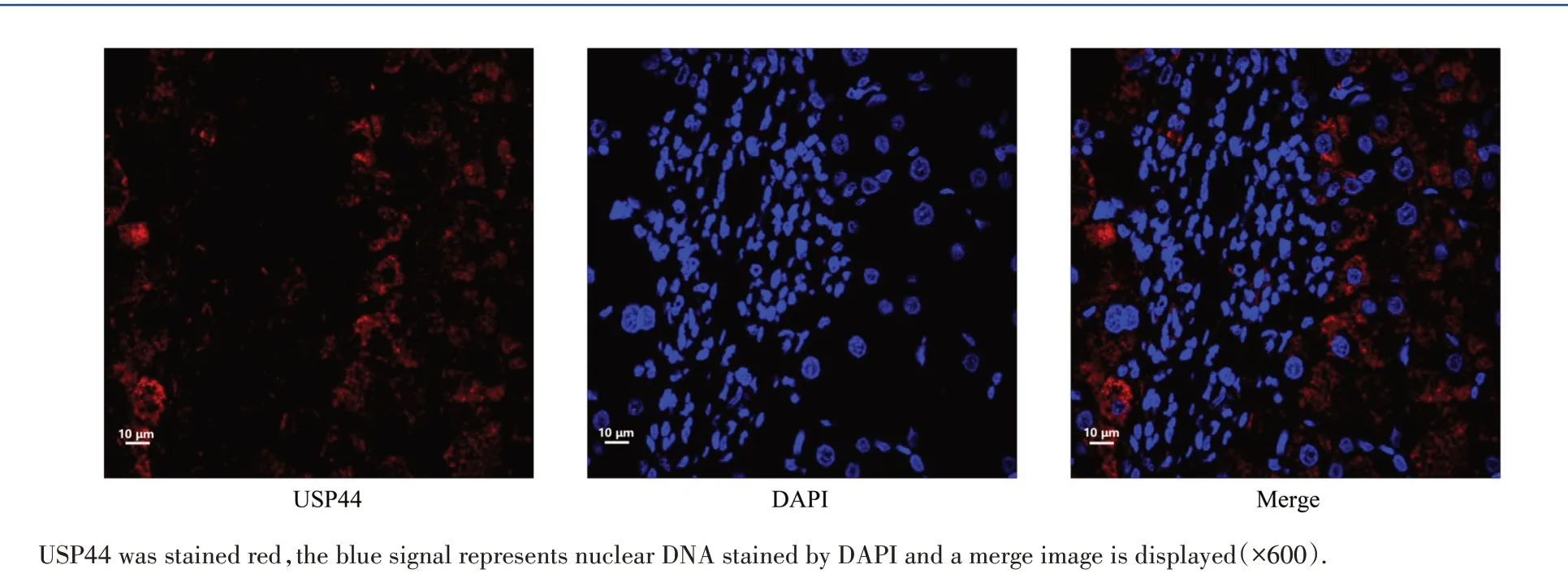
图2 USP44蛋白主要表达于细胞浆Fig.2 USP44 is primarily localized at the cytoplasm
2.4 USP44表达水平的截断值
运用ROC曲线分析方法选择最大敏感度和特异性的点确定为USP44免疫组化评分的截断值。本研究中,对每个临床病理特征的敏感性和特异性进行了绘图(图3),最终选择生存状态作为最佳状态变量,结果显示USP44蛋白表达评分的截断值是145(图3A,AUC=0.630,P=0.006)。因此,定义≥145分为USP44蛋白高表达组,<145分为低表达组,161例HCC患者石蜡组织中60.9%(98/161)存在USP44蛋白高表达。

图3 ROC曲线分析确定肝癌中USP44表达水平截断值Fig.3 ROC curve analysis was employed to determine the cut-off value for USP44 expression in HCC
2.5 HCC患者的USP44蛋白表达情况与临床病理参数之间的关系
经卡方检验分析发现,HCC患者的USP44蛋白表达在临床分期中,Ⅰ+Ⅱ期的高表达的病例明显高于Ⅲ+Ⅳ期(χ2=14.44,P<0.001),肿瘤单发的肝癌患者高表达USP44蛋白的例数明显高于多发患者(χ2=8.04,P=0.005);USP44蛋白的高低表达在患者的不同年龄、性别、肿瘤最大直径、病理分级、有无HbsAg感染、肝硬化、坏死、脉管癌栓中的差异均无统计学意义(P>0.05;表1)。
2.6 USP44蛋白表达及各临床病理参数对HCC患者总生存时间的影响
本研究对可能影响HCC患者生存时间的参数采用Kaplan-Meier法单因素分析发现:临床Ⅰ-Ⅱ期患者的平均生存期(168.0月)长于临床Ⅲ-Ⅳ期患者的平均生存期(62.5月,Log-rankχ2=11.35,P=0.001,图4A);病理G1~G2级患者平均生存期(170.5月)长于G3~G4级患者的平均生存期(71.9月,Log-rankχ2=6.25,P=0.012,图4B);肿瘤多发患者的平均生存期比单发患者短,差异有统计学意义(Log-rankχ2=11.79,P=0.001,图4C);肿瘤最大直径≤5cm的患者相比>5cm的患者,有着更好的生存期(Log-rankχ2=6.78,P=0.009,图4D);此外,坏死(Log-rankχ2=7.15,P=0.008,表2)、脉管癌栓(Log-rankχ2=8.33,P=0.004,表2)及USP44蛋白表达(Log-rankχ2=20.77,P<0.001,表2)与HCC患者总生存期显著相关,而且USP44高表达组相对于低表达组患者有更好的总生存率(Log-rankχ2=20.77,P<0.001,图4E)和DFS(Log-rankχ2=20.42,P<0.001,图4F)。USP44高表达组患者平均生存期为185.0个月,3年生存率为79.6%,5年生存率为62.2%,而USP44低表达组平均生存期仅为59.6个月,3年生存率为47.6%,5年生存率为28.6%(表3)。

表3 USP44蛋白表达对HCC患者三年和五年生存率的影响Table 3 The expression of USP44 for Three-year survival rate and Five-year survival rate
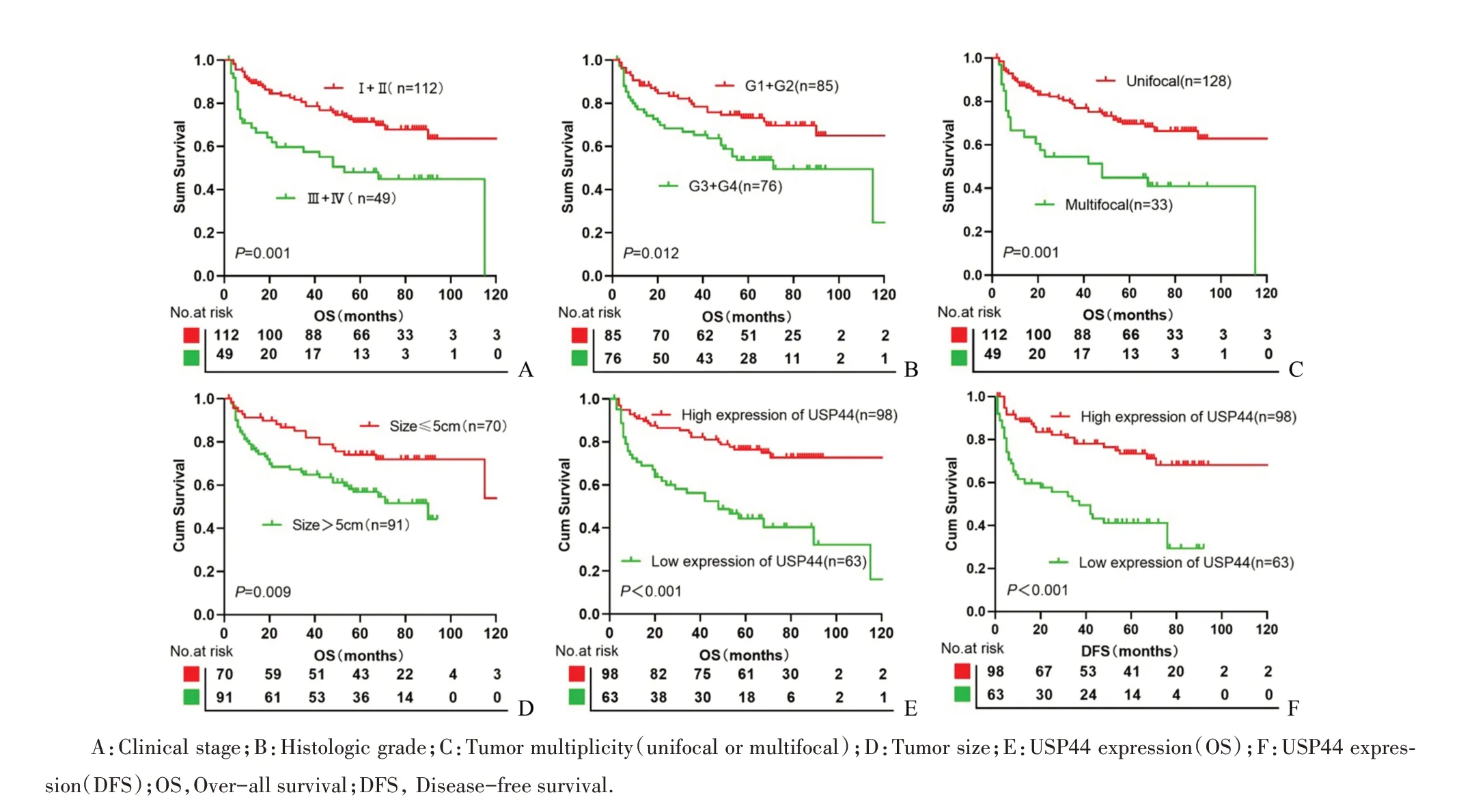
图4 不同预后因素对161例肝细胞癌患者生存时间的影响Fig.4 Different prognostic factors for survival outcome in 161 patients with HCC

表2 单变量分析USP44蛋白表达及临床病理参数在161例肝细胞癌患者预后的意义Table 2 Analysis of USP44 protein expression and clinicopathological parameters in the prognosisof 161 patients with hepatocellular carcinoma
为研究USP44蛋白表达对不同亚组HCC患者生存的影响,进一步分析了USP44在不同临床分期、病理分级患者中的表达情况,结果显示USP44蛋白表达是临床Ⅰ~Ⅱ期(Log-rankχ2=4.81,P=0.028,图5A),Ⅲ~Ⅳ期(Log-rankχ2=10.13,P=0.002,图5B)及病理分级G1-G2级(Log-rankχ2=20.73,P<0.001,图5C)亚组患者的预后因素。
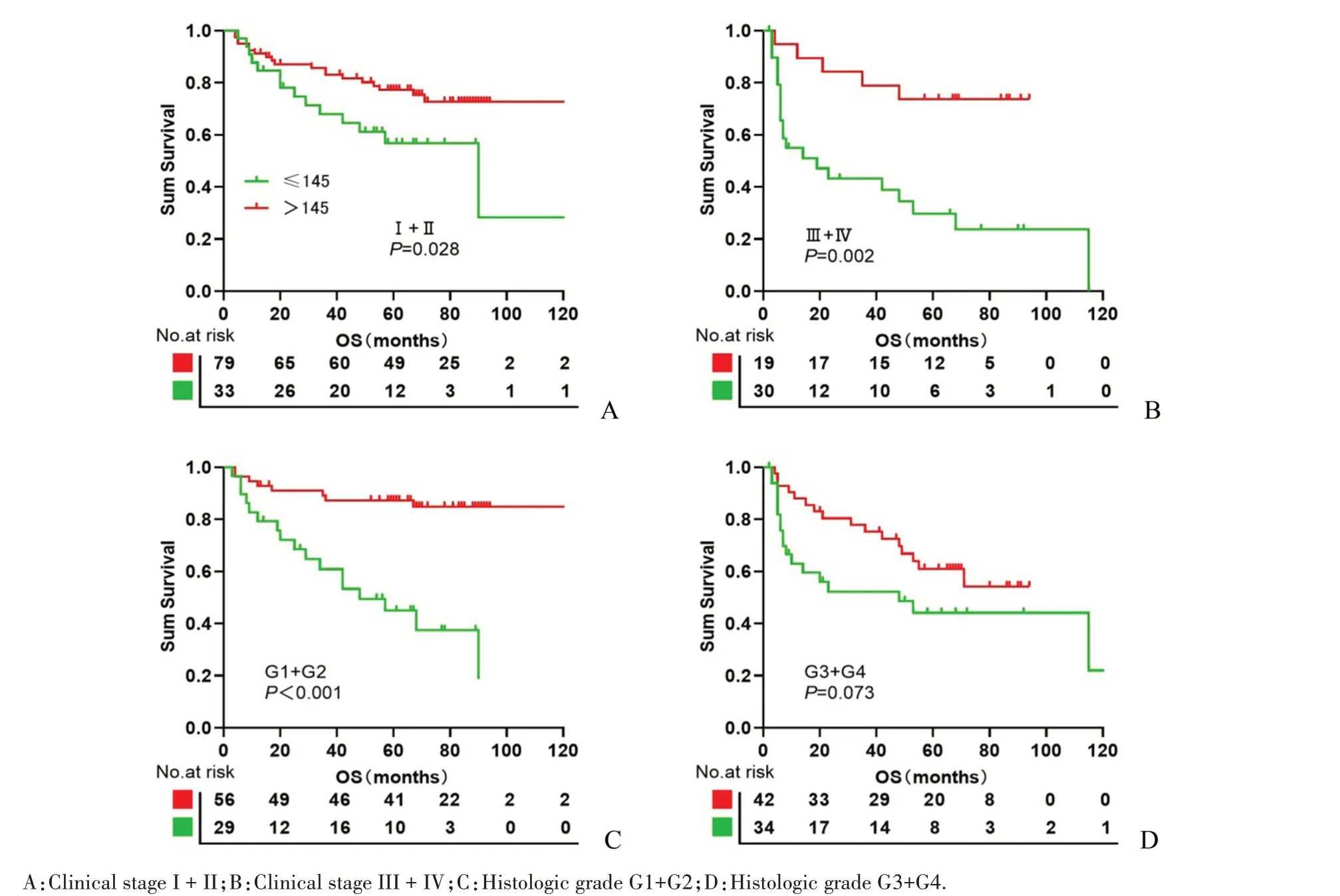
图5 不同临床分期和组织学分级的肝细胞癌患者中USP44表达的Kaplan-Meier生存分析Fig.5 Kaplan-Meier survival analysis of USP44 expression in subsets of HCC patients with different clinical stage and Histologic grade
2.7 肝细胞癌患者的独立预后因素分析
将有意义的临床参数引入多变量Cox回归分析,结果显示临床分期及USP44蛋白表达水平是HCC患者的独立预后因素(HR=1.750,95%CI(1.026,2.985),P=0.040;HR=0.363,95%CI(0.213,0.620 ),P<0.001;表4)。
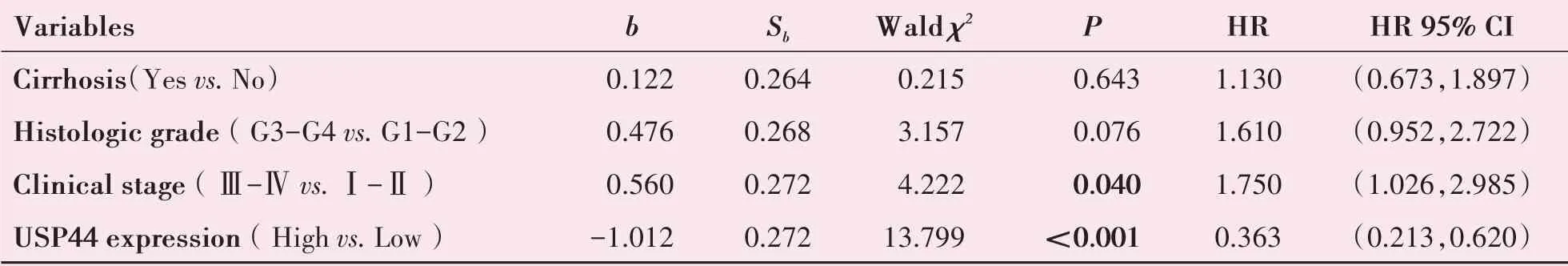
表4 多变量Cox回归分析鉴别HCC患者的预后因素Table 4 Multivariate cox regression analysis identify prognostic factors for HCC patients
3 讨论
USP44是一种具有ZnF-UBP结构域的去泛素化酶,具有保守的半胱氨酸、组氨酸和天冬酰胺/天冬氨酸残基[18]。据报道,USP44在许多细胞过程中发挥作用,如细胞增殖、免疫、调节细胞周期、炎症反应、细胞自噬、基因表达与抑制、DNA修复及肿瘤发生等[19-22]。然而,USP44在肝细胞癌中的临床病理学意义尚不清楚。
在本研究中,我们用免疫组化方法检测了161例肝细胞癌组织及部分相应癌旁组织中USP44蛋白的表达情况,并经过ROC曲线分析得出一个客观的截断值来区分USP44高低表达组。经Wilcox⁃on符号秩和检验分析发现USP44在HCC中低表达,提示USP44在肿瘤发生发展中发挥潜在作用。经卡方检验显示,USP44的表达情况与临床分期、肿瘤单灶及多灶性存在显著相关。单因素Kaplan-Meier分析表明,USP44蛋白的表达对HCC患者生存有显著影响,低表达USP44的HCC患者预后不良,进一步多变量Cox回归分析发现USP44是HCC患者的有效独立预后因素。本研究结果初步提示USP44在肝细胞癌中扮演着抑癌的角色。
有研究发现,USP44通过去泛素化Cdc20-Mad2复合体来调控纺锤体组装检查点蛋白防止有丝分裂后期过早的到来,以及调节中心体分离、定位和纺锤体几何形状防止染色体错误分离,进而抑制肿瘤进展[9-11]。Yang等[13]研究发现,USP44在胰腺癌患者中表达下调,且USP44表达情况与预后成正相关。Huang等[15]发现,USP44的过表达抑制了大肠癌细胞的增殖,同时促进了细胞的凋亡,提示USP44在大肠癌中是一种抑癌基因。Zhou等[16]发现,USP44通过抑制肾透明细胞癌中的JNK通路来抑制细胞增殖和迁移,USP44的表达与肿瘤分期、病理分级呈负相关,且高表达USP44的患者有着更长的生存期。以上研究提示USP44在肿瘤发生发展中起到抑癌基因的角色,这与我们的研究结果一致。然而,有研究人员提出USP44通过稳定肿瘤启动子securin促进胶质瘤的恶性程度[23]。乳腺癌中,USP44在肿瘤干细胞(CSC)亚群中上调,并通过诱导血管生成拟态形成而促进癌症的进展、侵袭和转移[24]。USP44通过EZH2蛋白稳定化促进前列腺癌细胞的肿瘤发生[25]。这些发现提示USP44的过度表达可能与某些肿瘤的进展有关;表明USP44作为去泛素化酶,可以通过稳定生物体中的不同蛋白底物来发挥功能,在肿瘤发生发展过程中具有两面性。
本研究中,经免疫组织化学分析及免疫荧光染色进一步的验证,发现USP44在肝细胞癌中多数表达于细胞浆,提示USP44可能在细胞信号通路过程在细胞浆中发挥抑癌作用。既往研究发现,在非小细胞肺癌中USP44通过去泛素化PTEN蛋白,抑制PI3K/AKT途径中信号传导,从而抑制癌细胞生长[12];在结直肠癌中,USP44通过去泛素化胞浆支架蛋白Axin使Wnt/β-catenin途径失活,从而抑制大肠癌细胞的增殖,同时促进细胞凋亡[15]。而在胰腺癌FBP1-MAPK途径中,USP44通过去泛素化FBP1蛋白来抑制糖酵解,从而抑制癌细胞生长,并调节吉西他滨耐药性[13]。FBP1拮抗糖酵解过程是通过其胞浆催化活性来实现的[26]。而在肝细胞中FBP1缺失会导致代谢异常和脂肪变性,由此引起的非酒精性脂肪性肝病是导致HCC的重要诱因[26]。由此推测USP44是否也是通过去泛素化FBP1蛋白来抑制肝癌细胞生长,这是一个值得探索的问题。此外,有研究发现细胞质中USP44在DNA病毒感染后会被招募到干扰素基因刺激蛋白(MITA)处,并从MITA中去除K48连接的多泛素链,从而阻止MITA蛋白酶体介导的降解,对DNA病毒诱导的先天免疫应答起正向调节作用[21];而慢性感染乙型肝炎病毒(HBV)是肝癌发生的重要危险因素。因此,我们推测USP44在肝细胞癌发生发展过程中起着调节细胞增殖和抗病毒的双重作用。有趣的是Kang等[27]发表的文章提示USP44可能是存在血清中,通过挖掘敏感性较高的方法在血液中检测USP44的表达,并通过高通量队列验证其为血清学的潜在的标记物,是一个值得进一步探讨的问题。本研究为单中心的研究,具有一定局限性,有待以后进行多中心研究,扩大样本量,并深入研究其在肝癌发生发展中的作用机制。
综上所述,USP44是HCC患者的独立预后危险因素,是肝细胞癌患者预后良好的生物标志物。USP44蛋白的表达可作为筛选预后良好的肝细胞癌患者的一种手段,我们的研究可能为USP44成为肝细胞癌治疗的潜在靶点提供证据。
