高脂饮食诱导APPswe/PS1ΔE9小鼠脑内炎症反应及细胞焦亡损伤神经功能
2021-10-12宋祯彦李富周贺春香于文静成绍武
李 泽,宋祯彦,李富周,贺春香,杨 苗,于文静,成绍武
(湖南中医药大学中西医结合心脑疾病防治湖南省重点实验室,湖南长沙410208)
阿尔茨海默病(Alzheimer′s disease,AD)是世界范围内最常见的老年神经退行性疾病,表现为记忆和认知障碍的进行性丧失[1]。随着社会发展和人类饮食结构的丰富,肥胖逐渐成为全球性健康问题[2]。研究表明,肥胖与慢性全身性炎症有关,且与认知能力下降的风险增加相关[3]。中年肥胖会导致中枢神经系统长期处于慢性炎症状态,影响大脑的认知功能,也是痴呆发病率和严重程度的一个强有力的预测因子[4]。长期慢性神经炎症促进AD疾病发展[5],过多激活态小胶质细胞可以导致突触丧失,并分泌伤害神经元的炎症因子[6]。目前已有研究表明高脂饮食能够引起野生型小鼠炎性反应增强和APP/PS1小胶质细胞炎性激活[3,7-8],提示炎症反应可能是高脂饮食导致认知功能障碍的关键因素。细胞焦亡通路为AD的主要病理改变之一,是一种新型的促炎细胞死亡程序,特征为依赖半胱氨酸蛋白酶(caspase)的程序性细胞死亡途径[9],导致细胞膜穿孔,进而肿胀、破裂和死亡,释放促炎症的胞内细胞因子[10]。高脂饮食和炎性反应以及阿尔兹海默病之间的病理关系尚不明确,本文分别对C57BL/6J普通小鼠和APP/PS1痴呆小鼠喂食高脂饲料后,观察其脑内海马区病理变化情况、炎症反应及细胞焦亡变化,探究高脂饮食、神经炎症和阿尔兹海默病之间的关系。
1 材料与方法
1.1 动 物
SPF级APP/PS1双转基因雄鼠12只,6月龄,体质量(20±5)g:购自北京华阜康生物科技有限公司,许可证号为SCXK(京)2014-0004,C57BL/6J雄鼠12只,6月龄,体质量(20±5)g:购自湖南斯莱克景达实验动物有限公司,许可证号为SCXK(湘)2015-0010,饲养于湖南中医药大学第一附属医院SPF级动物实验室,经繁育培育至12月龄。室内温度20℃~24℃,相对湿度35%~45%,室内光线12 h明暗交替,所有实验过程对动物处置符合湖南中医药大学第一附属医院动物实验室动物伦理学要求(伦理编号:LLBH-20191231003)。
1.2 药物及试剂
尼氏染色液(Nissol stain,焦油紫法)、DAPI染色液(C0065)、Triton X-100(T8200)购自中国索莱宝公司;一步法TUNEL细胞凋亡检测试剂盒(C1088)、SDS-PAGE蛋白上样缓冲液(SDS-PAGE Sample Loading Buffer,5×,P0015L)购自中国Beyo⁃time公司;RIPA裂解液(RIPA Lysis Buffer,01408/504074)、蛋白酶抑制剂混合物(CW2200)购自康为世纪生物科技有限公司;BCA蛋白定量分析试剂盒(BCA Protein Assay Kit,NCI3227CH)、荧光二抗驴抗兔(A21206)购自美国Thermo Fisher公司;一抗caspase-1(bs-10442R)、NALP3(bs-10021R)和βactin(bs-0061R)购自北京博奥森生物有限公司;一抗Iba-1(SAF5299)购自日本Wako公司;山羊抗兔二抗(SA00001-2)购自武汉三鹰生物技术有限公司;通用二步法检测试剂盒(小鼠/兔增强聚合物法检测系统)(PV9000),购自北京中杉金桥生物技术有限公司;逆转录试剂盒(NovoScript®Plus All-inone 1st Strand cDNA Synthesis SuperMix,gDNA Purge,E047-01B)购自中国近岸蛋白质科技有限公司。高脂饲料D12492,能量来源:60%猪油脂肪,20%蛋白质,20%碳水化合物,购自美国Research Diets公司。
1.3 仪 器
ChemiDocXRS+化学发光凝胶成像仪(美国BIO-RAD公司);石蜡切片机(Thermo Scientific,美国);Axio Vert.A1倒置荧光显微镜(德国ZEISS)公司);Medifuge™小型台式离心机(美国ThermoFisher公司);Cytation3多功能酶标仪(美国BioTek公司);显微成像系统(Motic,中国);TissueFAXS成像系统(Tissue Gnostics GmbH,奥地利);A1+共聚焦激光显微镜(日本Nikon公司)。
1.4 方 法
1.4.1 实验动物分组 12月龄C57BL/6J小鼠和APP/PS1雄性小鼠,按体质量随机分为4组,正常组(普通C57BL/6J小鼠n=6)、普通高脂组(C57BL/6J+高脂饲料n=6)、痴呆组(APP/PS1小鼠n=6)、痴呆高脂组(APP/PS1小鼠+高脂饲料n=6)4组;正常组和痴呆组,普通饲料喂养6周;普通高脂组和痴呆高脂组,高脂饲料喂养6周。每周记录小鼠体质量变化情况。
1.4.2 动物组织处理 麻醉给予100 mL/L水合氯醛腹腔注射后,常规消毒开胸,用预冷的生理盐水从心脏左心室灌注,排空血液后断头取脑。于冰板上分离小鼠左右脑,右脑用40 mL/L多聚甲醛固定48 h,依次经750、850、950 mL/L,无水乙醇脱水,再用二甲苯透明处理后浸蜡,石蜡包埋切片。左脑分离大脑皮质、海马,液氮速冻,-80℃保存。
1.4.3 尼氏染色海马神经元尼氏小体检测 选取备用石蜡切片,各组6只小鼠,每只选择3张切片,65℃烘烤3 h后依次放入二甲苯Ⅰ15 min、二甲苯Ⅱ15 min、无水乙醇5 min、950 mL/L乙醇5 min、850 mL/L乙醇5 min、750 mL/L乙醇5 min和纯水清洗。用尼氏染色试剂盒进行焦油紫尼氏体染色,焦油紫试剂染色56℃,1 h。纯水清洗后滴加分色液5 s,后经无水乙醇脱水、二甲苯透明,中性树脂封片,显微镜下观察。
1.4.4 免疫组化小胶质细胞激活检测 脑组织切片脱蜡处理同上述尼氏染色,后续用30 mL/L H2O2内源性过氧化物酶阻断后,加入90 mL/L蚁酸修复处理5 min。50 mL/L马血清封闭30 min后滴加Iba-1Ⅰ抗(1:100),4℃过夜孵育,通用二步法检测试剂盒滴加滴加100µL反应增强液,室温孵育20 min;继续滴加100µL增强酶标羊抗小鼠/兔IgG聚合物,室温孵育20 min。加入100µL DAB显色液,室温孵育5~8 min,自来水冲洗,苏木素染色液孵育20 s,分化、冲洗返蓝后梯度乙醇脱水、二甲苯透明、中性树脂封片。显微镜下观察海马区Iba-1小胶质细胞激活情况,每只小鼠选择3张海马区切片染色,每张切片选取均匀同等大小5个视野,Im⁃ageJ软件计算分析每只小鼠海马区Iba-1阳性细胞数量。
1.4.5 RT-PCR检测海马区IL-1β、IL-6和TNF-α炎症因子表达水平 取小鼠脑组织分离海马,Trizol法提取海马区总RNA,逆转录试剂盒将提取的RNA逆转录为cDNA后-20℃保存。伯乐CFX96 Real-time PCR系统SYBR荧光染料法进行RT-PCR检测,IL-1β正向引物(5’→3’)为TCG⁃CAGCAGCACATCAACAAGAG,反向引物(3’→5’)为TGCTCATGTCCTCATCCTGGAAGG;IL-6正向引物(5’→3’)为CTCCCAACAGACCTGTCTATAC,反向引物(3’→5’)为CCATTGCACAACTCTTTTCT⁃CA;TNF-α正 向 引 物(5’→3’)为GTCT⁃CAGCCTCTTCTCATTCC,反向引物(3’→5’)为CTACAGGCTTGTCACTCGAA。β-Actin正向引物(5’→3’)为AAGTGTGACGTTGACATCCG,反向引物(3’→5’)为TCTGCATCCTGTCAGCAATG。反应条件:95℃,5 min;95℃,15 s;58℃,15 s,40次循环。以2-∆∆ct定量分析IL-1β、IL-6、TNF-α的mRNA表达水平。
1.4.6 免疫荧光TUNEL、caspase-1染色检测细胞焦亡 脑组织切片脱蜡处理同上述尼氏染色,30 mL/L H202孵育10 min后,2.5 mL/L胰酶消化10 min。50 mL/L马血清封闭1 h后滴加caspase-1Ⅰ抗(1:100),4℃过夜孵育,一步法TUNEL细胞凋亡检测试剂盒避光孵育TUNEL染液37℃1 h,荧光Ⅱ抗Alexa Flour 488避光复染室温1 h,DAPI染液孵育5 min,抗荧光淬灭剂封片。共聚焦激光显微镜成像,观察痴呆小鼠海马区TUNEL、caspase-1共染色情况,每只小鼠选择3张海马区切片染色,每张切片选取相同区域同等大小5个视野,ImageJ软件计数每只小鼠海马区TUNEL、caspase-1共染色阳性细胞数量。
1.4.7 Western blot检测海马NLRP3、caspase-1表达情况 分离海马组织用RIPA法裂解,超声断裂DNA后12 000 r/min(r=5 cm),4℃离心15 min,取上清BCA法测定蛋白浓度,蛋白上样量20µg/孔,100 V电压电泳80 min,0.45µm PVDF膜200 mA,转膜90 min,50 mL/L脱脂牛奶封闭1 h后孵育一抗:TBST(1:1 000),β-Actin为内参蛋白,4℃孵育过夜。孵育二抗:TBST(1:10 000),37℃1 h。ECL化学发光法显影,Gel Doc XR+凝胶成像系统成像计算灰度值统计分析。
1.5 统计学方法
采用SPSS 26.0、Stata 16.0进行数据的统计与分析,计量资料满足正态分布用均数±标准差表示,运用2×2析因设计析对多因素交互作用进行统计学分析,二因素方差分析多组间差异,对不同时间结果进行重复测量方差分析,后用Bonferroni法多重比较;对单因素两组间差异应用独立样本t检验进行统计学分析。P<0.05为差异具有统计学意义。
2 结 果
2.1 高脂饮食小鼠体质量变化
监测各组小鼠体质量周变化如图1所示,重复测量方差分析,不同时间体质量变化F=9.131,P=0.000,差异有统计学意义;时间与组别P>0.05,二者无交互作用。不同组别间体质量变化P>0.05,差异无统计学意义。

图1 高脂饮食对各组小鼠体质量影响Fig.1 Effects of high fat diet on body weight of mice in each group
2.2 高脂饮食增强痴呆小鼠海马区炎性小胶质细胞激活
各组小鼠脑内海马区Iba-1免疫组化小胶质细胞激活情况如图2所示,各组小胶质细胞Iba-1染色数量经2×2析因设计分析和Bonferroni多重比较分析,高脂饮食主效应(F=13.969,P=0.005),APP/PS1基因主效应(F=57.657,P=0.000),高脂与APP/PS1基因交互作用(F=8.290,P=0.018),差异有统计学意义。痴呆小鼠和普通小鼠的小胶质细胞激活会因使用高脂饲料而有显著的差异,食用高脂饲料的痴呆小鼠,比正常饲料的痴呆小鼠均值高43.717(P=0.009),95%置信区间为(11.247,76.186);食用高脂饲料的痴呆小鼠,比正常饲料的普通小鼠均值高74.867(P=0.000),95%置信区 间 为(42.397,107.336 )。

图2 高脂饮食增强痴呆小鼠海马区Iba-1阳性细胞的数目Fig.2 High fat diet enhanced the number of Iba-1 positive cells in the hippocampus of dementia mice
2.3 高脂饮食增强小鼠海马炎性因子表达
对各组小鼠脑内海马区炎性因子IL-1β、IL-6、TNF-αmRNA表达水平进行RT-qPCR检测分析,结果如图3所示。经2×2析因设计和Bonferroni多重比较分析,IL-1β高脂饮食主效应(F=39.553,P=0.000),APP/PS1基 因 主 效 应(F=24.289,P=0.000),高脂与APP/PS1基因交互作用(F=6.993,P=0.023),差异有统计学意义。痴呆小鼠和普通小鼠IL-1βmRNA水平会因使用高脂饲料而有显著的差异,食用高脂饲料的痴呆小鼠,比正常饲料的痴呆小鼠均值高0.997(P=0.001),95%置信区间为(0.440,1.553);食用高脂饲料的痴呆小鼠,比正常饲料的普通小鼠均值高1.255(P=0.000),95%置信区间为(0.757,1.753)。IL-6高脂饮食主效应(F=10.267,P=0.008),差异有统计学意义,APP/PS1基因主效应(P>0.05),高脂与APP/PS1基因交互作用(P>0.05),差异无统计学意义。喂食高脂饲料较普通饲料IL-6均值高0.455,95%置信区间为(0.146,0.764)。TNF-α高脂饮食主效应(F=15.956,P=0.003),APP/PS1基因主效应(F=62.339,P=0.000),差异有统计学意义,高脂与APP/PS1基因交互作用(P>0.05),差异无统计学意义。喂食高脂饲料较普通饲料TNF-α均值高0.515,95%置信区间为(0.223,0.806)。痴呆小鼠较普通小鼠TNF-α均值高1.017,95%置信区间为(0.726,1.308)。

图3 高脂饮食上调痴呆小鼠海马区炎性因子IL-1β、IL-6、TNF-αmRNA表达Fig.3 High fat diet up-regulated the mRNA levels of inflammatory factors IL-1β,IL-6 and TNF-αin thehippocampus of dementia mice
2.4 高脂饮食对海马神经细胞的影响
各组小鼠脑部海马CA1区尼氏染色如图4所示,正常组海马CA1区神经元排列整齐紧密,细胞分布均匀,胞内尼氏体充盈丰富;普通高脂组神经元排列较为紊乱,胞内尼氏体明显减少,着色较浅,胞体肿胀扩张,呈空泡状,神经元损伤,代谢功能减弱;痴呆组和普通组相比,神经元排列稀疏,胞内尼氏体染色浅,尼氏体数量明显减少,细胞形态大小不一,可见不同程度神经元损伤;痴呆高脂组较痴呆组神经细胞稀疏,胞体边界不清,尼氏小体更为稀少,表明神经元损伤进一步加剧。

图4 高脂饮食对不同小鼠海马神经细胞组织病理学的改变Fig.4 Histopathological changes of hippocampal nerve cells in different miceinduced by high fat diet
2.5 高脂饮食对海马区NLRP3、caspase-1蛋白表达的影响
Western blot测定各组小鼠海马NLRP3、cas⁃pase-1蛋白表达如图5所示,各组蛋白表达相对值经2×2析因设计和Bonferroni多重比较分析,NLRP3高脂饮食主效应F=25.256,P=0.001;APP/PS1基因主效应F=38.629,P=0.000,差异有统计学意义。高脂与APP/PS1基因交互作用P>0.05,差异无统计学意义。喂食高脂饲料较普通饲料NLRP3相对表达量均值高0.074,95%置信区间为(0.40,0.108)。痴呆小鼠较普通小鼠NLRP3相对表达量均值高0.092,95%置信区间为(0.058,0.126)。
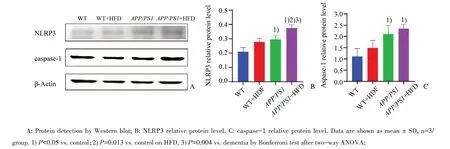
图5 高脂饮食对不同小鼠海马区NLRP3、caspase-1蛋白水平的影响Fig.5 Effects of high fat diet on NLRP3 and caspase-1 protein levels in hippocampus of different mice
caspase-1高脂饮食主效应P>0.05;APP/PS1基因主效应F=24.935,P=0.001,高脂与APP/PS1基因交互作用P>0.05,差异无统计学意义。痴呆小鼠较普通小鼠caspase-1相对表达量均值高0.937,95%置信区间为(0.504,1.369)。
2.6 高脂饮食影响痴呆小鼠海马区神经细胞焦亡
对痴呆组和痴呆高脂组脑部海马区进行TU⁃NEL、caspase-1共定位荧光染色结果如图6所示,经独立样本t检验分析,痴呆高脂组较痴呆组小鼠脑内caspase-1和细胞凋亡增加,且共定位表达显著增强(t=-3.780,P=0.019),差异有统计学意义。

图6 高脂饮食对痴呆小鼠海马区TUNEL和caspase-1阳性信号的影响Fig.6 Effects of high fat diet on TUNEL and caspase-1 co-positivity in hippocampus of dementia mice
3 讨 论
肥胖被认为是AD的重要危险因素,研究支持高脂饮食引起的肥胖症会加速AD小鼠模型中与AD相关的病理生理和记忆障碍[11-12],能够引起啮齿类动物血外周炎症增强[13],目前认为肥胖引起的神经炎症反应是导致痴呆病理损伤的主要原因。为探究高脂饮食诱导神经炎症加重AD病理损伤的具体机制。本研究采用C57BL/6J小鼠和APP/PS1小鼠为动物模型,给予高脂饲料连续喂养6周,观察其体质量增长变化、神经炎症反应、细胞焦亡、神经元病理影响等,结果表明,高脂饮食能引起小鼠脑内炎症反应增强,加重痴呆小鼠脑内神经损伤和功能障碍。
3.1 高脂饮食增强小鼠海马炎症反应,引起神经功能障碍
本研究结果显示,高脂饮食能够引起普通小鼠和痴呆小鼠体质量升高,引起肥胖。与New⁃combe[14]、Medrano-Jiménez[15]、Jena[16]等研究结果相符,高脂饮食能够增强小鼠脑内病理炎症反应。本研究表明高脂饮食能够增加普通小鼠和痴呆小鼠脑内海马区IL-1β、IL-6、TNF-α炎性因子表达,激活痴呆小鼠海马区更多小胶质细胞活化,改变神经元形态,减少胞内尼氏体,影响神经元正常生理功能。对比痴呆小鼠和普通小鼠,痴呆模型小鼠自身脑内具有慢性炎性反应,此结果反映了慢性炎症是引起阿尔兹海默病发病的重要原因之一[17]。Reilly等研究表明HFD喂养5×FAD小鼠加剧海马小胶质细胞表达和炎性反应[11]。本研究表明高脂饮食能够进一步激活APP/PS1痴呆小鼠小胶质细胞,引发更高水平炎性因子表达,进一步加剧神经元损伤,证明相较普通小鼠,高脂饮食对痴呆小鼠脑内小胶质细胞激活负担更重,释放更多炎性因子,破坏脑内环境稳态加剧,进一步损伤神经功能。
3.2 高脂饮食增强痴呆小鼠NLRP3/caspase-1、caspase-1/TUNEL表达,提示诱发神经细胞焦亡
为探究炎症反应在高脂饮食诱发痴呆过程的具体机制,本文研究了高脂饮食对Nod样受体蛋白3(nod-like receptor protein 3,NLRP3)炎性小体激活及caspase-1释放变化情况。NLRP3炎性小体是先天性免疫应答依赖的模式识别受体(pattern-rec⁃ognition receptors,PRR),炎性小体的激活是一组主要的炎性途径[18]。在免疫和炎症细胞中表达。小胶质细胞是脑内固有免疫细胞,而神经元和星形胶质细胞都能够表现强烈的NLRP3炎症反应。NLRP3炎性小体由NLRP3蛋白、衔接蛋白凋亡相关的斑点样蛋白(apoptosis-associated speck-like protein,ASC)和半胱氨酸蛋白酶前体(pro caspase-1)组成[19]。病原相关分子模式(PAMPs)或危险相关分子模式(DAMP)被Toll样受体(TLR)识别后激活NLRP3炎症小体,一些细胞因子如TNF-α也能够引起NLRP3炎性小体的激活[20]。将NLRP3、ASC和pro caspase-1组装成复合物,进而触发pro cas⁃pase-1蛋白水解向caspase-1的转化,产生和分泌成熟IL-1β和IL-18炎症因子,作用后续持久的炎症反应[21]。caspase-1能够介导细胞炎性程序性坏死即细胞焦亡[22]。本研究表明高脂饲料能够增强痴呆小鼠脑内炎症反应和免疫应答,加剧激活NL⁃RP3炎性小体使caspase-1分泌增加。痴呆小鼠海马NLRP3和caspase-1明显高于普通小鼠,高脂饲料喂食痴呆小鼠caspase-1和TUNEL共定位染色增多,进一步说明高脂饮食促进痴呆小鼠神经细胞焦亡,加重脑内神经损伤。后续实验将进一步探讨神经细胞焦亡途径中caspase-1前体、IL-1β前体、IL-1β、IL-18表达变化,为探究神经细胞焦亡途径奠定研究基础。
3.3 结 论
本文初步探讨了高脂饮食诱发神经炎性反应、影响神经功能、加重痴呆的机制,验证了高脂饮食能够增强小鼠脑内免疫应答和炎症反应,加重痴呆小鼠神经细胞焦亡进而加重脑内神经损伤。
