β-淀粉样蛋白对叉头蛋白O3a和突触后致密蛋白95的影响
2021-10-12王欣怡徐江平汪海涛
牛 波,王欣怡,徐江平,汪海涛
(南方医科大学药学院神经药理学科,广东广州510515)
阿尔兹海默病(Alzheimer′s disease,AD)是最为常见的中枢神经系统退行性疾病[1],患者在发病过程中会出现进行性不可逆转性的认知功能和记忆力的下降,最终患者会失去自主生活能力[2]。目前AD的发病机制尚不明确,但普遍存在神经元凋亡及突触蛋白丢失等病理表现。通过前期的基础研究,β淀粉样蛋白(amyloidβ-protein,Aβ)沉积假说是目前学术界较为认可的假说之一[3],由于患者脑内蛋白质水解能力的改变,导致Aβ多肽的异常合成、寡聚和聚集,形成了淀粉样蛋白斑块[4],淀粉样蛋白斑块对神经元有一定的毒性作用,同时可以引起了脑内炎症的激活,从而进一步影响神经元的功 能[5]。叉 头 框 蛋 白O3a(forkhead box protein O3a,FoxO3a)属于叉形头转录因子的O亚型,这一类转录因子的特点是有明显的叉头型DNA结合域;可进入细胞核调控相应基因的转录与翻译,而磷酸化的FoxO3a是其非活性形式[6]。FoxO3a广泛分布于神经系统中[7-8],有研究报道FoxO3a可以调控AD动物模型中神经细胞的凋亡[9];近期也有研究将血清中可检测出的FoxO3a作为早期诊断AD的参考[10];这些研究提示转录因子FoxO3a参与到AD的发病过程中,但是AD患者病理学产物之一Aβ对FoxO3a的作用尚不明确。另一方面,突触后致 密 蛋 白95(postsynaptic density protein 95,PSD95)作为突触的重要组成之一,参与学习过程和记忆的形成[11-12]。PSD95表达量可以一定程度上反映学习记忆功能的受损程度[13]。本研究以体外细胞模型和AD动物模型为研究对象,系统地考察Aβ对FoxO3a及PSD95的作用,同时初步探讨了其可能的机制,为揭示AD的发病机制和探索治疗途径提供新思路。
1 材料与方法
1.1 材 料
PC12细胞,购自中科院细胞库。SPF级健康Sprague Dawley(SD)雄性大鼠26只(6~8周,体质量150~180 g),购自南方医科大学实验动物中心(实验动物合格证号:SCXK(粤)2015-0041);SPF级雄性APPswe/PS1dE9(APP/PS1)转基因小鼠(7月龄,体质量22~25 g)购自南京大学国家遗传工程小鼠资源库。动物合格证号:SCXK(苏)2010-0003,由本实验室繁殖鉴定。大小鼠分别在饲养笼内自由摄食摄水,环境温度(20±2)℃,相对湿度40%~70%。DMEM培养基、Neurobasal培养基、B27、胰酶、多聚赖氨酸、HBSS、胎牛血清(FBS)购自Gibco公司,Aβ25-35(β-淀粉样蛋白片段25-35)购自Sigma-Aldrich公司,RIPA裂解液购自碧云天生物技术有限公司。FoxO3a、磷酸化蛋白激酶B(p-AKT)、磷酸化FoxO3a(p-FoxO3a)抗体购自Cell Signaling公司,PSD95、GAPDH抗体购自Abcam公司,BCA蛋白定量分析试剂盒购自Thermo scientif⁃ic公司。Alexa Fluor 488、DAPI购自Invitrogen公司,PVDF膜、ECL发光液购自Merck Millipore公司,Real Time RT-PCR逆转录试剂盒购自南京诺唯赞有限公司,2×Taq PCR Mastermix及DNA marker购自Gene Star公司。其他试剂均为进口或国产分析纯。
1.2 Aβ25-35的寡聚化
将Aβ25-35粉末在超净台中用无菌PBS配制成浓度为1 mmol/L的母液,放置于37℃的CO2孵箱中孵化7 d;置于4℃冰箱保存,根据实验需求稀释成工作液。
1.3 大鼠皮层神经元的培养
取孕19 d的孕鼠用异氟烷麻醉后,用75%酒精消毒,剪开子宫,小心夹出胎鼠,消毒后,剪下脑袋,用眼科镊取出脑组织,分离皮层组织,用预冷的PBS冲洗后,剥去表面的血管,眼科剪子将组织剪至糜状,加HBSS冲洗干净后,加胰酶消化10 min,加FBS终止消化反应,吸去FBS,加HBSS,反复吹打至分散均匀,经细胞筛过滤,过滤后再吹打均匀,111.8×g离心10 min后洗去上清,加入适量的培养基接种到提前包被多聚赖氨酸的培养板上,置CO2培养箱,6 h后换成神经元培养基(Neuronbasal:B27=50:1),每3天换一半培养基。
1.4 Aβ25-35海马注射
将大鼠随机分成假手术组和模型组,将大鼠腹腔注射水合氯醛麻醉后,将其头部固定在立体定位仪上。沿头背中部纵向切口,碘伏消毒,暴露前囟,参照大鼠脑立体定位仪使用说明,定位左右两侧海马区的坐标:前囟后5.2 mm,旁开4.4 mm。用颅骨钻在坐标点周围环形钻开颅骨,微量注射器自此处缓慢垂直进针4.8 mm,然后将1.5µL Aβ25-35缓慢注入大鼠左右侧海马,留针5 min,再缓慢撤针,缝合切口。假手术组则用同样的方法注射生理盐水。注射完成7 d后进行行为学实验。
1.5 水迷宫实验
将大鼠/小鼠面朝池壁放入水中,4个象限每个象限各放1次,记录动物找到平台的时间,找到后让动物在平台上停留10 s以便记忆,在训练7 d获记忆后,将平台移走,记录在平台所在象限停留的时间和穿越的次数,时长短和次数少的动物学习记忆功能受损。
1.6 RT-PCR实验
按Trizol试剂说明书提取细胞RNA,以OD260/280作为RNA纯度检测的指标,OD260/280在1.9~2.1之间,符合要求可进一步按Prime-Script RT Master Mix试剂盒说明,将5×PrimeScript Buffer、PrimeScript RT Enyzme Mix I、Oligo dT Primer(50µmol/L)和Random 6 meres(100µmol/L)试剂置冰上解冻,RNase-free H2O在室温解冻,按步骤合成cDNA。将引物、cDNA、试剂按比例混匀后,采用PCR扩增试剂盒对cDNA进行扩增。PSD95上游引物:TG⁃CACTATGCTCGTCCCATCATCA,下游引物:TGT⁃GCCTGGATGTCCTTCTCCATT;FoxO3a上游引物:5’-GGAACGUGAUGCUUCGCAATT-3’,下 游 引物:5’-UUGCGAAGCAUCACGUUCCTT-3’,GAP⁃DH上游引物:GCAGTGGCAAAGTGGAGATT,下游引物:ACAGTCTTCTGGGTGGCAGT。在琼脂凝胶上每孔加入1.5~2µL的各组样品和Maker进行电泳,完成后统计结果。
1.7 Western Blot免疫印迹法
细胞采用预冷的细胞裂解液(含1%蛋白酶抑制剂和1%磷酸酶抑制剂)进行振荡裂解,组织样品在加入上述裂解液后采用超声裂解。裂解完成后采用BCA蛋白定量试剂盒进行蛋白定量后,样品加入裂解液和上样缓冲液稀释至终浓度1µg/µL,煮沸10 min后备用。样品随后分别加入到聚丙烯酰胺SDS凝胶孔中,80 V电泳后完成后,转至PVDF膜上;5%脱脂牛奶封闭1 h,一抗稀释液孵育4℃过夜;将TBST缓冲液洗脱3次后,二抗稀释液孵育2 h;TBST洗脱后,滴加发光液曝光。
1.8 免疫荧光
将PC12细胞接种于共聚焦小皿中,Aβ25-35处理后,弃培养基,40 g/L的多聚甲醛固定20 min,Tri⁃tonX-100室温孵育20 min,5%的FBS室温封闭1 h,一抗溶液4℃孵育过夜后,荧光二抗溶液室温避光孵育1 h,DAPI溶液室温孵育15 min,滴加防荧光淬灭剂封片后,于共聚焦荧光显微镜下观察。
1.9 统计分析
所有实验数据均采用均数±标准误描述,数据由Graphpad Prism 8.0软件进行统计分析。实验设计分组是两组数据时,如果每一组资料都呈正态分布并且方差齐性,组间比较采用t检验,反之用校正t检验或秩和检验。多组均数比较,若各组定量资料都呈正态分布并且方差齐性采用One way-ANO⁃VA进行分析,反之则用Kruskal WallisH检验。不满足方差齐性的情况时,采用Welch′s anova方法分析。柱状图采用GraphPad Prism8.0软件绘制。
2 结果
2.1 Aβ25-35在PC12细胞中降低PSD95的表达且增加FoxO3a的表达
如图1A、B、C所示,梯度浓度(5、10、20µmol/L)的寡聚化的Aβ25-35处理PC12细胞24 h,Western Blot的结果显示Aβ25-35可以浓度依赖性地降低PSD95的蛋白水平的表达量和增加FoxO3a蛋白的表达。20µmol/L Aβ25-35处理时,PSD95蛋白表达量下调至(45.09±1.61)%(F=7.487,P=0.054 0)。FoxO3a的蛋白表达的上调则在20µmol/L Aβ25-35处理时有统计学差异(F=17.48,P=0.021 0),是对照组表达量的(228.7±20.4)%。图1D是Aβ25-35处理PC12细胞后对PSD95蛋白的染色结果,绿色荧光标记PSD95,蓝色为DAPI染色,免疫荧光的结果与Western blot的结果一致,Aβ25-35处理组的绿色荧光强度变弱,提示PSD95表达下调。而如图1E所示,同样用免疫荧光的方法检测了Aβ25-35处理后FoxO3a的亚细胞定位,结果显示Aβ25-35有促进FoxO3a进入细胞核的作用。以上结果提示Aβ25-35在引起PC12细胞突触受损的同时促进了FoxO3a的表达和进核。

图1 β淀粉样蛋白在PC12细胞中对PSD95和FoxO3a表达的影响Fig.1 Effects of Aβ25-35 on the expression of PSD95 and FoxO3a in PC12 cells
2.2 Aβ25-35在神经元中对PSD95及FoxO3a表达的影响
为进一步证实在PC12细胞中获得的结果,我们培养了体外的原代神经元(图2A)。在神经元中用同样梯度浓度的寡聚化的Aβ25-35(5~20µmol/L)去处理24 h。结果如图2B、C、D所示,PSD95的蛋白表达量随Aβ25-35浓度增加而下降,在剂量20µmol/L时与对照组相比有统计学差异(F=5.445,P=0.015 3),此时PSD95的表达量下调至(53.52±3.85)%,而Aβ25-35的处理也浓度依赖性地增加FoxO3a的表述,在20µmol/L浓度时即可上调FoxO3a至(314.9±31.51)%(F=17.46,P=0.019 7)。此结果与PC12细胞中获得的结果一致,提示Aβ25-35在神经元中引起突触损伤的同时可促进FoxO3a的表达。
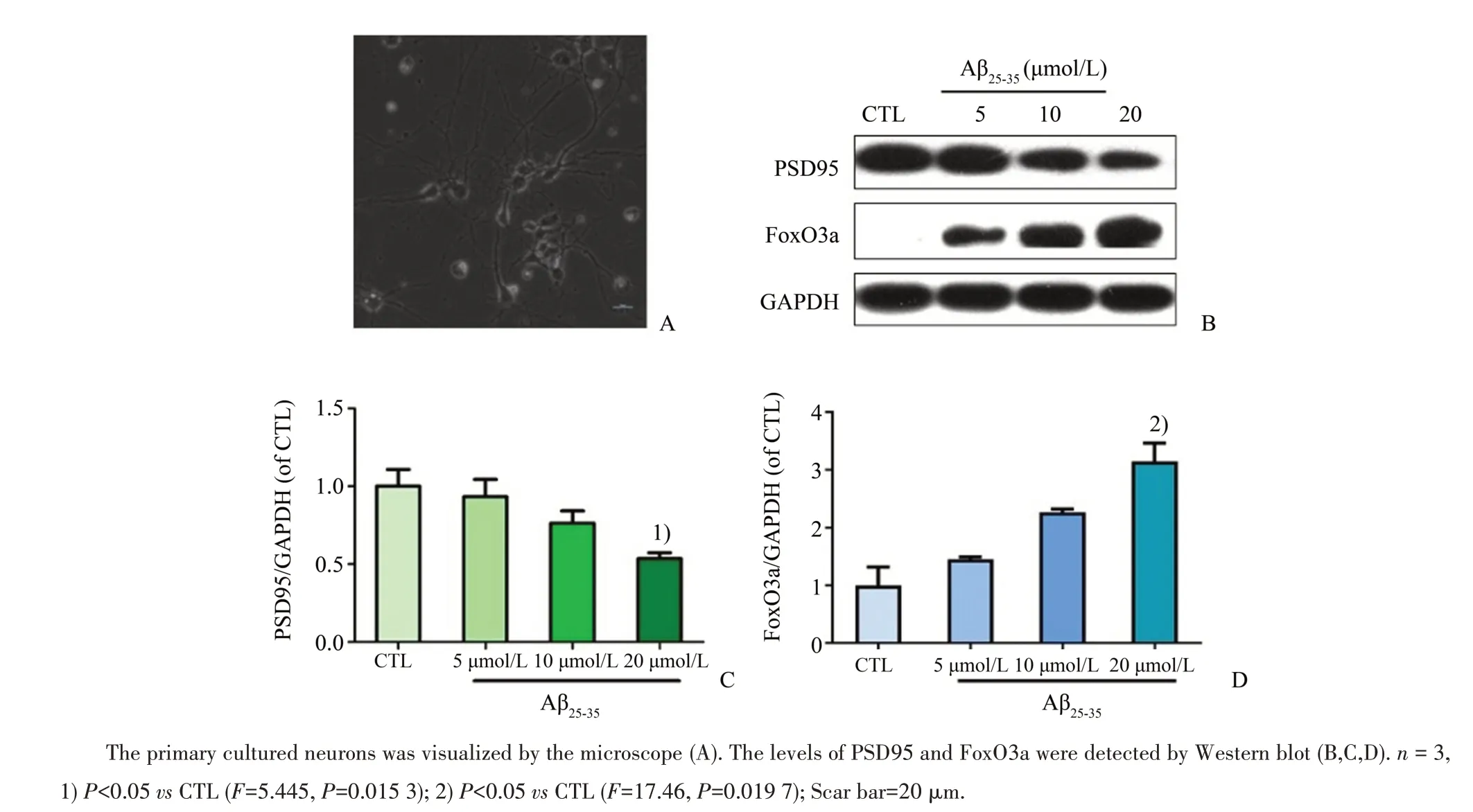
图2 β淀粉样蛋白在神经元中对PSD95和FoxO3a的影响Fig.2 Effects of Aβ25-35 on the expression of PSD95 and Foxo3a in neurons
2.3 Aβ25-35立体定位注射的AD大鼠模型中FoxO3a的表达增加
在SD大鼠的海马组织中立体定位注射寡聚化的Aβ25-35后对假手术组和模型组进行水迷宫训练,第8天进行探索性实验,实验结果如图3A、B所示:对照组的目标象限的探索实践为(31.56±2.17)s,Aβ25-35组的时长为(24.35±1.29)s,组间对比有统计学差异(F=2.843,P=0.098);对照组在目标象限的穿越次数为(5.31±0.91)次,而Aβ25-35组的穿越次数为(2.53±0.49)次(F=3.459,P=0.014 9),水迷宫的实验结果表明Aβ25-35引起了大鼠的认知障碍。RTPCR法检测海马组织中PSD95的mRNA水平,结果如图3C、D、E所示,与行为学结果一致,PSD95的mRNA显著下降至对照组的(58.40±8.28)%(F=1.193,P=0.010 1),同时FoxO3a的mRNA水平升高至(140.9±7.45)%(F=2.378,P=0.049 6),说明在Aβ25-35注射的在体AD模型中,突触功能受损的同时FoxO3a的表达水平上调,注射Aβ25-35的动物模型的结果与细胞模型中趋势一致。
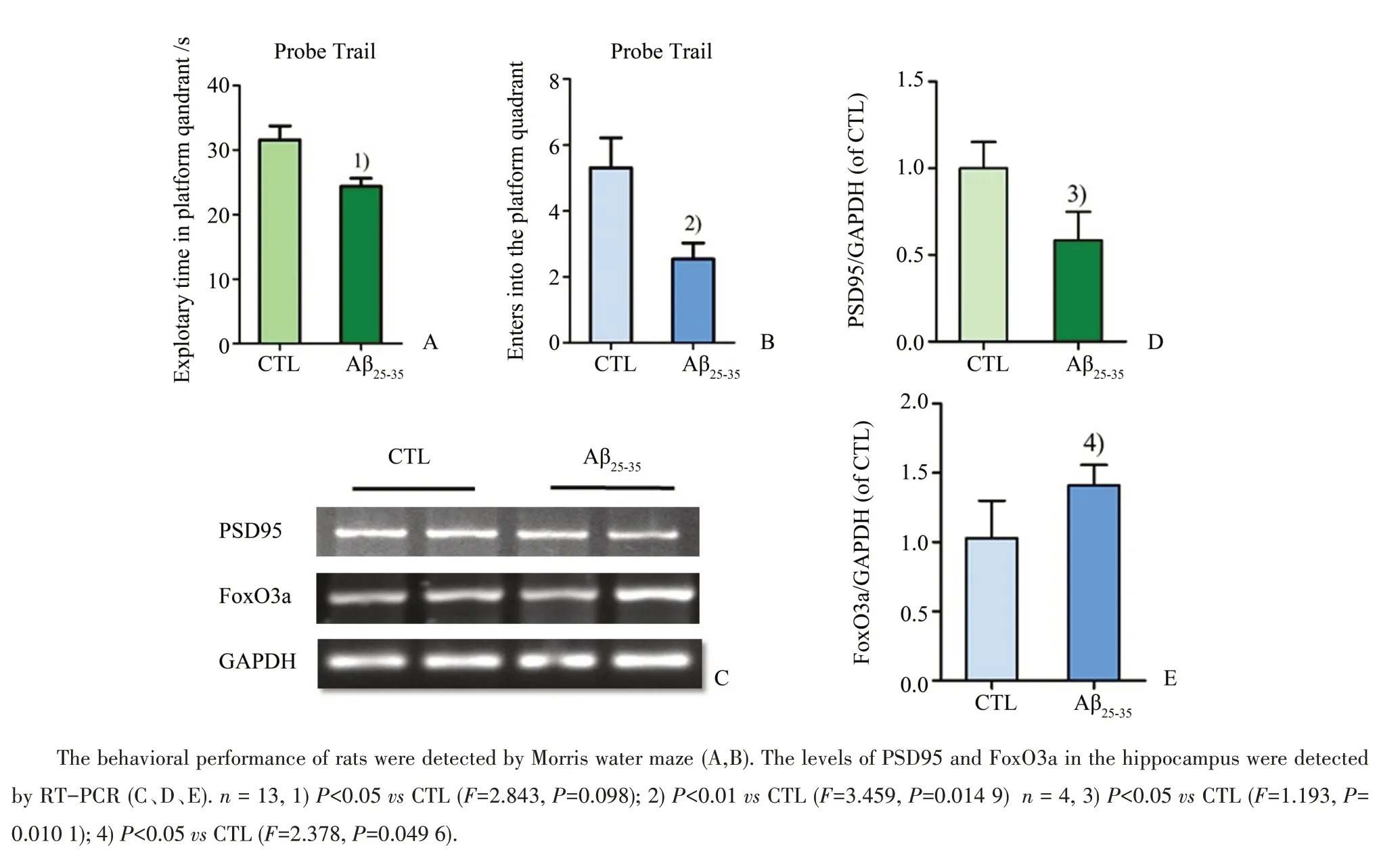
图3 在Aβ25-35注射的大鼠模型中β淀粉样蛋白对PSD95和FoxO3a的影响Fig.3 Effects of Aβ25-35 on the expression of PSD95 and FoxO3a in Aβ25-35-injected rats
2.4 APP/PS1转基因小鼠脑组织中FoxO3a及PSD95表达的变化
APP/PS1转基因小鼠是AD的动物模型。野生型和APP/PS1转基因小鼠在水迷宫实验训练如图4A所示。探索性的结果如图4B,野生型小鼠在目标象限的穿越次数为(4.91±0.81)次,APP/PS1转基因小鼠的穿越次数是(2.6±0.58)次,与野生型组相比显著下降(F=2.158,P=0.033 3)。在目标象限的停留时间如图4C所示野生型小鼠为(30.47±2.23)s,而APP/PS1转基因小鼠的探索时间为(17.32±2.08)s,组间对比具有统计学差异(F=1.265,P=0.000 4)。行为学实验结果表明7月龄的转基因小鼠表现出明显的认知障碍。进一步用RT-PCR法和Western Blot的方法检测野生型和转基因小鼠脑组织中PSD95和FoxO3a的表达情况。结果如图4D所示,与野生型组相比,转基因小鼠中的PSD95的mRNA水平下降至对照组的(60.89±1.53)%(F=20.05,P=0.008 8),而蛋白表达量水平为野生型组的(59.63±13.55)%,具有统计学差异(F=8.496,P=0.044 5),与行为学中表现出的记忆认知障碍相符。在检测突触相关蛋白PSD95的表达量变化的同时,图G所示在转基因小鼠脑组织中FoxO3a的mRNA是野生型小鼠表达量的(172.4±4.87)%,有统计学差异(F=2.351,P=0.000 4),而对应的蛋白水平是野生型组的(235±39.03)%(F=2.754,P=0.032 0),这进一步说明β-淀粉样蛋白在降低突触相关蛋白PSD95表达量的同时,上调了FoxO3a的表达水平。
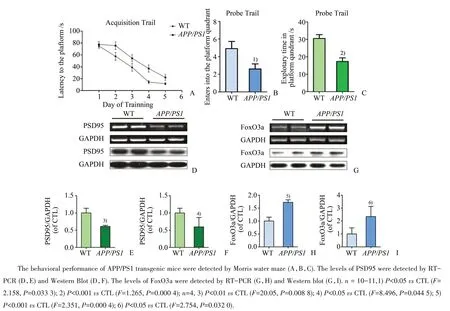
图4 在APP/PS1转基因小鼠脑组织中β淀粉样蛋白对PSD95和FoxO3a的影响Fig.4 The levels of PSD95 and Foxo3a in the brain of APP/PS1 transgenic mice
2.5 Aβ对AKT及FoxO3a磷酸化的影响
在上述实验结果中我们发现,Aβ可以增加体外神经细胞模型中FoxO3a的表达量,与此同时在体内模型中也可以上调FoxO3a的表达水平。已经证实磷酸化的AKT可以增加FoxO3a的磷酸化水平,降低FoxO3a的活性,那么β-淀粉样蛋白上调FoxO3a表达的作用是不是通过介导AKT磷酸化而实现的呢?如图5A所示,用20µmol/L的寡聚化的Aβ25-35处理PC12细胞,Western Blot方法检测不同处理时间点(5、10、20和40 min)p-AKT的量,发现随着处理时间的增加,AKT的磷酸化水平降低,在处理时间为40 min时AKT的磷酸化水平为对照组的(37.64±11.92)%,有统计学差异(F=6.553,P=0.042 6)。与此同时,如图5B所示,FoxO3a的磷酸化水平与AKT的磷酸化水平变化趋势一致,在处理时间为10 min有统计学差异,p-FoxO3a的量是对照组的(41.43±9.49)%(F=44.88,P=0.041 4)。此外,图5C、D所示APP/PS1转基因小鼠中脑组织中的p-AKT的下降为对照组的(65.75±3.51)%(F=6.362,P=0.023 6),而p-FoxO3a的表达量下降至对照组的(46.62±9.64)%(F=8.562,P=0.007 9)。综上结果,在细胞模型和动物模型中,Aβ都可以降低AKT和FoxO3a的磷酸化水平。

图5 Aβ在体内、外模型中抑制AKT及FoxO3a磷酸化水平Fig.5 Aβinhibited the phosphorylation of Akt and FoxO3a both in in vitro and in vivo models.
3 讨论
为了考察异常沉积的β淀粉样蛋白对核转录因子FoxO3a的作用,本研究首先从体外细胞模型入手,选取了操作方便可重复性强的PC12细胞。β淀粉样蛋白的前体是淀粉样前体蛋白(amyloid pre⁃cursor protein,APP),APP是一种广泛存在于细胞膜上的蛋白,APP本身无毒,只有在被分泌酶裂解后产生了β淀粉样蛋白沉积后,才会对中枢神经元有毒性作用[14-15]。本研究中为了确保β淀粉样蛋白产生并且有一定的毒性作用,将突触后膜蛋白PSD95作为神经元功能正常的标志物,学习认知能力的下降受损伴随着PSD95表达量的减少[16-17]。本研究中采用37℃孵育7 d的方法去制备寡聚化的Aβ25-35,在处理24 h后,在神经元细胞系和体外培养的神经元中的结果都显示寡聚化的Aβ25-35可以浓度依赖性的减少PSD95蛋白的表达,提示体外寡聚化的Aβ25-35处理可以模拟阿尔兹海默的发病过程。同时,相应组别的FoxO3a的表达量浓度依赖性的上调。这些结果提示Aβ25-35处理PC12细胞及原代神经元会导致FoxO3a及PSD95的变化,但这些变化是一个伴随过程还是一个有因果关系的事件,值得进一步的研究。
在体外细胞模型上证实了Aβ可以促进核转录因子Foxo3a的表达以及降低PSD95的表达,那么在体内模型中Aβ是否有相同的作用呢?实验设计将寡聚化的Aβ25-35立体定位注射大鼠海马造模[18],选择大鼠进行Aβ25-35海马注射的主要是因为术后大鼠的存活率高于小鼠。在水迷宫实验中,模型组大鼠表现出明显的记忆认知障碍的同时也同样检测到海马组织中PSD95表达量下降,这与认知功能受损的分子生物学上的变化相符。进一步检测模型组海马中的FoxO3a的表达量,与假手术比模型组显著增加,说明在体内环境中,Aβ同样促进核转录因子FoxO3a的表达。利用体外立体定位在海马区注射的方法主要是在脑组织中加入外源性的Aβ,那么在体内环境中增加内源性的Aβ,是否也会影响FoxO3a和PSD95表达呢?本研究中采用了APP/PS1转基因小鼠模型[19]。文献报道Aβ是由APP基因编码产生的,APP蛋白经过蛋白水解作用可产生Aβ,Aβ在正常生理状态下存在于血液和脑脊液中[20]。但是病理状态下如AD患者脑组织中出现大量Aβ沉积,这种异常的蛋白沉积对神经元产生毒性。前期的基础研究发现:在家族性AD患者有多个APP基因的突变位点,APP突变可改变APP的水解代谢过程,导致具有神经毒性作用的Aβ沉积产生,并引发包括神经炎症在内的多种病理机制,进一步促进神经细胞凋亡或死亡,因神经元不可逆的受损,患者会出现认知障碍和记忆功能下降。而PS1基因编码的PS蛋白是γ分泌酶的重要组成部分,在生成Aβ的过程中起重要作用。PS1基因的突变是另一个引起家族性AD的主要原因之一。本实验中所选用APPswe/PS1dE9转基因小鼠能较为真实地模拟β淀粉样蛋白引起的AD的发病过程[21]。APP/PS1转基因小鼠一般在6-7月龄开始表现出较为明显的认知功能障碍[22]。将7月龄的野生型和转基因小鼠进行行为学检测,结果与文献报道一致,APP/PS1小鼠的认知功能明显受损,同时转基因小鼠脑组织中的PSD95表达量与野生型组相比显著下调,并伴随着FoxO3a表达量的增加。由此通过对“外源性”和“内源性”的Aβ聚集的两种动物模型脑组织中FoxO3a的检测,发现两种模型中FoxO3a的水平皆上调,与细胞模型中Aβ的作用相同。与此同时,也有文献报道Aβ可以通过调节FoxO3a激活NF-κB的中枢神经系统中经典炎症通路[23],脑内的神经炎症假说也逐渐成为近年来AD研究热点之一。此外APP蛋白的胞内肽段可以激活FoxO3a从而阻止海马神经元的神经发生[24],神经发生在神经退行性疾病和颅脑损伤的治疗方面也有着重要意义。文献报道与本研究结果都提示核转录因子FoxO3a与AD的发病过程关系密切。
无论是体外还是体内模型中,Aβ都可以促进FoxO3a的表达,但是其机制却尚不明确。AKT可通过磷酸化生成p-AKT,p-AKT是激活模式,有文献报道AKT已经被证实是FoxO3a的上游信号通路之一[25-26],p-AKT可以 磷酸 化FoxO3a,上 调p-FoxO3a的表达量,而p-FoxO3a是非“激活”状态,p-FoxO3a无法进入细胞核与DNA结合,继而对下游的基因发挥调控作用。为了研究β淀粉样蛋白上调FoxO3a水平作用是否是通过介导AKT磷酸化实现的,本研究中采用了20µmol/L的Aβ去处理PC12细胞不同时间,发现随着时间的增加,Aβ25-35可以减少p-AKT的量,同时,p-FoxO3a的量也随处理时间增长而降低。而在体内环境中,与野生型相比,APP/PS1转基因小鼠的脑组织中p-AKT和p-FoxO3a的量都显著下降。本研究结果提示β淀粉样蛋白可能是通过降低AKT磷酸化水平从而去磷酸化FoxO3a,上调FoxO3a的表达水平。AKT除了可以直接通过FoxO3a影响下游基因转录外,实际上还参与到神经元内功能蛋白的合成,突触可塑性的形成以及神经元在疾病模型中功能的改变等过程中[27]。PSD95作为突触后致密蛋白,维持着突触间信息的传递和突触可塑性的形成。在中枢神经系统疾病如抑郁症和AD模型的动物模型脑组织中都能观察到PSD95的表达量的下降。有研究报道,在抑郁症模型p-AKT的水平低于生理状态下水平,而激活AKT可以提高PSD95的水平,改善突触功能同时增强长时程增强[28]。在实验结果也发现Aβ处理的细胞模型和APP/PS1转基因小鼠脑组织中的AKT的磷酸化下调,而PSD95的表达量也下降,与文献报道的趋势一致,说明AKT也参与到AD的发病过程中。但Aβ及AKT通过怎样的途径影响PSD95的表达还需进一步研究。另外,FoxO3a在Aβ对PSD95的调控中发挥怎样的作用,值得深入研究。通过鉴定PSD95的启动子区是否存在FoxO3a转录因子的结合位点,并通过双荧光素酶报告基因和点突变实验有利于研究该问题。同时还可通过转染组成性激活的AKT(constitutively ac⁃tive AKT)来研究Aβ是否通过AKT/FoxO3a途径来调控PSD95的表达。
综上,β淀粉样蛋白无论在体外细胞模型还是在体内模型中都可以降低PSD95的表达,同时上调转录因子FoxO3a的水平,并可能是通过介导AKT磷酸化水平实现的对PSD95和FoxO3a的作用。
